预后营养指数联合系统免疫炎症指数对预测食管鳞癌根治性同步放化疗/放疗患者生存的临床价值*
2022-03-29张榕珂李涛吕家华肖苓陈泰聿张杭月唐淳瀚
张榕珂,李涛,吕家华,肖苓,陈泰聿,张杭月,唐淳瀚
646000 四川 泸州,西南医科大学 临床医学院 (张榕珂、李涛、张杭月); 610041 成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 胸部放疗科 (李涛、吕家华、肖苓); 610500 成都,成都医学院 临床医学院 (陈泰聿、唐淳瀚)
我国食管癌的发病率和死亡率均居全球首位, 主要类型是食管鳞癌(esophageal squamous cell carcinoma,ESCC)[1-2]。60%~70%的食管癌患者就诊时已属中晚期,其标准治疗模式为同步放化疗(concurrent chemoradiotherapy,CCRT)或放疗(radiotherapy,RT),但5年生存率仅30%左右[3-4]。因此,迫切需要寻找能够准确预测接受CCRT或RT的ESCC患者不良结局的预后指标,来指导个体化治疗。多项研究表明,免疫、炎症和营养在肿瘤的发生发展和患者预后中发挥着至关重要的作用[5-9]。血小板与淋巴细胞比例、中性粒细胞与淋巴细胞比例是反映患者全身炎症状态的重要标志物,既往已被用于预测多种恶性肿瘤的预后[10-11]。与上述所提及的预后标志物不同的是,系统免疫炎症指数(systemic immune-inflammatory index,SII)由血小板、中性粒细胞、淋巴细胞计数这3个指标组成,反映了机体的免疫和炎症状态,并被证明是肝细胞癌、胃癌、食管鳞状细胞癌等恶性肿瘤的有效预后指标[12]。预后营养指数(prognostic nutritional index,PNI)可以在一定程度上代表机体的营养状况和全身免疫能力,且PNI已被证实与多种实体肿瘤的不良预后有关,特别是消化道肿瘤[13-14]。基于此,Zhang等[15]联合了PNI与SII,证实其在接受手术的ESCC患者预后中的价值,进一步指导了接受手术的ESCC患者的治疗。然而,目前国内外尚未见到关于PNI联合SII是否可以准确预测行根治性CCRT/RT的ESCC患者的预后价值相关研究。因此,本文探索了这一纳入了4种血液学指标的联合指标(PNI+SII)能否预测接受CCRT/RT的ESCC患者预后,同时还对PNI、SII和PNI+SII预测患者预后的效果进行了比较。
1 资料与方法
1.1 临床资料
本研究所有调查均依据《赫尔辛基原则宣言》及其修正案进行。该研究由四川省肿瘤医院伦理委员会审核批准。回顾性分析了2012年3月至2018年7月在四川省肿瘤医院接受根治性CCRT/RT的206例ESCC患者的临床资料。纳入标准:1)经组织病理学确诊为ESCC;2)拒绝或无法忍受手术;3)KPS评分≥70分;4)计划靶区(PTV)接受的调强放射治疗剂量≥50 Gy[16];5)治疗前1周有完整血常规及生化资料;6)按照美国癌症联合委员会(AJCC第八版,2018)发布的TNM分类系统进行分期。排除标准:1)在外院已行抗肿瘤治疗者;2)远处转移或合并第二原发肿瘤者;3)CCRT/RT后行肿瘤切除手术者;4)临床资料不完整或缺失者;5)有严重肝肾功能障碍、血液系统疾病、自身免疫性疾病者。
1.2 治疗方案
本研究所有患者均接受根治性放射治疗,外照射采用适形调强放射治疗技术。根据颈-胸-腹CT、胃镜及PET-CT确定肿瘤病灶与阳性淋巴结的位置。所需勾画的靶区包括大体肿瘤靶体积(gross tumor volume,GTV)、临床靶体积(clinical tarset volume,CTV)和计划靶区(planning target valume,PTV)。GTV定义为原发肿瘤(primary gross tumor volume,GTVp)和任何阳性的区域淋巴结(nodal gross tumor volume,GTVn)。CTV定义为GTV向前后左右均外扩0.8~1.0 cm,而向上和向下各外扩3 cm。PTV是指CTV向各个方向均匀外扩0.5 cm。RT方案:总剂量(PTV)≥50 Gy,2 Gy/次/天。
接受同步化疗的患者采用以铂类为基础的1~5个周期的联合化疗: 1)TP方案 (紫杉醇+顺铂); 2)TC方案 (紫杉醇+卡铂); 3)DP方案 (多西他赛+顺铂)。对于一般情况差,不能耐受静脉化疗的老年患者予以1~3周期的口服化疗 (替吉奥/卡培他滨)。
1.3 PNI、SII和PNI+SII的构建
采集治疗前1周内的血液样本,进行血液生化、血常规分析。PNI的计算公式为:PNI=SAL(g/L)+5×TLC(109/L);SII的计算公式为:SII=PC(109/L)×NC(109/L)/LC(109/L)。其中SAL为血清白蛋白水平,TLC为总淋巴细胞计数,PC为血小板计数,NC为中性粒细胞计数,LC为淋巴细胞计数。此外,为进一步寻找能够更好预测ESCC患者总生存期(overall survival,OS)的标志物,我们提出将PNI+SII作为指标。首先,利用受试者工作特征(receiver operating characteristic,ROC)曲线获得PNI、SII最佳截断值,再结合格拉斯哥预后评分(glasgow outcome scale,GOS)构建联合评价指标PNI+SII。
1.4 随访
所有患者均通过门诊或住院检查,由训练有素的医生进行电话随访。从患者放化疗结束后的2年内每3个月随访一次,2~5年每6个月随访一次,5年以后每年随访一次。末次随访时间是2021年6月22日。OS定义为从病理诊断到死亡或末次随访时间。中位随访时间为50个月(20~107个月)。
1.5 统计分析
临床资料由SPSS 26.0、GraphPad Prism 8.3软件进行分析。采用ROC曲线来确定PNI和SII的最佳截止值。正态分布的变量比较采用t检验或方差分析,非正态分布的变量比较采用Mann-Whitney U检验。分类变量采用卡方检验或Fisher精确检验进行比较。采用Kaplan-Meier法和Log-Rank检验计算OS率。Cox比例风险模型用于单因素及多因素分析,以检验影响OS的潜在临床因素。双尾P<0.05代表差异有统计学意义。
2 结 果
2.1 患者临床特征
本研究共206例根治性CCRT/RT的ESCC患者符合纳入标准,确诊时中位年龄为64岁(范围34~86岁),男性157例(76.21%),女性49例(23.79%);113例(54.85%)有吸烟史,111例(53.88%)有饮酒史;肿瘤多位于食管胸上段(80例,38.83%)和胸中段(84例,40.78%),较少位于颈段(19例,9.22%)和胸下段(23例,11.17%);中位肿瘤长度为5 cm。其中174例(84.47%)患者在RT的基础上接受同步化疗(表1)。77例(37.38%)行TP方案,25例(12.14%)行TC方案,50例(24.27%)行DP方案,16例(7.77%)口服替吉奥,6例(2.91%)口服卡培他滨。中位随访时间为50个月(20~107个月)。关于RT的剂量,187例(90.8%)接受大于60 Gy的剂量。
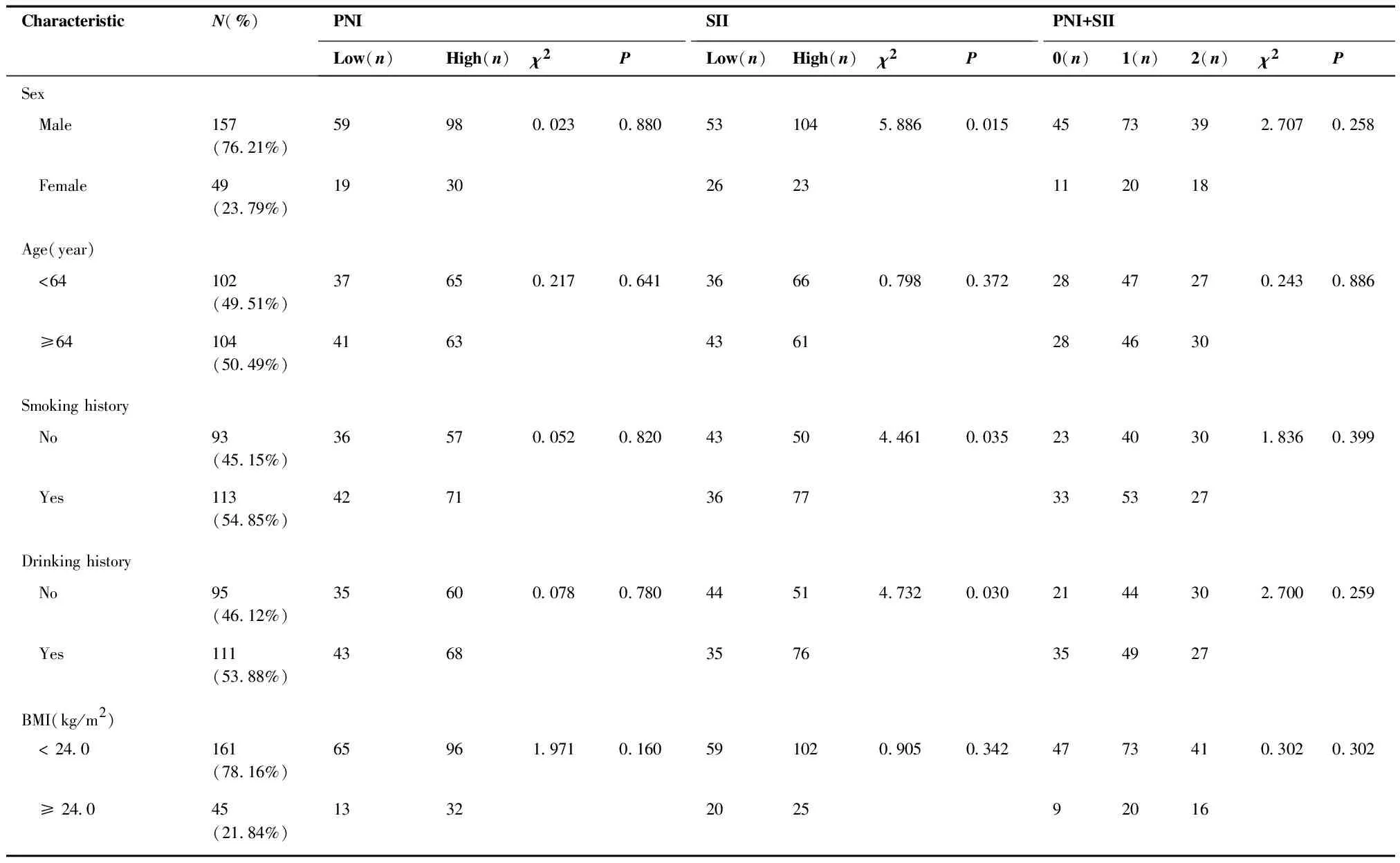
表1 206例食管鳞癌患者的基本情况以及PNI,SII,PNI+SII与临床特征的关系

CharacteristicN(%)PNISIIPNI+SIILow(n)High(n)χ2PLow(n)High(n)χ2P0(n)1(n)2(n)χ2PKPS score 709(4.37%)45-0.180∗54-0.514∗324-0.270∗ 80101(49.03%)32693962225029 9096(46.60%)42543561314124Tumor location Cervial19(9.22%)9106.5030.090514-0.459∗6112-0.083∗ Upper thoracic80(38.83%)31492951243422 Middle thoracic84(40.78%)25593747193431 Lower thoracic23(11.17%)13108157142Tumor length (cm) < 5.083(40.29%)27561.6810.19539444.3880.0361541275.9890.050 ≥ 5.0123(59.71%)51724083415230T stage T2-T3102(49.51%)30726.1350.01348546.4820.01116523413.6920.001 T4104(50.49%)48563173404123N stage N0-N2168(81.55%)601081.7890.181641040.0250.8754280462.8600.239 N338(18.45%)18201523141311TNM stage II-III121(58.74%)39823.9550.04752692.6540.1032460378.0050.018 IV85(41.26%)39462758323320RT dose (Gy) < 6019(9.22%)1275.6920.0178110.1250.724793-0.405∗ ≥ 60187(90.78%)6612171116498454Chemotherapy No32(15.53%)18145.4430.02010220.8080.369141265.4040.067 Yes174(84.47%)6011469105428151
2.2 PNI与SII
PNI与SII的ROC曲线见图1。当约登指数最大时,得到最佳截断值。PNI的最佳截断值为47.8,敏感度为44.3%,特异度为76.8%,ROC曲线下面积(area under the curve,AUC)为0.595(95%CI:0.51~0.68,P<0.05)(图1)。SII的最佳截断值为400.76,敏感度为66.7%,特异度为51.8%,ROC曲线下面积为0.615(95%CI: 0.529~0.702,P<0.05)(图1)。为进一步分析,根据截断值将患者分为两组进行研究:高PNI组(PNI≥47.8),低PNI组(PNI<47.8);高SII组(SII≥400.76),低SII组(SII<400.76)。PNI、SII与临床特征间的关系见表1, 低PNI组与高PNI组在T分期、临床分期、放疗剂量、是否化疗上存在差异(P<0.05), 低SII组与高SII组在性别、吸烟史、饮酒史、肿瘤长度、T分期上存在差异(P<0.05),PNI+SII=0、1、2在T分期、临床分期上存在差异(P<0.05)。此外, 低PNI组和高SII组的OS分别显著低于高PNI组(P<0.001)和低SII组(P=0.001) (图2、3)。

图1 PNI、SII、PNI+SII预测ESCC患者预后的ROC曲线

图2 Kaplan-Meier生存曲线显示了ESCC患者高PNI组和低PNI组之间的差异
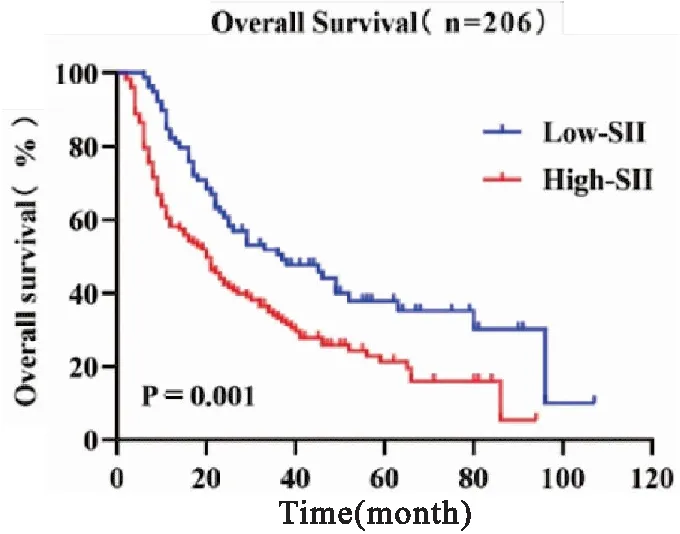
图3 Kaplan-Meier生存曲线显示了ESCC患者高SII组和低SII组之间的差异
2.3 单因素和多因素生存分析
通过单因素分析,我们发现以下7个与ESCC患者OS显著相关的因素:饮酒史(P=0.007)、T分期(P=0.001)、N分期(P=0.006)、TNM分期(P=0.003)、化疗(P=0.025)、PNI(P<0.001)、SII(P=0.001)。COX回归分析显示,PNI(HR=0.631,95%CI:0.448~0.887,P=0.008)和SII(HR=0.632,95%CI:0.441~0.905,P=0.012)是影响OS的独立预后因素(表2)。

表2 影响ESCC患者预后的单因素及多因素分析
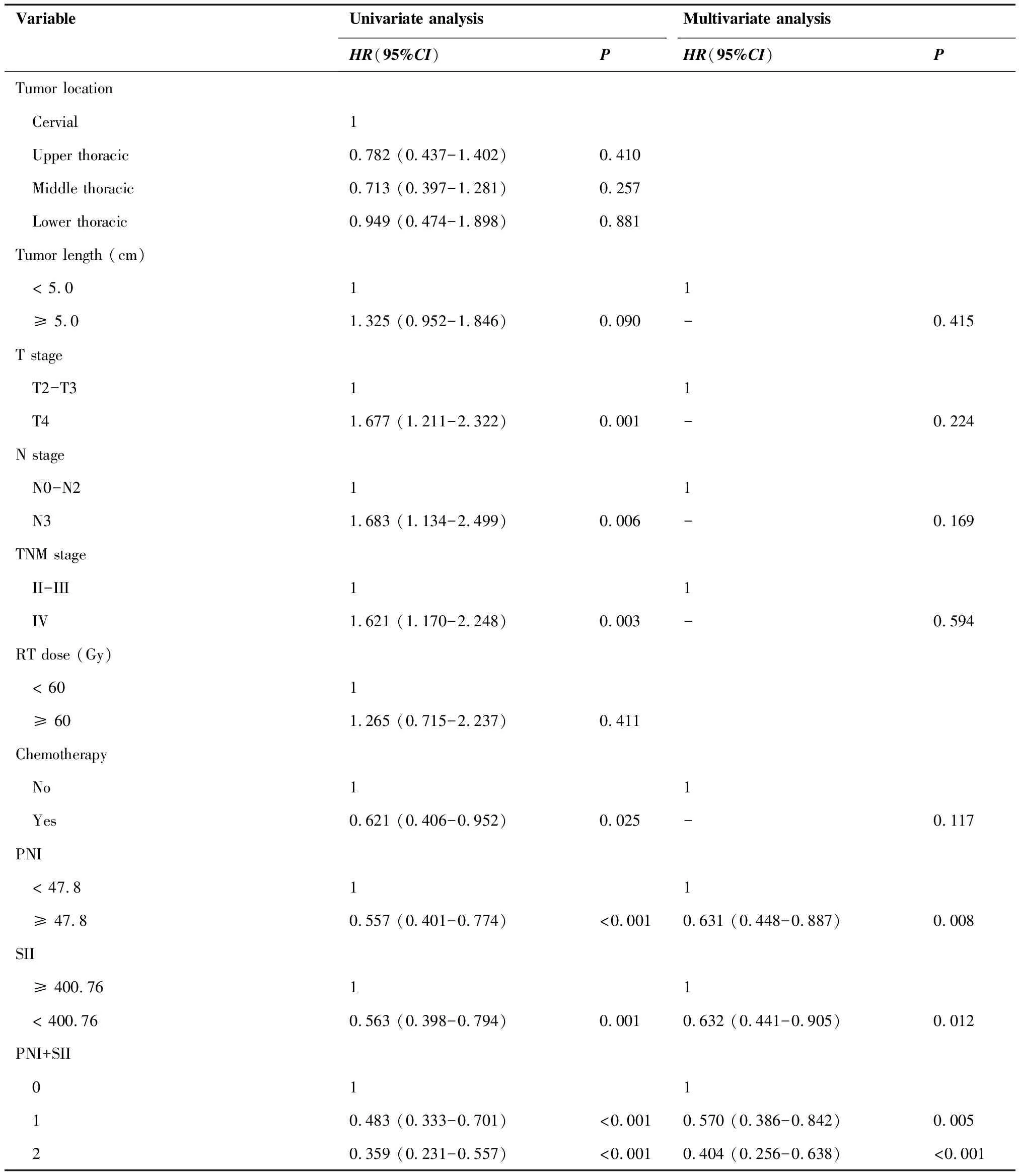
VariableUnivariate analysisMultivariate analysisHR(95%CI)PHR(95%CI)PTumor location Cervial1 Upper thoracic0.782 (0.437-1.402)0.410 Middle thoracic0.713 (0.397-1.281)0.257 Lower thoracic0.949 (0.474-1.898)0.881Tumor length (cm) < 5.011 ≥ 5.01.325 (0.952-1.846)0.090-0.415T stage T2-T311 T41.677 (1.211-2.322)0.001-0.224N stage N0-N211 N31.683 (1.134-2.499)0.006-0.169TNM stage II-III11 IV1.621 (1.170-2.248)0.003-0.594RT dose (Gy) < 601 ≥ 601.265 (0.715-2.237)0.411Chemotherapy No11 Yes0.621 (0.406-0.952)0.025-0.117PNI < 47.811 ≥ 47.80.557 (0.401-0.774)<0.0010.631 (0.448-0.887)0.008SII ≥ 400.7611 < 400.760.563 (0.398-0.794)0.0010.632 (0.441-0.905)0.012PNI+SII 011 10.483 (0.333-0.701)<0.001 0.570 (0.386-0.842)0.005 20.359 (0.231-0.557)<0.001 0.404 (0.256-0.638)<0.001
2.4 PNI+SII在根治性CCRT/RT的ESCC患者中的预后价值
如上所述,我们的研究证明了PNI和SII都是ESCC患者的独立预后指标。然而,为更好地预测ESCC患者的预后,我们根据表3所示的GOS构建了PNI+SII模型。在我们的模型中,根据不同评分将患者分为三组:低SII、高PNI为2分组,高SII、高PNI或低SII、低PNI均为1分组,高SII、低PNI为0分组(表3)。此外, 绘制ROC曲线得到PNI+SII的AUC为0.640(95%CI: 0.56~0.72,P<0.05),敏感性为34%,特异性为91.1%(图1)。

表3 PNI+SII联合评分表
通过Kaplan-Meier法(图4)和Cox比例风险模型(表2)进一步评估PNI+SII作为根治性CCRT/RT的ESCC患者的独立预后因素。单因素Cox比例风险模型的结果如下:PNI+SII=1(HR=0.483,95%CI:0.333~0.701,P<0.001),PNI+SII=2(HR=0.359,95%CI:0.231~0.557,P<0.001)。多因素Cox比例风险模型的结果如下:PNI+SII=1(HR=0.570,95%CI:0.386~0.842,P=0.005),PNI+SII=2(HR=0.404,95%CI:0.256~0.638,P<0.001)。206例ESCC患者中位OS为23.5个月。在PNI+SII模型中,评分较高组的OS优于评分较低组(P<0.001;图4),PNI+SII=0、1、2的中位OS分别为11个月、27个月、33个月。PNI+SII=0组患者中,1年、2年、3年、5年和7年的OS分别为44.6%,26.8%,21.0%,7.9%和0;PNI+SII=1组患者中,1年、2年、3年、5年和7年OS分别为73.1%,54.5%,44.3%,30.8%和25.2%;PNI+SII=2组患者中,1年、2年、3年、5年和7年OS分别为80.7%,63.2%,50.7%,41.7%和33.0%。

图4 Kaplan-Meier生存曲线显示ESCC患者在不同PNI+SII评分组之间的差异
实验结果表明PNI+SII的敏感性和特异性分别为34%和91.1%。此外,绘制ROC曲线比较PNI、SII和PNI+SII对患者预后的预测能力。如图1所示,PNI、SII和PNI+SII的AUC分别为0.595(95%CI:0.51~0.68,P<0.05)、0.615(95%CI:0.529~0.702,P<0.05)和0.640(95%CI:0.56~0.72,P<0.05)。因此,我们可以看出PNI+SII相比PNI和SII,其AUC分别提高了4.5%和2.5%。这表明相较于PNI或SII,PNI+SII是接受CCRT/RT ESCC患者更具价值的预后预测指标。
3 讨 论
既往关于PNI、SII的预后价值相关研究人群都是针对行手术治疗的肿瘤患者[15,17-19]。在本研究中,PNI、SII和PNI+SII在行根治性CCRT或RT的ESCC患者中具有显著的预测价值,且联合指标PNI+SII的预测价值最大。据我们所知,这是首次使用联合指标PNI+SII来评价行根治性CCRT或RT的ESCC患者的预后。
结果显示,高PNI组的预后与T分期、TNM分期、RT剂量和同步化疗显著相关;低SII组的预后与性别、吸烟史、饮酒史、肿瘤长度、T分期显著相关;此外,PNI+SII与T分期、TNM分期显著相关。多因素分析揭示PNI、SII和PNI+SII是影响OS的重要独立预后因素。研究结果表明,PNI+SII评分较低组的OS低于PNI+SII评分较高组(P<0.001),并且PNI+SII的AUC(0.640)高于PNI的AUC(0.595)和SII的AUC(0.615)。这说明,在接受根治性CCRT/RT的ESCC患者中,PNI+SII能更好预测预后。
本研究中,PNI,SII和PNI+SII与T分期显著相关,表明肿瘤的浸润深度可以影响患者治疗前的机体炎症、营养和免疫状态,这与Hirahara等[19]和Geng等[20]的研究结果一致。Zhang等[15]发现PNI<52.28组的OS明显低于PNI≥52.28组(P<0.001),SII≥387.65组的OS明显低于SII<387.65组(P<0.001),并且PNI和SII是行手术治疗的ESCC患者独立预后因素。在影响因素方面,年龄、肿瘤大小、浸润深度、淋巴结转移、PNI、SII与长期预后相关。在本研究中,PNI<47.8组和SII≥400.76组的OS分别显著低于PNI≥47.8组(P<0.001)和SII<400.76组(P=0.001),同时PNI、SII也是独立预后因素。产生这些差异的原因主要是纳入的患者人群和治疗方式的不同。我们的研究对象包含颈段食管癌和IVA期的患者,且治疗模式是根治性CCRT/RT。与行手术治疗的食管癌患者相比较,行放化疗的患者在治疗前呈现更低的PNI和更高的SII水平,这可能与我们的患者分期更晚和严重的吞咽梗阻所导致的营养不良有关。而在另外一项行根治性RT的颈段ESCC患者的研究中,PNI的最佳截断值为48.15,这与我们的研究结果是类似的[21]。
PNI和SII是PNI+SII的两个重要组成部分,关于这两项指标可用于预测肿瘤患者预后的深层机制已被广泛探讨。PNI由血清白蛋白浓度和外周血总淋巴细胞计数构成,可量化患者炎症反应、免疫和营养状况。低PNI与血清白蛋白和/或外周血总淋巴细胞计数的减少有关。肿瘤患者的分解代谢增加与摄入不足所导致的营养不良以及肿瘤微环境中的炎症介质(IL-1、IL-6和TNF-α)升高,均会导致血清白蛋白的降低[22-23]。更重要的是,低血清白蛋白水平与高癌症风险之间的关联性已被证实[24]。ESCC患者的营养不良也可表现为低淋巴细胞计数[25]。淋巴细胞具有强大的抗癌活性,特别是CD4+T和CD8+T细胞可发挥协同免疫效应,以遏制恶性肿瘤增殖与迁移[26]。较低的循环淋巴细胞是肿瘤患者预后不良的标志物[27]。大量研究表明,SII是恶性肿瘤的独立预后指标[12,18,20]。SII整合了3种常见的血液学指标(血小板、中性粒细胞和淋巴细胞),反映了机体的免疫和炎症状态之间的平衡。除如上所述的淋巴细胞相关机制,SII可用于预测肿瘤患者预后的潜在机制如下:1)在肿瘤微环境中,中性粒细胞通过分泌细胞因子(IL17、CXC等)、诱导中性粒细胞胞外陷阱的形成并释放多种蛋白酶(NE、MMP-99)和活性氧,促进肿瘤增殖和转移[28-29];2)血小板可以通过MHC-I和TGF-β抑制自然杀伤细胞的功能,从而诱导免疫逃逸;3)血小板也可通过TGF-β、糖蛋白VI等诱导上皮间质转化,从而促进肿瘤远处转移[30];4)中性粒细胞和血小板均可促进肿瘤新生血管的形成,有利于肿瘤的远处播散[28-30]。
PNI+SII是临床实践中简单、易得、廉价的指标,与单用PNI或SII相比能更好地反映患者全身炎症、营养和免疫之间的平衡状态。PNI+SII可进一步将患者细分为三类不同预后结局的群体。这有助于医生尽快尽早筛选出炎症负荷重、营养状况差、免疫功能低下的患者,进行早期针对性干预。
综上所述,PNI、SII和PNI+SII能在治疗前预测行根治性CCRT/RT的ESCC患者的预后。此外,与单独使用PNI或SII相比,PNI+SII具有更高的AUC,说明PNI+SII具有更好的预测预后的能力。因此在行CCRT/RT治疗前,根据PNI+SII评分在ESCC患者中筛选出不同分组(PNI+SII=0,1,2);然后,针对PNI+SII=0,1的患者积极进行个性化治疗,例如:抗炎、增强免疫和营养支持。这样有利于延缓肿瘤的发生发展、提高患者的生存率。
本研究仍有一些局限性的问题亟待解决。首先,这是一项小样本量的单中心回顾性研究,在患者纳入和数据收集过程中可能存在选择偏倚,需进一步扩大样本量进行前瞻性探究。其次,改良的GOS和全身炎症反应指数等可能的预后标志物未纳入本研究。最后,我们将在未来的研究中加入更多有效的标志物进一步完善联合指标。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
