结合网络分析方法探讨人参皂苷Rg3治疗胃癌的作用机制*
2022-03-28尹硕鑫张馨月李绅绅陈远能
卢 鑫,尹硕鑫,吕 哲,张馨月,李绅绅,张 涛,陈远能
(1.广西中医药大学研究生院 南宁 530000;2.广西中医药大学附属瑞康医院 南宁 530000)
胃癌(Gastric cancer)是全球第五大最常见的癌症,也是第三大最常见的癌症死亡原因[1],世界卫生组织最新公布数据显示,在中国癌胃癌总发病率和死亡率均排名第三[2]。胃癌早期发病特征不明显,多数患者发现时已是中晚期,给家庭和社会带来沉重负担[3]。近年来,中医药治疗胃癌取得了显著成效,中药及其活性成分对肿瘤转移有明确抑制作用[4],尤其中药化学成分治疗胃癌报道较多,人参皂苷在抑制胃癌细胞生长方面发挥了重要作用[5]。人参在我国具有极高的用药价值是我国著名珍贵药材之一,其历史悠久有着“百药之长,百草之王”的美誉。人参皂苷为人参主要活性化学成分,因此开展人参皂苷Rg3治疗胃癌进展综述,对新药研发及临床治疗具有一定的指导价值。现将人参皂苷Rg3治疗胃癌及其作用机制对近年来相关实验研究文献综述如下。
1 资料和方法
1.1 检索方法
中文以“胃癌”“人参皂苷 Rg3”,英文以“Ginsenoside Rg3”“gastric carcinoma”“gastric cancer”等为关键词,在中国知网、万方数据、维普、PubMed等数据库中检索建库至近年来发表的相关文献。
1.2 纳入与排除标准
1.2.1 纳入标准
人参皂苷Rg3治疗胃癌的作用机理研究及临床研究等。
1.2.2 排除标准
①重复文献;②综述文献;③时间跨度大的文献;④低质量文献。
1.3 数据提取
本次研究由课题组多名研究者一同进行研究,安排2名研究者分别独立在各大数据库查找文献,并筛选文献和提取文献中数据,课题组设定第三方对文献筛选和数据提取等意见分歧进行仲裁。若仍不能解决分歧,则由课题组几人协商解决。数据提取主要分为临床研究和实验研究文献,其中临床研究提取第一作者、发表年份、结局指标、治疗组和实验组样本量、治疗药物等。基本情况结局指标为CD4+/CD8+比例、血清VEGF浓度等。实验研究文献的数据提取主要包括第一作者、发表年份、治疗药物、胃癌细胞种类、动物模型、检测指标、作用通路、给药剂量及给药时间等,对于数据不全的研究尽量与原文作者取得联系进行补充。
1.4 文献质量评价方法
安排课题组2人作为研究评价员,独立对所有与人参皂苷Rg3治疗胃癌的作用机理研究及临床研究的相关文献进行评价,意见分歧时由第3名评价员介入评价。对于临床研究文献评价,本次研究根据改良的Jadad评分量表评价纳入临床研究的质量,具体包括随机序列产生方法、盲法应用(单盲或双盲)、分配隐藏方法、退出或失访病例及原因、其他偏倚分配方案等。总分为7分,1-3说明文献质量较低,4-7说明文献质量高。若评分低于1分或为0和数据不全文献直接排除;对于实验研究文献,查看其研究方法、数据结果等是否完整,发表年限是否太过久远,药物剂量用法是否明确等,若不满足纳入标准直接排除。最后仔细阅读文章内容,总结有效信息运用Meta分析方法分析临床研究文献,同时对实验研究文献进行总结分析并严谨撰写文章。
1.5 Meta分析
提取人参皂苷Rg3治疗胃癌临床研究文献的研究数据,采用Review Manager 5.3软件进行Meta分析,若P>0.05且I²≤50%,采用固定效应模型,若P<0.05或I²>50%,采用随机效应模型。
2 结果
2.1 文献检索及筛选结果
各数据库检索共得到140相关篇文献,根据标题及摘要进行初步筛选,排除重复文献、综述文献、低质量文献和年代久远的文献。最终共42篇文章纳入。文献检索流程图如图1。
2.2 人参皂苷Rg3结构式
通过PubChem得到人参皂苷Rg3结构式,其分子式为C42H72O13,如图2。
2.3 文献总结分析
2.3.1 改善胃癌患者免疫力,提高患者生存率
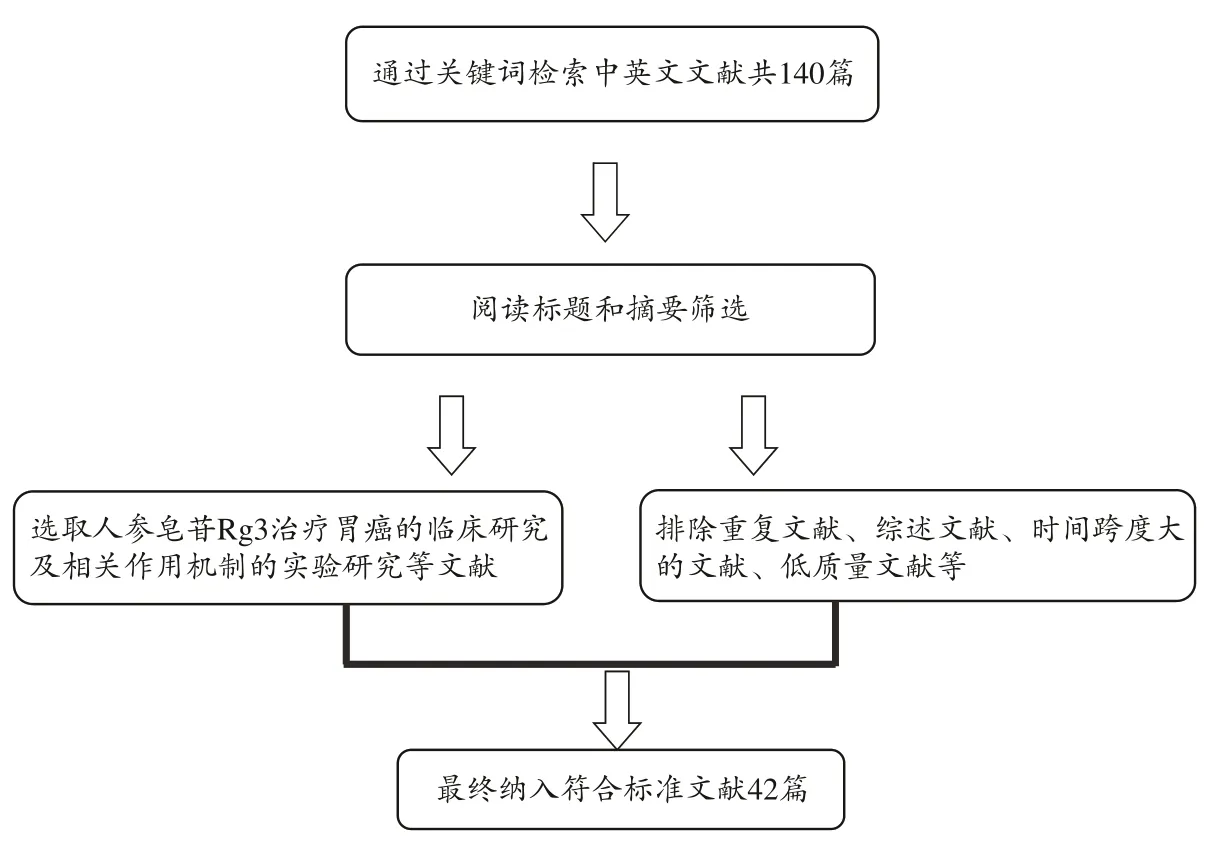
图1 文献检索流程图
人的免疫力降低时易受病邪侵袭,提高免疫力可以有效预防疾病,也对胃癌等肿瘤防治有一定作用。郑伊妮等[6]发现人参皂苷Rg3联合XELOX方案(卡培他滨+奥沙利铂)治疗可以明显提高患者外周血CD4+T淋巴细胞水平,胃癌患者的肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、癌胚抗原(Carcinoembryonicantigen,CEA)水平明显低于对照组(卡培他滨+奥沙利铂),研究结果提示人参皂苷Rg3联合XELOX方案更能提高晚期胃癌患者的免疫力,可以明显延长晚期胃癌患者的生存期。孙义长等[7]也发现人参皂苷Rg3观联合新辅助放化疗使胃癌患者CD3+、CD4+、T淋巴细胞转化率及CD4+/CD8+值均上升,且CD8+值下降,可有效改善患者免疫能力,提高患者生存率。另有研究发现人参皂苷Rg3与卡培他滨、奥沙利铂方案联合治疗晚期胃癌具有协同作用,不良反应轻、耐受性好,能提高化疗疗效及改善患者生活质量[8-9]。此外,益生菌联合人参皂苷Rg3对胃癌术后患者免疫球蛋白A、M、G(Immunoglobulin A、M、G,IgA、IgM、IgG)和CD4+/CD8+均显著提高,说明人对胃癌术后患者免疫力及术后恢复均有较好的促进作用,且能明显地延长晚期胃癌患者生存期[10-11]。Fu等[12]研究显示,CD4+/CD8+比例失衡是介导肿瘤细胞免疫逃避的主要原因,其数值大小与机体免疫力呈正相关,CD4+/CD8+比例升高,表明免疫力提高。除此之外,进展期胃癌患者术后采用丝裂霉素加呋喃尿嘧啶方案(MF)联合Rg3治疗可明显降低血清血管内皮生长因子(Vascular endothelial growth factor,VEGF)含量,提高生存率[13]。通过仔细阅读文章提取刘世祥、郑伊妮、孙义长、乔林邦等人文献数据,利用Review Manager 5.3软件对提取的数据进行Meta分析,Meta分析结果见森林图(图3),结果表明人参皂苷Rg3联合化疗治疗胃癌在CD4+/CD8+升高程度上优于单纯化疗(P<0.05);对VEGF浓度改变上Meta分析森林图见图4,结果表明人参皂苷Rg3联合化疗治疗胃癌在VEGF降低程度上要优于单纯化疗(P<0.05);这些研究说明人参皂苷Rg3参与治疗胃癌的确能起到改善胃癌患者免疫力,提高患者生存率,降低血清VEGF含量等作用。其数据提取,见表1。

图2 人参皂苷Rg3结构式
2.3.2 调节VEGF,改善胃癌术后情况
血管抑制剂人参皂苷Rg3联合紫杉醇治疗,可提高疗效及患者生活质量、增强患者免疫功能、延长患者生存时间,值得临床推广应用[14]。有研究表明人参皂苷Rg3联合EAP(表柔比星、多柔比星)或者ELFP(依托泊苷、甲酰四氢叶酸钙、顺铂)化疗治疗进展期胃癌术后患者可调节其血清VEGF、CD3、CD4、CD4/CD8等免疫指标水平,提高胃癌术后化疗总有效率[15]。谢晓东等[16]、袁国荣等[17]亦发现人参皂苷Rg3可明显降低胃癌患者术后血清VEGF浓度,研究还发现人参皂苷Rg3联合紫杉醇为主化疗治疗胃癌术后肝转移能提高近期总有效率。人参皂苷Rg3联合化疗治疗胃癌对胃癌术后患者VEGF的影响见数据提取见表2。利用Review Manager 5.3软件对提取的数据进行Meta分析,通过分析结果见图5,表明人参皂苷Rg3对胃癌术后患者的血清VEGF浓度升高上有明显优势(P<0.05),这些研究表明人参皂苷Rg3可调节VEGF,改善胃癌术后情况,缓解患者病情。
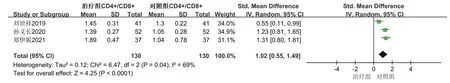
图3 人参皂苷Rg3治疗胃癌调节“CD4+/CD8+”森林图
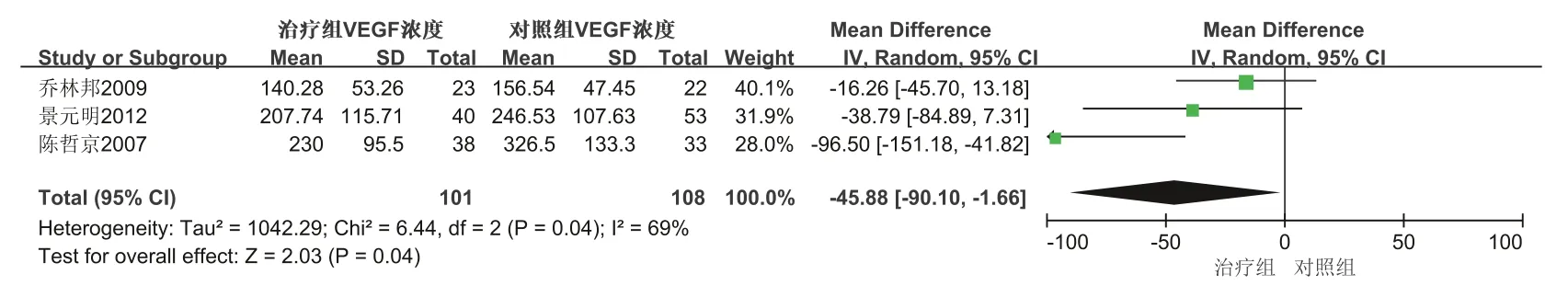
图4 人参皂苷Rg3治疗胃癌调节“VEGF”浓度森林图
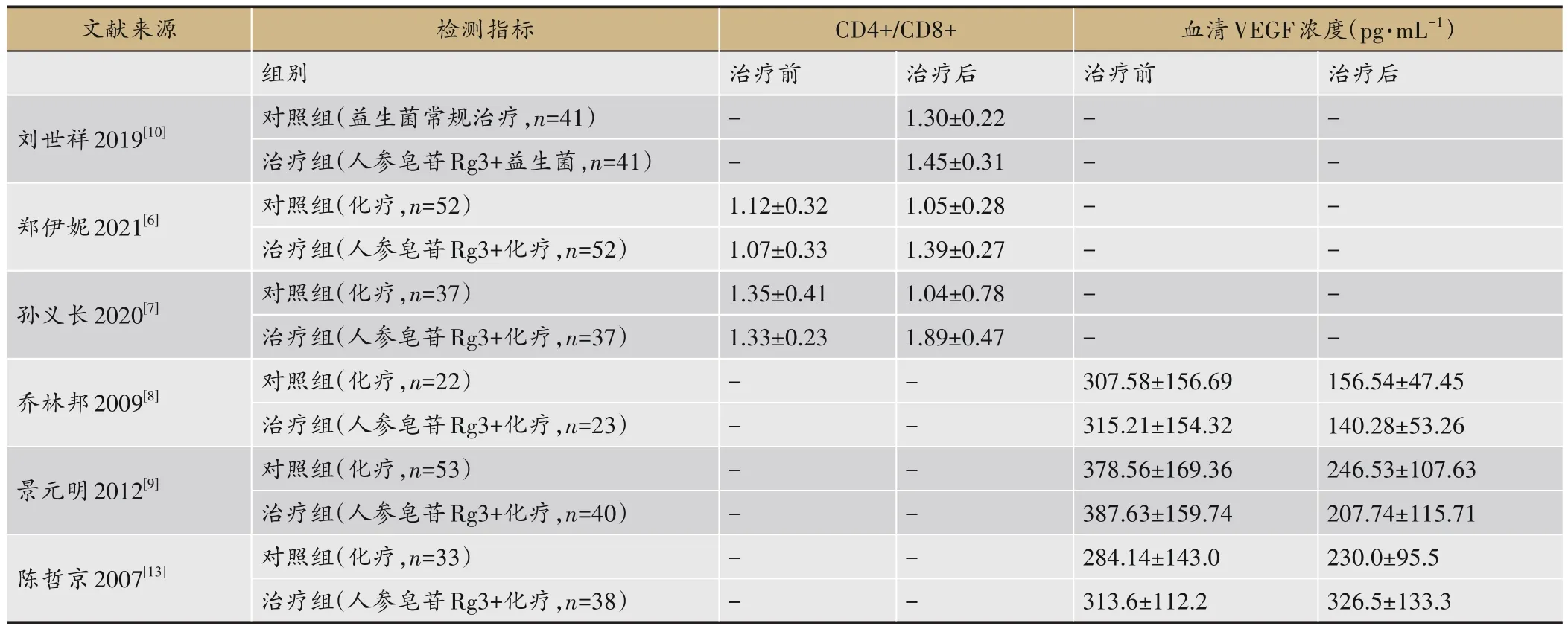
表1 文献中人参皂苷Rg3治疗胃癌的数据表
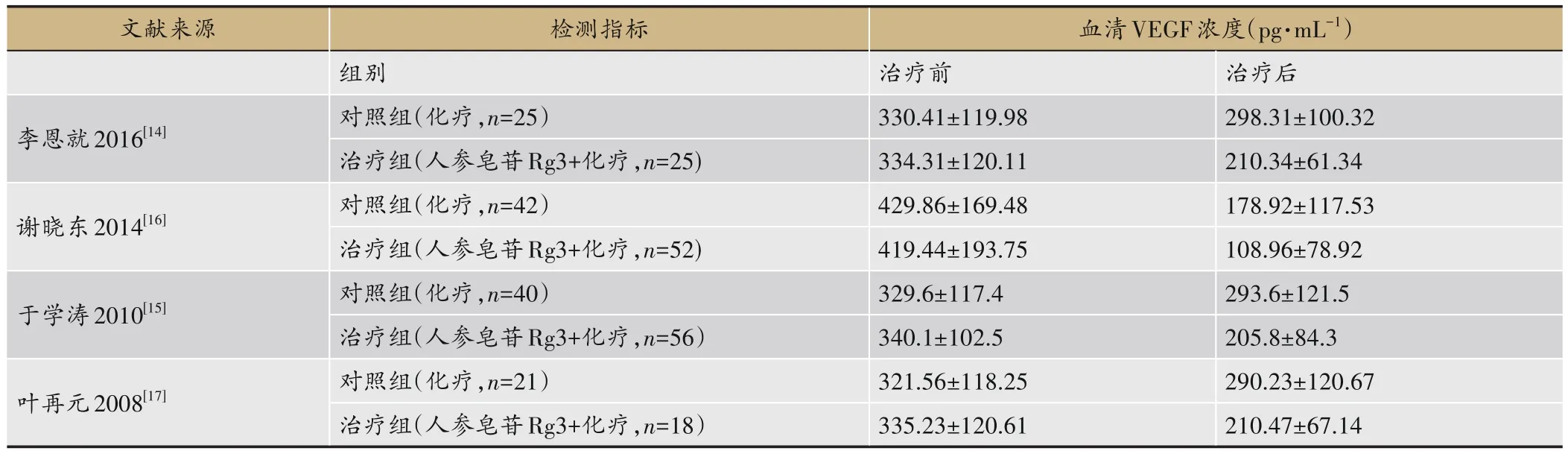
表2 文献中人参皂苷Rg3治疗胃癌调控VEGF的数据表
2.3.3 抑制胃癌细胞生长与增殖
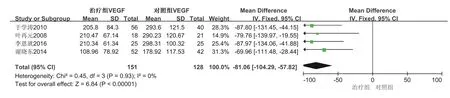
图5 人参皂苷Rg3联合化疗治疗胃癌调节“VEGF”浓度森林图
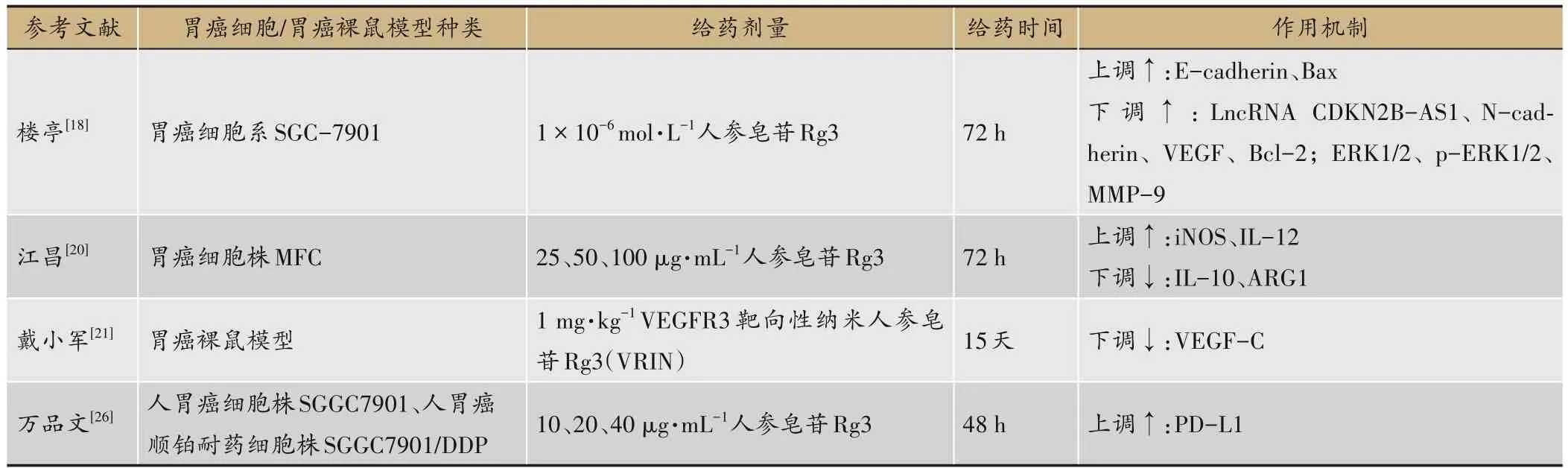
表3 人参皂苷Rg3抑制胃癌细胞生长与增殖作用
人参皂苷Rg3具有抗肿瘤作用,为四环三萜类人参二醇型皂苷单体。楼亭[18]等发现人参皂苷Rg3能够抑制丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)信号通路激活、抑制下游靶基因活化,在胃癌细胞中加入人参皂苷Rg3,可下调长链非编码RNA(Long non-coding RNA CDKN2B-Asl,LncRNA CDKN2B-AS1)、神经钙粘蛋白(N-cadherin)、血管内皮生长因子(VEGF)、B淋巴细胞瘤-2(Bcl-2)、细胞外调节蛋白激酶(Extracellular regulated protein kinases,ERK1/2)、p-ERK1/2、基 质 金 属 蛋 白 酶 9(Matrix metallopeptidase 9,MMP-9);上调上皮钙粘蛋白(E-cadherin)、Bcl-2相关 X 蛋白(Bax)等;通过抑制LncRNA CDKN2B-ASl作用,有效抑制胃癌细胞上皮间充质转化(Epithelial-mesenchymal transition,EMT)、增殖及迁移等生物学行为。人参皂苷Rg3各种剂量对胃癌(SNU-216)细胞生长具有明显地抑制作用, 抑制效率与药物浓度呈正比[19]。体外研究也发现人参皂苷Rg3在体外可抑制胃癌细胞株MFC细胞增殖,具体作用机制通过上调诱导型一氧化氮合酶(Inducible nitric oxide synthase,iNOS)、白介素 12(Interleukin-12,IL-12);下调↓:白介素10(IL-10),重组人精氨酸酶1(Arginase-1,ARG1)实现,且具有剂量依赖性,体内具有抗肿瘤活性,其机制可能与Rg3诱导巨噬细胞向M1极化,改善胃癌炎性微环境相关[20]。人参皂苷免疫纳米VRIN(VEGFR3-mediated immunenanoemulsion of ginsenoside Rg3,VRIN)是采用聚乙二醇法制备,将血管内皮细胞生长因子受体3抗体(VEGFR-3)抗体与人参皂苷Rg3纳米乳结合的新制剂,VRIN可抑制人胃癌细胞祼鼠移植瘤生长及淋巴结转移,并通过下调血管内皮生长因子C(VEGF-C)表达抑制肿瘤淋巴管生成[21-22]。聂娜等[23]发现5-氟尿嘧啶与人参皂苷Rg3均具有对MGC-803胃癌细胞和MKN-28胃癌细胞的增殖抑制效果以及对荷瘤裸鼠肿瘤生长的抑制能力,二者联合应用更是一种潜在的治疗胃癌的有效手段。另有研究证明人参皂苷Rg3联合紫杉醇能协同抗胃癌细胞增殖,抑制肿瘤的生长[24]。转移是胃癌等恶性癌症恶性程度的评价标准之一,胃癌细胞的转移与肿瘤血管形成关系密不可分。人参皂苷Rg3对胃癌细胞条件培养液诱导的胃癌诱导血管内皮细胞(VEC)增殖具有抑制作用[25]。万品文等[26]研究发现人参皂苷Rg3可有效抑制对顺铂(DDP)耐药性,通过下调程序性死亡配体1(Programmed death-1 ligand 1,PD-L1)表达抑制胃癌细胞株(SGC7901/DDP)的细胞增殖。此外人参皂苷Rg3能阻断神经纤毛蛋白(Neuropilin-1,NRP1)和纤连蛋白(Fibronectin,FN1)的相互作用,抑制胃癌的进展[27]。有研究也发现人参皂苷Rg3抑制胃癌细胞的生长和存活,其原因是阻断了瞬时受体电位7通道(Transient receptor potential melastatin 7,TRPM7)通道的活性[28]。这些研究证明人参皂苷Rg3防治抑制胃癌细胞生长及增殖可能通过调控LncRNA CDKN2BASl、PD-L1或VEGF-C等来实现,人参皂苷Rg3抑制胃癌细胞生长与增殖作用机制详见表3。
2.3.4 促进或诱导胃癌细胞凋亡
国外研究发现人参皂苷Rg3可通过激活半胱氨酸天冬氨酸蛋白酶3(Caspase-3)、半胱氨酸天冬氨酸蛋白酶8(Caspase-8)、半胱氨酸天冬氨酸蛋白酶9(Caspase-9)以及调节B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)、兔抗人单克隆抗体(BCL2-Associated X,Bax)表达诱导胃癌细胞凋亡[29]。Aziz等[30]发现人参皂苷Rg3能增促凋亡蛋白表达,通过激活Caspases-3、Caspases-8、Caspases-9和聚腺苷二磷酸-核糖聚合酶(Poly-ADP-ribose polymerase,PARP)调控特异性蛋白1(Specificity protein 1,SP1)、热休克转录因子 1(Heat Shock Transcription Factor 1,HSF1)抑制岩藻糖基转移酶4(Fucosyltransferase 4,FUT4)表达,最终诱导胃癌细胞凋亡。目前研究普遍认为肿瘤细胞的恶性生长及增殖是肿瘤发生发展必不可少的一步,近年来对胃癌相关作用机理的研究表明,lncRNA调控基因的表达可影响胃癌细胞凋亡[31-32]。国内研究亦发现人参皂苷Rg3能通过抑制长链非编码RNA-LINP1(lncRNA-LINP1)的表达,从而抑制胃癌细胞的增殖与迁移,并促进其凋亡,且这种作用随着Rg3浓度的增加而增强,从而发挥抑癌作用[33]。还有研究发现人参皂苷Rg3和紫杉醇联合可协同提高Caspase-3的活性, 诱导胃癌细胞的凋亡[34]。此外,李想[35]发现人参皂苷Rg3的抗癌活性与其调节原癌基因pim3(Pro-oncogene pim-3,Pim-3)以及磷酸化Bad蛋白表达有关,Pim-3可磷酸化相关死亡促进因子BCL-xL(BCL-2-associated death promoter,Bad)抑制胃癌细胞的凋亡。此类研究证明人参皂苷Rg3可通过调控Bcl-2、Bax、HSF1、SP1等表达起到诱导胃癌细胞凋亡的作用,人参皂苷Rg3促进胃癌细胞凋亡作用机制详见表4。
2.3.5 抑制胃癌细胞侵袭转移
戴小军[36]研究发现VEGFR3靶向性纳米人参皂苷Rg3能通过抑制VEGF-C、血管内皮生长因子D(VEGF-D)和VEGFR-3的表达抑制胃癌转移。研究还发现人参皂苷Rg3能抑制人胃癌细胞缺氧诱导因子1α多肽(Hypoxia-inducible factor 1-Alpha,HIF-1α)和血管内皮生长因子(Vascular endothelial growth factor,VEGF)的表达,影响胃癌的腹腔种植转移[37]。罗玉妍[38]发现人参皂苷Rg3联合5氟尿嘧啶(5-Fu)可降低胃癌癌组织中CD133(突起蛋白-1,prominin-1)表达进而降低胃癌细胞瘤远处转移率。丁健[39]发现人参皂苷Rg3纳米乳通过降低VEGF-C、VEGFR-3等淋巴生长转移因子表达,进而减少胃癌组织细胞微淋巴管生成抑制胃癌细胞转移。人参皂苷Rg3联合紫杉醇具有协同抗胃癌转移作用,可能通过协同抑制肿瘤新生血管形成实现[40]。研究还发现人参皂苷Rg3可能通过下调细胞间黏附因子1(Intercellular adhesion factor 1,ICAM-1)、上调闭合蛋白(Claudins)表达从而抑制人胃癌SGC-790细胞体外转移[41]。人参皂苷Rg3还能够抑制人胃癌细胞SNU601增殖、迁移和侵袭的作用,抑制上皮间质转化,发挥其抗癌作用[42]。抑胃癌细胞转移是防治胃癌的重要手段,人参皂苷Rg3可通过抑制VEGFR-3、VEGF-C、VEGF-D等表达,降低胃癌癌组织中CD133表达,以及抑制上皮间质转化等达到抑制胃癌细胞转移的作用,人参皂苷Rg3抑制胃癌细胞转移作用机制详见表5。
2.3.6 人参皂苷Rg3治疗胃癌涉及通路
有研究发现人参皂苷Rg3可通过调节磷脂酰肌醇-3-羟激酶(PI3K)、丝氨酸/苏氨酸激酶(AKT)、雷帕霉素机制性靶标(Mechanistic target of rapamycin,mTOR)、HIF-1α、乳酸脱氢酶A(Lactate dehydrogenase A,LDHA)、己糖激酶-II(Hexokinase-II,HK-II)和微小核糖核酸(MicroRNA-21,miRNA-21)的表达来缓解GPL小鼠异常糖酵解,人参皂苷Rg3是GPL治疗的有效补充物,可抑制GPL细胞的增殖和诱导凋亡,证明人参皂苷Rg3通过PI3K/AKT/miRNA-21通路抑制糖酵解,改善Atp4a-/-小鼠胃癌前病变[43]。人参皂甙Rg3通过阻断PI3K/AKT信号通路来抑制钙调蛋白(Calmodulin,Ca M)的表达,进而促进胃癌细胞的凋亡[44-45]。这些研究证明人参皂苷Rg3发挥防治胃癌与PI3K/AKT信号通路密切相关。研究发现人参皂苷Rg3通过抑制SGC7901细胞中Wnt/β联蛋白通路激活从而抑制细胞的侵袭、迁移[46]。人参皂苷Rg3通过Ca2+/CaM信号系统抑制胃癌BGC-823细胞增殖,可能是通过降低Ca M的表达来抑制核因子κB(Nuclear factor kappa-B,NF-κB)信号通路的活性,进而抑制胃癌细胞的增殖和侵袭、促进其凋亡[47]。通过已经有文献研究,表明人参皂苷Rg3治疗胃癌主要涉及PI3K/AKT、Wnt/β联蛋白通路、Ca2+/CaM、NF-κB信号通路等。对其靶点通路总结如表6。人参皂苷Rg3调控PI3K/AKT、Wnt/ß-catenin、Ca2+/CaM、NF-κB等信号通路防治胃癌作用机制详见图6。
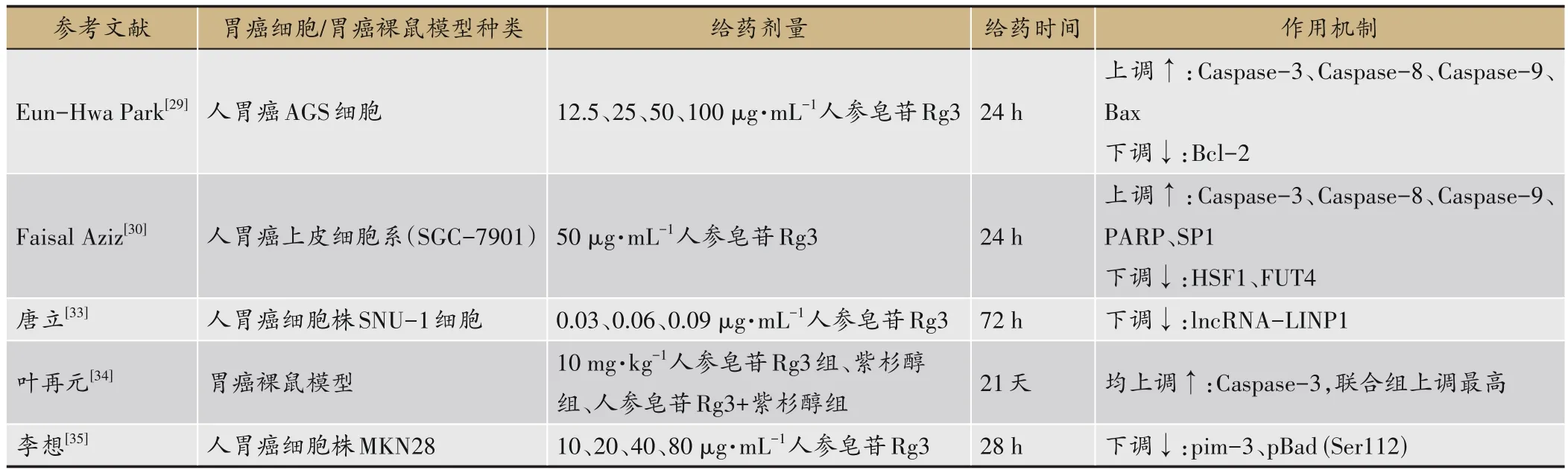
表4 人参皂苷Rg3促进胃癌细胞凋亡作用机制
2.3.7 对血管生长因子(VEGF)的影响
人参皂苷Rg3免疫纳米乳剂(VRIN)可抑制人胃癌细胞祼鼠移植瘤淋巴结转移,调控淋巴管生长因子VEGF-D蛋白[48]。临床研究发现人参皂苷Rg3联合新辅助放化疗治疗胃癌,可显著降低患者VEGF和MTA1阳性率[49]。另有研究发现以淋巴管生成为靶点的人参皂苷Rg3免疫纳米乳通过抑制VEGF-C、VEGF-D和VEGFR-3在人胃癌原位小鼠模型中的表达,抑制肿瘤生长和降低淋巴结转移[50]。这些临床及实验机制研究均表明人参皂苷Rg3能起到调控血管生长因子(VEGF)治疗胃癌的作用。现通过以上总结分析将人参皂苷Rg3治疗胃癌其详细可能作用机制图绘制如图7。

表5 人参皂苷Rg3抑制胃癌细胞转移作用机制

表6 文献中与人参皂苷Rg3治疗胃癌的相关通路
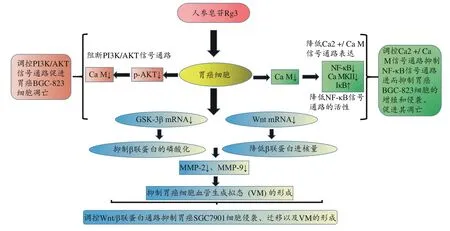
图6 人参皂苷Rg3治疗胃癌相关信号通路
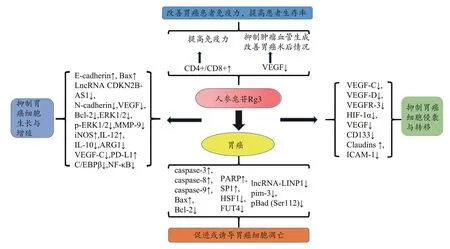
图7 人参皂苷Rg3治疗胃癌可能作用机制
3 结语与展望
目前胃癌仍然是威胁人类生命健康的重大疾病,人参皂苷Rg3在临床研究中已经证实对胃癌患者疗效明确,可改善胃癌患者免疫力,提高患者生存率,改善胃癌患者术后情况。通过对部分临床研究文献进行Meta网络分析可知人参皂苷Rg3+化疗对比单纯化疗治疗胃癌在降低血清VEGF含量及其它炎性因子上具有明显优势,达到治疗胃癌的作用,还可改善胃癌化疗术后情况。VEGF的发现彻底改变了我们对发育和生理稳态过程中血管生成和血管生成的理解,VEGF在多种癌症发病机制中作用明显[51-53]。总结上述文献已知人参皂苷Rg3与化疗药物联合可起到明确的增效作用,在增效减副作用上为胃癌化疗提供了重要参考。人参皂苷Rg3是人参重要化学成分,国内外各大医家及科研工作者对人参皂苷Rg3防治胃癌作用机制做了大量研究,人参皂苷Rg3防治胃癌作用机制主要是阻断TRPM7通道活性及调控LncRNA CDKN2B-ASl、PD-L1等抑制胃癌细胞生长及增殖;抑制lncRNA-LINP1的表达等促进胃癌细胞凋亡;降低胃癌癌组织中CD133表达及抑制上皮间质转化等抑胃癌细胞迁移;抑制肿瘤新生血管生成等。其涉及通路包括PI3K/AKT、Wnt/β联蛋白通路、Ca2+/CaM信号通路、NF-κB信号通路等。值得肯定的是这些国内外研究研究方法严谨、结果明确、数据完整、不乏高质量文献。人参皂苷Rg3治疗胃癌研究类型多样,既有临床研究,又有离体胃癌细胞研究和动物在体研究。但也存在缺点,如在人体内的作用机制研究尚缺乏、胃癌实验鼠模型造模方法等不统一,人参皂苷Rg3的给药剂量多数研究不统一,大多是动物在体研究和离体细胞研究,临床研究较少,因而仍需大量且深入的对人参皂苷Rg3治疗胃癌进行研究以明确人参皂苷Rg3防治胃癌作用机理。
目前,人参皂苷Rg3在临床已有应用,且用途较广,如主要成分为人参皂苷Rg3的参一胶囊就在多种癌症患者中使用,参一胶囊可补益气血、培元固本,每一粒参一胶囊就包含人参皂苷Rg3约10 mg。其药理作用既可与其它化疗药物配合使用,有助于提高胃癌、肝癌、原发性肺癌等癌症疗效,又能改善肿瘤患者的虚弱症状,提高患者免疫功能。还有人参皂苷Rg3其它用药,如人参皂苷复合压片、人参皂苷Rg3胶囊、水溶性人参皂苷Rg3冲剂等药物主要成分均为人参皂苷Rg3,这些药在肿瘤治疗以及其它多种疾病中多有应用。但人参皂苷Rg3治疗胃癌的临床研究以及人体作用机制研究较少,说明人参皂苷Rg3尚未大量投入胃癌的临床使用。目前大多是与其它化疗药物组合使用,以增强疗效,改善患者免疫力、减少化疗药物副作用等。通过前文总结分析大量的实验研究可知人参皂苷Rg3的确对胃癌有效,但是人参皂苷Rg3对人胃癌患者的临床应用研究尚缺乏,故很有必要充分挖掘人参皂苷Rg3治疗胃癌的临床应用价值。
综上所述,本文主要对人参皂苷Rg3及其联合化疗药物治疗胃癌作用及其机理的研究进展进行了归纳总结,人参皂苷Rg3治疗胃癌涉及多通路、多靶点,除本文总结归纳的通路靶点外,还可能通过其它通路和靶点发挥防治胃癌的作用,需进一步探索,如采用网络药理学、分子对接等方法结合实验验证进一步挖掘其作用机制。对人参皂苷Rg3治疗胃癌的作用机理进行归纳总结以及拓展分析意义非凡,希望可为人参皂苷Rg3进一步开展临床试验研究提供参考,以及把人参皂苷Rg3药物的进一步研发应用于临床作为未来着重研究的方向。
