安寐丹干预斑马鱼睡眠剥夺模型昼夜节律及能量代谢作用机制研究*
2022-03-28游秋云
汪 卿,游秋云,丁 莉,夏 婧,王 平
(湖北中医药大学老年医学研究所 武汉 430065)
睡眠是生命活动中不可缺少的一种生理现象,良好的睡眠有利于生长发育、机体恢复以及保持心理健康等。但随着现代人生活方式的变迁,尤其是新冠疫情引发的后续心理问题,导致失眠症的发病率逐年增高。中国睡眠研究会公布的中国成人失眠患病率已经达到57%[1]。长期失眠不仅会导致生活质量下降,还会造成能量代谢紊乱,增加肥胖、糖尿病及代谢综合征等疾病的风险[2]。
研究表明,生物节律和内稳态是调控睡眠的两大关键因素,二者又互为影响[3]。一方面生物钟的节律表达参与了机体能量代谢的调控。全基因组基因表达谱分析发现,大约有15%的转录组基因呈周期性表达,其中大部分是参与编码碳水化合物、脂肪酸代谢、胆固醇生物合成的重要调节剂[4]。另一方面昼夜节律的破坏是诱发代谢性疾病的危险因素。如轮班工作者患二型糖尿病、胃肠疾病、肥胖、代谢紊乱等的发病率显著升高[5];小鼠时钟基因(Clock)突变、时钟管理基因(Bmal1)缺陷或SCN受损,都会引起葡萄糖耐受能力、胰岛素敏感性降低,表现为食欲旺盛、昼夜饮食节律减弱,并且随着年龄的增长问题更为突出[6]。可见,生物钟网络和代谢调控网络是交织在一起,提示我们可以通过研究生物钟基因调控能量代谢的机制,来探索失眠防治的方向和路径[7]。
相较于以中枢神经系统镇静催眠为主的化学药物长时间使用会出现药物依赖、呼吸抑制、损伤认知和精神系统等副作用,中医药在失眠防治领域中显示出独特优势[8]。经典古方安寐丹,出自清代陈士铎《石室秘录》一书。书云:“心经之病,怔忡、不寐等症,乃心血少矣……”方中人参益心气,丹参、当归补心血,麦冬养心阴,菖蒲开心窍,茯神、枣仁、甘草补心神,五味子敛心气,诸药合用,共奏益气养心安神之功效。临床用于治疗虚证失眠并随症加减能收到良好效果[9]。课题组前期实验也证实,安寐丹可通过修复线粒体分裂/融合失衡状态、食欲素水平等改善睡眠剥夺(SD)模型大鼠神经细胞凋亡,恢复昼夜节律及学习记忆水平[10-11]。安寐丹浸泡给药后能恢复光照SD斑马鱼幼鱼昼夜节律,且镇静催眠效果随剂量升高而增加,其机制可能与调节MAPK/MNK/eIF4E通路相关[12]。本研究选用模式生物斑马鱼为研究对象,采用咖啡因做诱导剂建立成年斑马鱼睡眠剥夺模型,观察安寐丹浸泡给药后对昼夜节律和能量代谢水平的影响,探讨了安寐丹在调控斑马鱼睡眠中的作用机理。
1 材料与方法
1.1 实验动物
实验所用斑马鱼为4月龄野生型AB系,购自国家斑马鱼资源中心并于湖北中医药大学老年医学研究所斑马鱼实验室繁殖饲养,参照Westerfield方法[13],设置温度为28℃,光黑交替循环为14 h:10 h,每天按时喂食丰年虾两次。
1.2 实验药物与仪器
1.2.1 主要药物与试剂
安寐颗粒(湖北中医药大学老年医学研究所提供[14]);褪黑素(Sigma公司,批号:M5250);咖啡因(巴菲尔公司,批号:58-08-2);RNA提取液(批号:G3013)、RT First Strand cDNA Synthesis Kit(批号:G3330)、2×SYBR Green qPCR Master Mix (High ROX) [A Synthesis Kit(批号:G3322)],以上试剂均由武汉赛维尔生物技术有限公司提供;总蛋白定量测试盒考马斯亮蓝法(批号:A045-2)、超微量三磷酸腺苷(ATP)酶测试盒(批号:A070-6),以上试剂均由南京建成弘大生物科技有限公司提供;尼氏染色液(南京生航生物技术有限公司,批号:DL-082)。
1.2.2 主要仪器与设备
斑马鱼行为分析系统(法国View Point Life Science,Videotrack Track 3.5)、T迷宫(法国 View Point Life Science,TF105B)、实时荧光定量聚合酶链反应仪(Real time-PCR,美国Bio-Rad公司,CFX96)、超微量分光光度计(美国Thermo公司,ND2000)、酶标检测仪(美国Biotek公司,Epoch)、病理包埋机(德国Leica公司,RM2016)、切片机(德国Leica公司,RM2016)、荧光倒置显微镜(日本Olympus公司,IX71)。
1.3 实验分组
1.3.1 分组及给药
将斑马鱼随机分成5组,分别为空白组、模型组、褪黑素组、安寐丹低剂量组、安寐丹高剂量组,每组15尾。空白组:正常饲养;模型组:用25 mg·L-1的咖啡因溶液浸泡24 h[15];褪黑素组:用25 mg·L-1的咖啡因溶液浸泡给药22 h后再转移到0.464 mg·L-1褪黑素溶液中浸泡给药2 h;安寐丹低组:用25 mg·L-1的咖啡因溶液浸泡给药22 h后再转移到0.129 g·L-1安寐丹溶液中浸泡给药2 h;安寐丹高组:用25 mg·L-1的咖啡因溶液浸泡给药22 h后再转移到0.514 g·L-1安寐丹溶液中浸泡给药2 h。各组每日放入T迷宫中训练,以此循环4天。
1.3.2 样本采集
行为学检测结束后,将斑马鱼放入冰水混合物中处死,于冰上迅速分离脑、肝脏等组织,用于组织切片样本固定于4%多聚甲醛溶液放于4℃冰箱备用,用于分子生物分析样本装于灭菌EP管放于-80℃冰箱备用。
1.4 指标检测
1.4.1 24 h行为学检测
将各组斑马鱼置于斑马鱼行为分析系统中,根据成鱼游动速率设置参数范围为:静止(<5 mm·s-1,黑色)、小运动(5-25 mm·s-1,绿色)、大运动(>25 mm·s-1,红色),监测24 h内斑马鱼不同状态运动计数、运动时间和运动距离。仪器将自动追踪斑马鱼的行为轨迹,检测结束后自动产生数据记录与行为轨迹图。
1.4.2 T迷宫实验
T型迷宫由水平等长的左右臂和垂直起始臂组成,在起始臂的最前端设置一个可控的挡板隔开,根据斑马鱼颜色偏好[16],右臂标记绿色,并在深水区放置孵化的丰年虾食物设为营养富集区(EC区),左臂标记红色,不放置食物。
实验测试包括3个阶段:第1个阶段是适应阶段。将所有斑马鱼都放入T迷宫中自由游动,以适应新环境,为期2天。第2阶段是训练实验。将每组斑马鱼分别放在T迷宫的起始区域,待鱼适应稳定30 s后,轻轻抽出隔板,记录斑马鱼在T迷宫中探索6 min的行动轨迹,分别记录第1次进入EC区的时间以及在EC区停留的总时间,未进入者记为0 min,超过6 min记为6 min。测试时间内没有进入EC区的将被人为引导到EC区,并让它在其中停留1 min。训练测试连续4天每天1次。第3阶段是正式实验。在最后1次训练实验的第2天进行记忆能力正式实验,但不以食物作为奖励,以评估学习记忆情况。配合斑马鱼行为分析系统记录并分析每尾斑马鱼的行为轨迹。
1.4.3 尼氏染色观察中脑神经元形态
全脑经4%多聚甲醛固定后,用PBS冲洗组织表面,切片机连续冠状切片,PBS洗片3次,将切片放入1%尼氏染色液染色中浸染10 min。然后使用蒸馏水冲洗,用分色液分化10 s以清除背景。梯度乙醇脱水,再用二甲苯透明。最后中性树胶封片,在显微镜下进行拍照,观察中脑神经元及尼氏小体变化。
1.4.4 Real time-PCR检测clocka、bmal1、晶体蛋白基因(Cry)1a、系列周期基因(Per)1a、per2mRNA表达水平
取斑马鱼脑组织,使用TRIzol提取总RNA溶于15 μL ddH2O并进行逆转录,而后使用Real time-PCR反应,以rpl13a为内参测定时钟基因clocka、bmal1、cry1a、per1a和per2的相对量。结果采用 2-ΔΔCT法表示各mRNA表达。引物设计均由武汉赛维尔生物技术有限公司代合成,引物序列见表1。
1.4.5 定磷法测定肝脏中Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶及总ATP酶活力
由于ATP酶可分解ATP生成二磷酸腺苷和无机磷,因此测定无机磷含量可间接判断ATP酶的活性。首先,取斑马鱼肝脏,准确称取组织重量进行匀浆,采用考马斯亮蓝法测定斑马鱼肝脏蛋白浓度。然后采用定磷法按照超微量Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶、总ATP酶测试盒说明书进行检测。计算公式:组织中ATPase活力(U·mg-1)=(测定OD值-对照OD值)(/标准OD值-空白OD值)×标准品浓度(0.02 μmol·mL-1)×6*×7.8**/待测样本蛋白浓度(mg·mL-1),注:6*:定义上为每小时,实际操作为10 min反应,所以必须乘6;7.8**:反应体系中7.8倍稀释
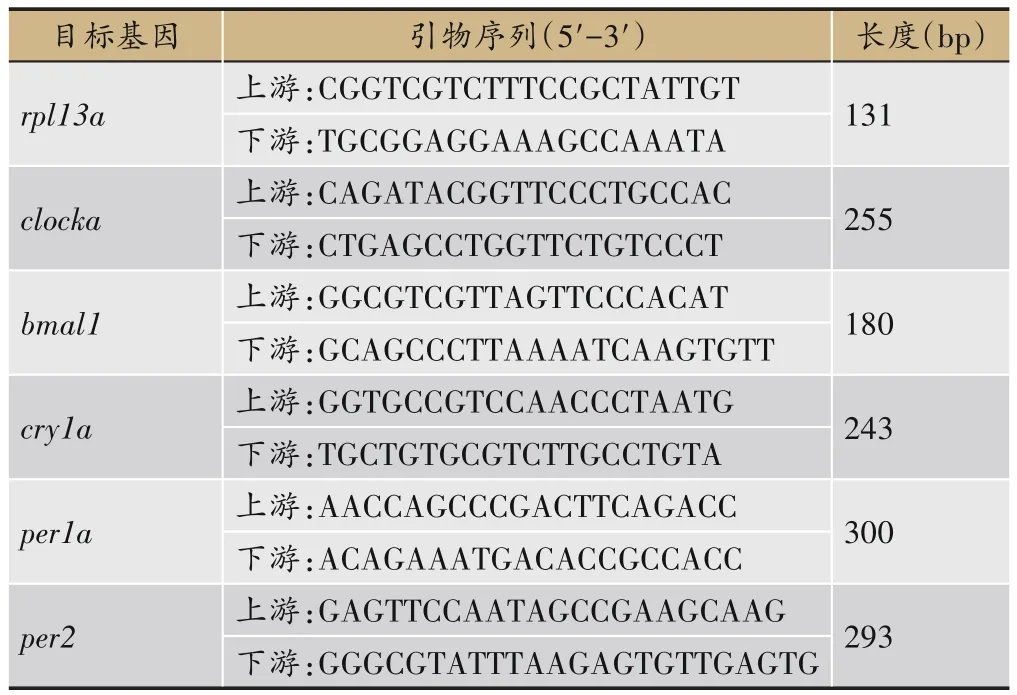
表1 引物序列
1.5 统计学方法
用SPSS 23.0统计软件处理所有采集数据,运用Graphpad Prism 6.0绘制图形。数据通过单因素方差分析,使用LSD、沃德-邓肯法对组间进行统计评估,以平均值±标准差()表示,当结果P<0.05时被认为具有统计学意义。
2 结果
2.1 安寐丹对SD斑马鱼24 h自主活动的影响
结果显示,与空白组相比,SD斑马鱼静止状态总计数、持续时长、覆盖距离减少,大运动状态总计数、持续时长、覆盖距离增加,24 h昼夜节律变化幅度特征降低,但未见统计学差异。与模型组相比,药物干预能恢复模型昼夜节律特征,其中褪黑素、安寐丹高剂量可增加静止状态计数(P<0.05)、减少大运动状态计数(P<0.05),安寐丹低剂量增加静止状态计数(P<0.05)(图1,表2)。
2.2 安寐丹对SD斑马鱼学习记忆能力的影响
除模型组外,各组随着训练时间延长第1次进入EC区时间均有不同程度的缩短。正式实验结果显示,与空白组相比,模型组第1次进入EC区的时间显著增加(P<0.05),多在主臂徘徊,少数斑马鱼进入EC区后又游出,累计停留时间减少。与模型组相比,褪黑素组斑马鱼第1次进入EC区的时间显著缩短(P<0.05),EC区的停留时间显著增加(P<0.05),安寐丹组也出现改善效果,但差异无统计学意义(图2,表3、4)。
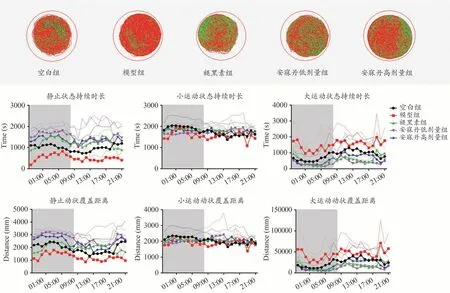
图1 安寐丹对SD斑马鱼24 h自主活动的影响(n=4)
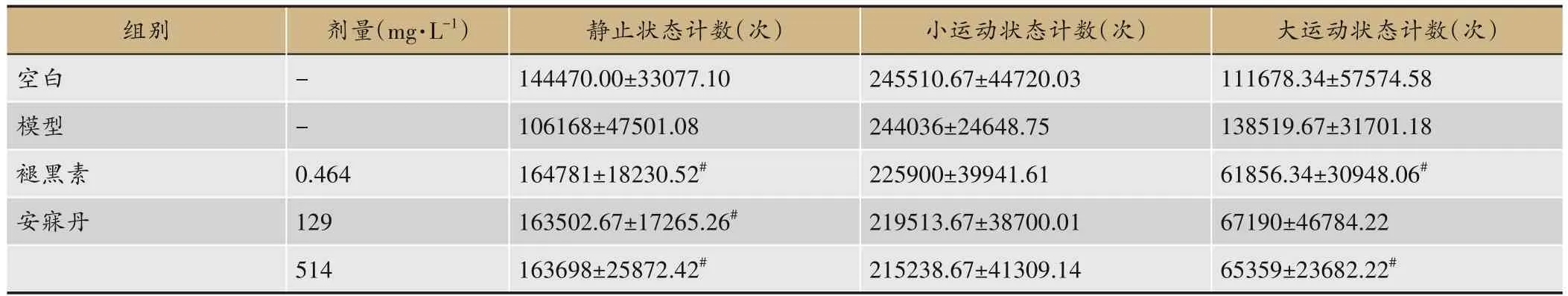
表2 各组24 h不同状态总计数(n=4)
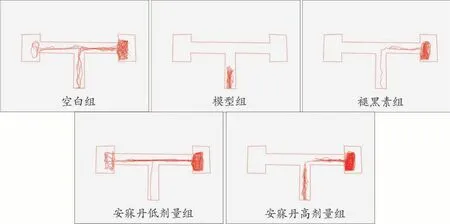
图2 正式实验各组T迷宫轨迹图(n=5)
2.3 安寐丹对斑马鱼中脑神经元的影响
尼氏染色是观察神经细胞改变的一种检测方法,染色结果显示,空白组斑马鱼中脑组织神经细胞数目正常,视盖区细胞集中分布在中央灰质层,尼氏小体多见,着色显著,核相对完整。与空白组比较,模型组中脑神经细胞数目明显减少,细胞周围裂隙增宽,尼氏小体明显减少,着色浅。经安寐丹干预后,SD斑马鱼神经元胞体较为饱满,丢失情况明显好转,尼氏小体部分可见,着色加深,且高剂量效果优于低剂量组。褪黑素组同样可见中脑神经元数目增加,损伤减轻(图3)。
2.4 安寐丹对脑组织clocka、bmal1、cry1a、per1a、per2 mRNA表达的影响
Real time-PCR结果显示,与空白组相比,模型组bmal1和cry1a基因的mRNA相对表达量显著上调(P<0.01)。与模型组比较,褪黑素及安寐丹处理后能降低bmal1和cry1amRNA相对表达量(P<0.01)(表 5)。
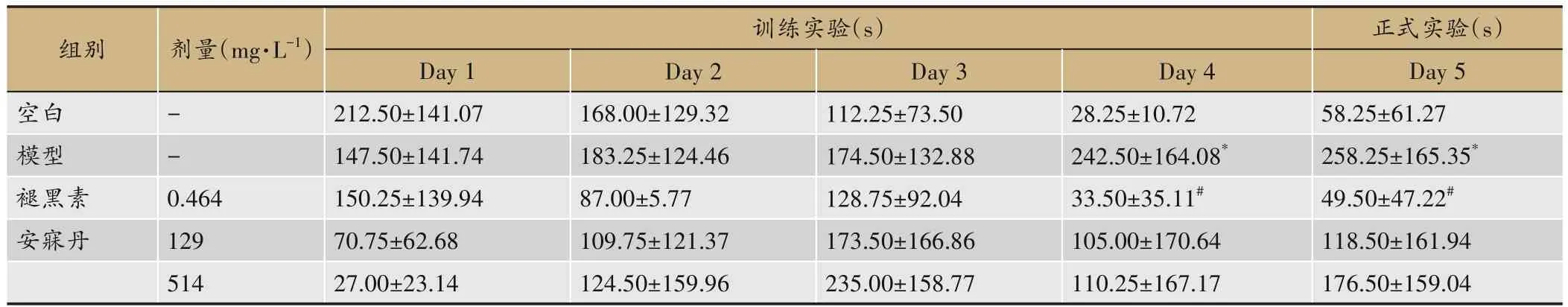
表3 各组第一次进入EC区时间(n=5)

表4 各组在EC区累计停留时间(n=5)
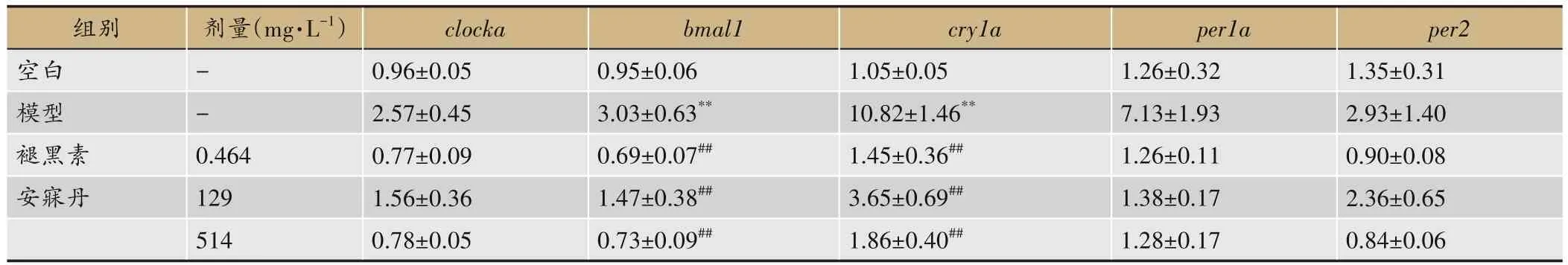
表5 各组斑马鱼脑组织clocka、bmal1、cry1a、per1a、per2 mRNA相对表达量(n=3)
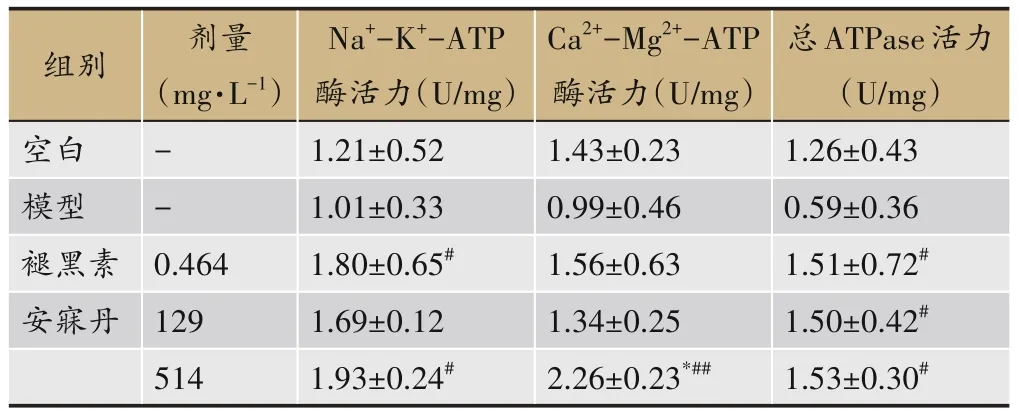
表6 各组斑马鱼肝脏Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶、总ATP酶活力(n=6)
2.5 安寐丹对肝脏Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶及总ATP酶活力的影响
模型组肝脏Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶及总ATP酶活性均较正常斑马鱼减少,但差异未见统计学意义。安寐丹干预后,高剂量组三种酶的活性均显著增加(P<0.05,P<0.01);低剂量组总ATP酶活力显著增加(P<0.05)。褪黑素组总ATP酶及Na+-K+-ATP酶活力显著增加(P<0.01)(表6)。
3 讨论
睡眠剥夺是一种造成动物失眠的有效方式[17],咖啡因是制造SD模型的常用中枢神经系统兴奋剂,通过结合神经递质腺苷A2A受体抑制睡眠,增强觉醒。我们前期实验结果证实咖啡因能有效诱导斑马鱼SD模型[18],尤其是高剂量的咖啡因,可以通过影响海马神经元凋亡加重SD模型认知损伤[19]。故本实验采用模式生物斑马鱼为研究对象,选取咖啡因诱导建立斑马鱼SD模型。实验结果发现与空白组相比,模型组24 h行为学节律特征降低,静止状态总计数、持续时长、覆盖距离均减少,运动状态则显著增加,并且以大运动为主;睡眠还可以帮助记忆信息存储,SD则会影响大脑编码神经元整合信息,降低学习记忆水平[17]。实验发现SD模型学习记忆能力受损,随着训练时间延长第1次进入EC区的时间未见缩短,与空白组相比,正式实验中进入EC区时间显著增加(P<0.05),累计停留时间减少;与人脑不同,鱼脑的形态是原始的,与视器有关的中脑占主要地位,通过发达的视网膜接收区来控制运动行为[20]。尼氏染色显示SD模型中脑神经细胞、尼氏小体数目减少,裂隙增宽,着色变浅,提示模型的行为学变化与神经细胞受损密切相关。
昼夜节律的产生依赖于生物体自身的生物钟系统以及钟控基因组建的复杂的调控网络,其中CLOCK和Bmal1形成异源二聚体诱导钟控基因PER和CRY的转录,并随着诱导基因的转移增多形成负反馈,构成了节律震荡最为重要的驱动回路[21]。因此我们从钟控基因入手继续探讨了造成模型行为学改变的机制,发现SD模型的核心生物钟基因clocka、bmal1(P<0.01)、cry1a(P<0.01)、per1a、per2mRNA表达水平较空白组升高,提示SD导致内源性生物钟紊乱,这可能是引起睡眠-觉醒周期异常的重要原因。
同时生物钟参与了机体能量代谢的调控并依赖于细胞膜上的离子泵等限速酶[22]。离子泵即ATP酶,钠钾泵是细胞的Na+-K+-ATP酶,钙镁泵是细胞的Ca2+-Mg2+-ATP酶,它们都参与了细胞逆浓度梯度的主动运输,且酶的活性与转运强度成正比。有研究发现SD令兴奋性神经递质谷氨酸释放,通过谷氨酸离子型受体使钙离子内流,细胞内钙离子含量升高[23]。我们实验也证实SD使能量代谢Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶及总ATP酶活性降低,会减少物质的交换和毒素的外排,从而破坏代谢稳态。提示SD会干预生物钟基因功能,打破肝细胞跨膜转运平衡,影响能量代谢。
安寐丹是中医治疗失眠症的代表方,针对上述SD导致的行为学、细胞形态学及分子生物学改变结果,我们发现与模型组相比,安寐丹能恢复模型昼夜节律特征,增加静止状态计数(P<0.05)、减少大运动状态计数(P<0.05);缩短第1次进入EC区的时间,增加EC区的停留时间;保护神经元胞体结构,增加尼氏小体数目;降低生物钟基因clocka、bmal1(P<0.01)、cry1a(P<0.01)、per1a、per2mRNA 相对表达量;升高 Na+-K+-ATP酶(P<0.05)、Ca2+-Mg2+-ATP酶(P<0.01)及总ATP酶(P<0.05)活力,并且结果呈现出剂量相关性。提示安寐丹对生物钟基因异常表达导致昼夜节律紊乱,影响能量代谢稳态,造成神经元损伤这一过程有显著的拮抗作用。
另外褪黑激素作为一种潜在的同时参与调节睡眠觉醒和能量代谢的激素[24],设为阳性对照药,实验发现褪黑素可显著改善SD斑马鱼的镇静和睡眠质量,维持代谢平衡,与安寐丹低剂量组相比在降低bmal1(P<0.05)、cry1a(P<0.01)mRNA水平上更为显著,但与安寐丹高剂量组相比未见明显差异。
综上所述,安寐丹可以恢复斑马鱼睡眠剥夺模型昼夜节律,增强学习记忆能力,保护神经元结构,其机制可能与干预bmal1、cry1a等生物钟基因,提高Na+-K+-ATP酶、Ca2+-Mg2+-ATP酶、总ATP酶等能量代谢酶活性相关。但本实验并未对生物钟干预能量代谢的关键途径进行深一步的探讨,后期将继续开展昼夜节律与能量代谢的关联性分析和机制研究。
