从中西医结合角度探讨PACAP对糖尿病及其并发症神经源性膀胱的影响*
2022-03-28韩栩珂邱现良陈一丁陈慧臻
韩栩珂,邱现良,朱 婵,陈一丁,陈慧臻,龙 聪,陈 秋**
(1.陕西中医药大学针灸推拿学院 咸阳 712046;2.成都中医药大学附属医院 成都 610072;3.四川大学华西第二医院 成都 610021)
随着社会现代化的发展和人类饮食结构的改变,糖尿病已经成为威胁全人类健康的主要风险因素之一。据统计,全球约有4.15亿人患有糖尿病,占世界成年人口的1/11,预计到2040年,全球糖尿病患者将增至6.5亿[1]。糖尿病的常规治疗方案多以控制血糖和缓解临床症状为主,但这种基础治疗并不能阻止并发症的发生和发展[2]。糖尿病并发症是由于机体组织和器官长期处于高血糖环境下而受损,进而产生的慢性病变,主要包括破坏性的大血管并发症(心脑血管疾病)和微血管并发症(糖尿病肾病、糖尿病视网膜病变和神经病变)等,导致糖尿病患者死亡率增加、失明及肾功能衰竭风险增高、总体生活质量下降[3]。糖尿病神经源性膀胱(Diabetic neurogenic bladder,DNB)是糖尿病常见的慢性并发症之一,由于约80%的糖尿病患者有包括尿频尿急、尿潴留和尿失禁在内的尿路症状[4],若治疗不当,可引起泌尿系感染和尿路梗阻,导致或加重肾功能不全,有引发败血症、肾功能衰竭的风险[5]。因此,寻找新的治疗靶点来干预糖尿病及其并发神经源性膀胱显得极为重要。PACAP作为生物学功能多样的细胞保护肽[6],在机体中广泛分布,不仅存在于中枢及周围神经系统中,而且在以胰腺为主的肝肾胃肠、脂肪肌肉、眼角膜等组织器官中也大量存在[7]。相关研究报道,PACAP及其衍生物不仅能改善糖尿病动物的胰岛素抵抗并修复胰岛β细胞功能,而且能够在不引起肾上腺素分泌和糖原分解的前提下提高机体胰岛素敏感性,极有可能成为治疗糖尿病及其并发症的新型候选药物[8]。故本文从多角度对PACAP治疗糖尿病及其并发症神经源性膀胱的机制进行综述。
1 PACAP的基因及分子结构概述
PACAP是于1989年发现的一种下丘脑神经肽,在之后的30年中,大量研究证实了其具有包括抑制凋亡、抗炎、抗氧化和促进细胞可塑性在内的数百种功能,PACAP被视为神经递质、神经营养及细胞保护因子、血管扩张和免疫抑制剂,可用于多种疾病的防治[9-13]。甚至有研究认为,PACAP作为一种天然存在的阳离子肽,可用于抗生素耐药性感染药物的研发[14]。简而言之,PACAP是已知神经肽列表中能够对多种组织损伤刺激提供内源性控制的高效代表性细胞保护肽[15],可通过不同的信号转导通路或受体发挥相应的生物学效应。PACAP被归于促胰液素/生长激素释放激素/血管活性肠肽家族,能够调节中枢神经系统、胃肠道、血管以及胰岛的功能[12]。PACAP有PACAP38和PACAP27两种形式,它们是由称为Prepo-PACAP的PACAP前体通过替代加工生产的。在人体内,Prepo-PACAP含有176个氨基酸残基,且人的PACAP基因定位于染色体18p11带区[16]。其中PACAP38含有38个氨基酸残基,而PACAP27则含有PACAP38 N端的1-27个氨基酸残基(图1)[17],并且在所有组织中PACAP38的表达明显高于PACAP27。在巨大的生物进化压力之下,PACAP依旧具有很高的保守性,在哺乳动物中保留了其关键的生物活性序列,在脊椎动物中PACAP38为主要存在形式[18],足以证明PACAP具有重要的生理功能。PACAP不仅在外周自主神经和感觉神经元中均有表达,还能够根据靶组织中受体亚型的表达不同,而发挥相应的下游效应。PACAP在维持多种生理系统的稳态方面起着关键作用,包括:生产和调控内分泌激素、影响心血管反应、糖代谢、胃肠运动、排尿、痛觉和生殖细胞发育。此外,PACAP可调节多种中枢功能,包括:进食/饱腹感、认知和学习/记忆及压力相关行为[10]。
2 PACAP受体概述
PACAP受体可分为两大组,分别是PAC1-R和VPAC-R(VPAC1与VPAC2),均为G蛋白偶联受体。由于PACAP和血管活性肠肽(Vascular intestinal peptide,VIP)的氨基酸序列高度同源,所以VPAC1-R和VPAC2-R对PACAP38、PACAP27和VIP具有相当的亲和力,但PAC1-R对PACAP38和PACAP27的亲和力至少是VIP的1000倍(图2)[19]。故研究认为,虽然VPAC1-R与VPAC2-R对VIP也有高亲和力,但PAC1-R是PACAP的特异性受体[17]。总得来说,PACAP主要通过其特异性受体PAC1-R以及下游的蛋白激酶 A(Protein kinase A,PKA),蛋白激酶 C(Protein kinase C,PKC)和丝裂原活化蛋白激酶(Mitogen activated protein kinase,MAPK)激活多种保护途径[20]。目前已知的PAC1受体剪接变体有8种,其受体的反式激活和非依赖性细胞摄取解释了PACAP对不同器官组织的多样性效用[13,21-22]。
而PACAP受体间主要有以下几个区别:①来源不同:PAC1-R最初是从大鼠胰腺腺泡癌细胞中发现的,而VPAC1-R则是通过大鼠肺cDNA文库与分泌素受体cDNA的交叉杂交克隆获得,VPAC2-R是从大鼠垂体cDNA文库得到[23]。②基因定位不同:PAC1-R基因定位于人染色体7p14.3带区,而VPAC1-R基因定位于人染色体的3p22.1带区,VPAC2-R基因则定位于人的染色体7q36.3带区[17]。③分布不同:PAC1-R主要分布于垂体、胚胎神经和外周组织(肾上腺及视网膜等)中,而VPAC1-R主要在于海马、大脑皮质、肠道、肺及肾上腺髓质中表达,而VPAC2-R主要在存在于β胰岛细胞、丘脑、脾脏和生殖系统的平滑肌[24-25]。④介导信号通路不同:PAC1-R主要介导Ca2+、磷脂酶C(Phospholipase C,PLC)以及腺苷酸环化酶(Adenylate cyclase,AC)等信号,而VPAC1-R主要参与PLC和AC的跨膜信号转导,VPAC2-R仅激活AC信号通路(表1)。
3 糖尿病神经源性膀胱概述

图1 Prepo-PACAP与PACAP38、PACAP27的生物活性肽结构关系

图2 PACAP和VIP受体亲和力的比较
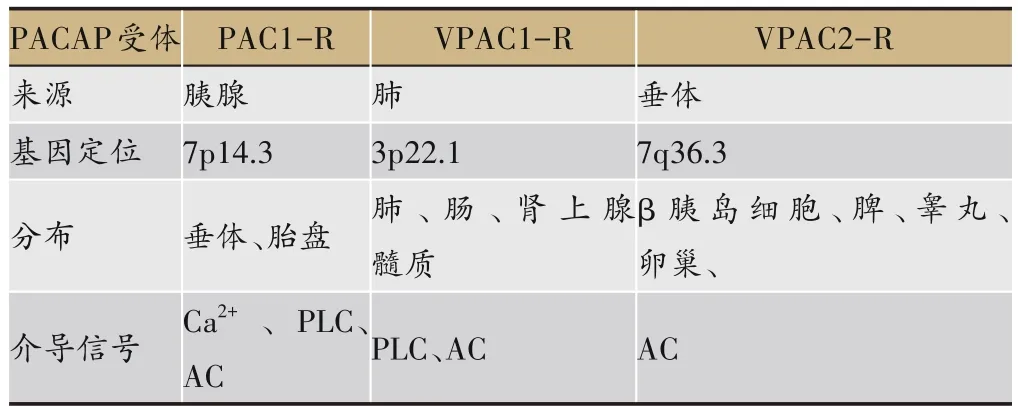
表1 PACAP受体间的区别。
糖尿病神经源性膀胱(Diabetic neurogenic bladder,DNB)是糖尿病性神经病变在泌尿系统中的一种常见表现,其主要病理原因是机体长期处于高血糖环境下,引起的周围神经节段性的脱髓鞘病变和自主神经传导障碍,进而导致的排尿反射异常、膀胱功能障碍,其主要临床特征是膀胱感觉神经受损、逼尿肌收缩力下降,残余尿量和膀胱容量增加,主要临床表现为尿频尿急、尿失禁、尿潴留、尿淋漓不尽等排尿功能障碍[26-27]。据文献资料显示,糖尿病患者DNB的患病率为40%-80%,血糖水平调控理想的状态下DNB的发生率仍为25%,在糖尿病进展10年后出现DNB相关症状的概率可高达50%[28-30]。近些年来,中国DNB的发病率已呈上升的趋势,随着DNB病程的进展不仅引起血糖波动,还有发生泌尿系感染、败血症、肾功能衰竭等严重全身性疾病的风险。现代西医针对DNB的治疗方案仅是在保守生活干预及控制血糖的基础上,营养神经抗氧化以期减少残余尿量,预防上尿路损伤。但由于DNB患者通常在发现血糖升高的急性期后和早期出院,疗程不足,缺乏对膀胱功能的恢复和重建的长期干预方案,可能引起包括肾损伤在内的一系列并发症,故而此类西医基础治疗方案疗效不尽人意[31],给患者生活质量和社会经济都带来了巨大的风险和压力。此外,有关DNB的自然史和生理病理学信息非常有限,实际上对DNB的研究明显落后于糖尿病其它并发症,从而阻碍了DNB最佳治疗手段的研发[32]。因此,如何安全有效的治疗DNB,最大程度地修复患者受损膀胱功能,减轻泌尿系临床症状,延缓病情进展,改善患者生活质量是临床迫切需要解决的难题与医学研究热点,寻找一种对DNB行之有效的治疗手段是目前迫切需要解决的医疗需求。
4 PACAP对糖尿病的影响及其作用机制研究
之前的研究表明,PACAP以自分泌或旁分泌方式对胰岛β细胞产生营养作用,它刺激胰腺的主要内分泌功能(胰岛素的产生和释放),维持β细胞对葡萄糖的反应,并调节细胞增殖和细胞活力[18,33-36]。目前研究认为PACAP及其受体能够双向调控能量内环境稳定及代谢平衡,具体表现为:当机体处于高血糖环境时,PACAP会促进胰岛素分泌,并显著提高胰岛素受体的敏感性;而当机体处于低血糖环境时,PACAP将加快胰腺淀粉酶和脂肪酶的分泌,同时加速肝糖原分解以升高血糖[37-38]。相关研究认为PACAP既是一种新型的外周营养素传感器,又是一种潜在的食欲抑制剂和促食/厌食激素调节剂,它可通过PAC1-R调节机体食物摄入量和饱腹感。该研究发现与PAC1-/-小鼠相比,向体内注射PACAP38/PACAP27明显降低了WT小鼠摄食量。并且,无论是禁食还是餐后,PAC1-/-小鼠的血浆胰岛素水平都显著低于WT小鼠[39]。另一方面,虽然像PACAP这样的分子通常被认为是营养因子,但由于其在脉管系统中的特殊生物学作用(受微环境和共存因子影响),因此PACAP也被定义为“血管生成的非典型内源性调节因子”,与糖尿病内皮功能障碍关系密切[13]。虽然PACAP既不能诱导微血管内皮细胞增殖活性,也不能对此类细胞系的细胞活力产生内在影响,但PACAP可能通过抑制活性氧自由基(Reactive oxygen species,ROS)诱导的氧化应激来防止高糖引起的细胞死亡[40]。因此,在高血糖条件下,PACAP可能发挥双重调控作用:生长抑制/保护作用,阻止异常激活的新生血管形成,并防止ROS介导的细胞凋亡。
PACAP作为胰岛G蛋白偶联受体,能够调节胰岛功能,是治疗2型糖尿病的潜在靶标。因此,有研究使用基因工程技术制备了PACAP的衍生物MPL-2,发现MPL-2能够明显改善2型糖尿病小鼠的胰岛素抵抗、葡萄糖耐量和血脂常数,提高胰岛素敏感性,显著降低小鼠体质量、空腹血糖,并且在修复胰岛β细胞的基础上不引起肾上腺素分泌和糖原分解[8]。进一步明确了PACAP治疗2型糖尿病的生物学作用,为其治疗糖尿病提供了更深入的药理学研究基础。
5 PACAP对膀胱功能的影响及其作用机制研究
PACAP及其同源PAC1-R受体在下尿路分布中具有组织特异性,其在膀胱平滑肌、尿路下神经丛和周围血管内的神经纤维中广泛表达[41-42]。在脊髓中,PACAP免疫反应性在腰椎(L1-L2)节段以及参与排尿反射的下腰骶(L6-S1)脊髓区域显著增加[43-44]。下尿路功能障碍(尿急、尿频和尿失禁等)产生的基本原因,可能是中枢和周围神经系统的膀胱反射通路中PACAP及其受体的表达失衡。排尿途径中的PACAP/受体系统平衡可能是治疗膀胱功能障碍的潜在靶点。研究发现,在具有膀胱功能障碍某些临床症状的转基因小鼠模型中,阻断PACAP/PAC1-R系统可降低排尿频率,推测PACAP相关信号有助于刺激膀胱传入神经兴奋性和激活尿路上皮中的Ca2+信号,这可能是影响膀胱功能的重要原因[45]。相关研究也报道,PACAP基因破坏导致膀胱形态和功能以及躯体和内脏感觉的改变,研究发现[46]PACAP基因敲除小鼠膀胱重量增加,膀胱固有层和逼尿肌明显增厚,小鼠表现出膀胱容量、排尿量和排尿收缩间期增加,逼尿肌收缩持续时间显著延长,残余尿量增加。在进行体细胞敏感性测试时,与对照组小鼠相比,PACAP基因敲除小鼠对后肢和骨盆刺激的敏感性较低。其它研究报道[47],PACAP27和PACAP38可激活尿路上皮细胞的PAC1受体释放ATP,这可能会激活在尿路上皮下神经丛中相邻感觉神经纤维以及其他组织(包括逼尿肌平滑肌和固有层间质细胞)上表达的嘌呤能受体。而PAC1受体拮抗作用可阻断ATP释放,表明通过PAC1受体的PACAP信号传导可以在尿路上皮水平调节排尿反射功能。使用PAC1受体拮抗剂的药理学研究表明,PACAP及其受体可能在调节膀胱功能障碍中发挥作用[48]。而鞘内和膀胱内两个不同给药途径,却具有相似的改善作用。鞘内注射PACAP38可能作用于脊髓背角神经元以阻止从C类纤维传入神经中释放PACAP,而膀胱内注射PACAP38可能靶向尿路上皮细胞、尿路上皮下神经纤维或逼尿肌平滑肌细胞。因此,鞘内或膀胱内阻断PACAP/PAC1-R可能是干预DNB的一个潜在靶点。
6 PACAP对DNB的影响及其作用机制研究

图3 PACAP信号途径与肌球蛋白系统磷酸化介导肌丝滑行
目前认为DNB的主要形成机制与以下3个方面有关:①膀胱感觉神经异常,DNB是糖尿病下尿路外周神经的病理表现,这是因机体长期处于高血糖环境,引发阶段性神经脱髓鞘和轴突损伤,神经传导系统阻滞,所导致的膀胱感觉功能减退[49];②膀胱运动神经异常,这是由于去甲肾上腺素和胆碱乙酰化酶的活性降低、胆碱能M受体改变、膀胱颈部内皮素受体紊乱等多种因素所直接引发的膀胱舒张功能障碍[50];③逼尿肌肌源性病变,这与逼尿肌肌球蛋白含量变化、Na+-K+通道活性降低、胞内Ca2+浓度升高、逼尿肌细胞代偿性肥大、线粒体减少、所产生的逼尿肌兴奋性降低、膀胱顺应性改变有关[51-52]。PACAP作为一种神经肽对神经肌肉调控有着重要作用,可直接影响肌肉收缩和舒张活动,也可间接作用于交感和副交感、嘌呤能、氨基酸递质及其他神经肽类递质以调节肌肉活动。研究发现PACAP38可激活尿路上皮细胞的PAC1受体释放ATP,以激活逼尿肌上的嘌呤能受体,再次佐证了PACAP传导信号通过上调cAMP水平对DNB逼尿肌功能的控制作用[47]。目前研究认为PACAP 通过介导cAMP激活PKA调节DNB逼尿肌收缩的主要机制为:①cAMP通过抑制L型电压依赖性钙通 道(L-typevoltage-dependent calcium channel,LVOC),阻止胞外Ca2+内流至肌细胞,降低胞内Ca2+浓度以舒张平滑肌;②cAMP可能抑制了细胞内的收缩元件磷酸化水平,低其对Ca2+的敏感度以诱导平滑肌舒张[53]。已有研究发现PACAP通过cAMP激活PKA以帮助平滑肌细胞舒张[54-55]。在膀胱逼尿肌的收缩与舒张过程中,肌球蛋白系统起着关键作用,由于肌肉收缩的经典“磷酸化”途径,与Ca2+浓度变化有关,故膀胱逼尿肌的收缩活动也受肌球蛋白系统细胞内Ca2+水平变化引起的磷酸化、去磷酸化影响。PACAP则与肌球蛋白系统密切相关,PACAP最基础的作用是活化AC,以催化ATP,升高cAMP水平。静息状态下,细胞内cAMP的含量非常低,PKA作为未被激活的钝性复合体存在。当胞内cAMP含量升高至一定水平,才能激活PKA,而活化的PKA具有极高的磷酸化能力,能够调控逼尿肌肌球蛋白系统收缩元件磷酸化水平[56]。PKA可直接磷酸化肌球蛋白磷酸酶靶亚单位1(Myosin phosphatase target subunit 1,MYPT1),增强肌球蛋白轻链磷酸酶(Myosin light chain phosphatase,MLCP)活性,最终加速肌球蛋白轻链(Myosin light chain,MLC)的去磷酸化[57]。此外,PKA可磷酸化平滑肌收缩元件肌球蛋白轻链激酶(Myosin light chain kinase,MLCK)上的残基,改变MLCK构像后,使其与Ca2+-CaM的结合能力下降,直接导致肌球蛋白磷酸化所需的Ca2+浓度升高,对MLC产生级联反应,使MLC去磷酸化对Ca2+的敏感度降低ATP分解减少,从而导致平滑肌舒张[58]。此外,研究也证实了PACAP38还能通过调节膀胱细胞中的Ca2+活性以影响ATP释放,推测将肌球蛋白调整至静息的去磷酸化状态从而影响了膀胱神经活动[45]。由于膀胱逼尿肌的舒缩主要依赖于肌球蛋白系统引起肌丝滑动相关收缩元件介导,逼尿肌细胞相关收缩元件磷酸化水平改变是膀胱功能障碍的重要基础。因此,总得来说,与PACAP有关的cAMP/PKA信号途径参与了肌球蛋白系统的磷酸化,平衡PACAP系统可能是治疗DNB的始动靶点(图3)。
7 针刺通过PACAP信号通路对DNB的影响及其作用机制研究
在许多国家的临床实践中,针灸已被广泛用于治疗膀胱功能障碍和改善神经功能[59-61]。相关临床研究也明确了针灸治疗膀胱功能障碍的优势,包括缓解症状(改善慢性尿潴留和尿失禁)、改善患者的生活质量以及延缓DNB的进展[62-63]。研究已经证实了针刺对内分泌、免疫、交感神经和副交感神经系统的积极作用[64]。电针治疗DNB能够双向调控阴部神经-膀胱反射-尿道括约肌舒缩,以调节尿道压力,减少残余尿量和膀胱最大容量,从而改善膀胱顺应性和逼尿肌活动,以缓解临床症状[65]。因此,作为一种可行的补充和替代疗法,针灸治疗DNB的有效性已逐渐得到内分泌学领域专家的认可[66]。相关动物实验也已证明电针能有效抑制大鼠膀胱过度活动、改善膀胱顺应性、减少膀胱组织的病理损伤、并改善膀胱功能[67-68]。祖国传统医学并无“糖尿病神经源性膀胱”的病名记载,根据其临床症状可归属为“消渴”并发“淋证”、“癃闭”范畴。《医宗必读》曰:“脾土主运行,肾水主五液”,本病病位首在肾与膀胱,脾肾阳虚为发病之本,随着疾病传变涉及多个脏腑。《圣济总录》:“消渴日久,肾气受伤,肾主水,肾气衰竭,气化失常,开阖不利”。《灵枢》曰:“肾脆,则善病消瘅易伤”。故本病病因为消渴日久,肾气受损。而核心病机则是肾阳不足,命门火衰,气化失司,膀胱失约。《针灸大成》中指出针刺次髎“主小便赤淋”,针刺中髎、下髎“主大小便不利”。《证治准绳·杂病》曰:“小便不通,先艾灸三阴交”。有研究在进行数据挖掘后发现,中髎和三阴交是临床针灸治疗膀胱功能障碍最常用的两个穴位[69]。中髎和三阴交处的肌肉组织由脊髓排尿中心的同一节段(S2-S4)支配,电针刺激产生的传导信号能不同程度影响膀胱的骶髓排尿中枢,促进逼尿肌和膀胱括约肌的节律性收缩,增强其协调功能,从而调控膀胱排尿功能[70]。研究发现,针刺中髎和三阴交穴激活的神经信号传导节段与机体低水平位置的脊髓排尿中枢存在多个重叠点位[71]。基于此,课题组观察了电针中髎和三阴交对DNB大鼠模型的影响及其机制,发现电针可以通过逆转膀胱粘膜层和逼尿肌平滑肌细胞的损伤来减轻膀胱肥大,从而改善DNB,这可能主要是通过p-MLC和p-MLCK水平来实现的[72]。先前的研究已经证实,PACAP蛋白可以通过cAMP调节PKA,进而松弛平滑肌[73-74]。此外,研究发现电针可通过上调PACAP38和PAC1-R蛋白表达以调控神经源性膀胱大鼠的尿流动力学[75]。而最新研究也佐证了电针可通过上调膀胱逼尿肌中PACAP38、cAMP及PKA表达,以激活PACAPCAMP-PKA信号通路,从而缓解膀胱逼尿肌无抑制性收缩,以改善脊髓损伤后神经源性膀胱大鼠膀胱功能[76]。
8 小结与展望
作为重要的神经肽,PACAP与糖尿病的病因学关系及在调控DNB功能方面的特殊作用尚未完全阐明。有研究报道,糖尿病动物逼尿肌内MLC的磷酸化水平显著升高[77]。目前,人们普遍认为膀胱逼尿肌的收缩是一个Ca2+-ATP交互影响过程。逼尿肌内Ca2+水平升高,与无活性的CaM结合转化为活性Ca2+-CaM复合物,并激活MLCK,从而影响MLC磷酸化,在这个过程中,足够的ATP可以被分解,为肌球蛋白和肌动蛋白之间的交互作用提供能量,从而导致逼尿肌收缩[78-79]。因此,推测PACAP38水平越低,MLC磷酸化程度越高,平滑肌纤维收缩强度越大,而升高PACAP38水平,可抑制MLC磷酸化以促进逼尿肌舒张,缓解膀胱功能障碍相关症状。而针刺治疗DNB具有双向调节作用和多靶点、多环节、多系统特征,可能反应在针刺通过PACAP表达途径,将逼尿肌的收缩舒张与多种信号通路和多种效应蛋白衔接[80]。我们推测,针刺能够调控DNB模型大鼠膀胱逼尿肌的PACAP水平和细胞内Ca2+浓度,以升高cAMP和PKA含量,使其下游肌球蛋白系统相关收缩元件产生级联反应(如MLCK磷酸化、MLC去磷酸化),以改善横桥ATP能量代谢,肌球蛋白与肌动蛋白肌丝摆动引起的收缩活动被阻断,肌丝滑行张力下降,从而诱导逼尿肌舒张,可能是改善膀胱功能障碍的枢纽。
目前针灸干预DNB的研究以临床试验为主,有关效应机制的基础实验不足,此外多数神经源性膀胱研究以脊髓损伤后大鼠模型为核心,聚焦DNB模型的PACAP信号通路研究较少[81]。故本文存在一定的不足之处,针灸干预DNB的基础研究较少,未能完整清晰的阐述针灸通过PACAP通路介导DNB的机制,仅基于现有文献做了前瞻性的讨论。因此,未来研究可以进一步探讨针灸对DNB模型大鼠逼尿肌PACAP信号通路肌球蛋白系统磷酸化水平的影响,这是现阶段极具潜力的创新研究方向,可能为针灸治疗DNB提供新的实验证据和科学理论支撑。
