氧化石墨烯/二氧化锰的制备及应用
2022-03-28王苗林玫陈祖亮
*王苗 林玫 陈祖亮
(福建师范大学环境科学与工程学院福建省污染控制与资源循环利用重点实验室 福建 350007)
近年来,各种工业废水的排放以及电子废物的随意丢弃,使得水体的重金属污染已经成了一个不可忽视的问题[1]。在这些重金属中,铅的危害尤为严重。环境中的铅污染主要来自于含铅涂料、采矿、冶炼、铸造等工业生产活动。被铅污染的食品、水以及污泥施用于农业土壤等,进入食物链,和人体长期接触[2]。铅在体内的半衰期长,对许多器官、系统和生理功能均有危害[3]。
目前,处理含铅废水的方法有很多,包括吸附、电解、离子交换和膜分离技术[4]。其中吸附法对于其他技术而言,拥有制备成本低、操作简单、设备要求低、适用范围广等优点,在实际应用中去除重金属离子有明显的优势[5]。
石墨烯由于其结构中含有大量的褶皱孔穴和较大的比表面积,因此它作为一种新型的碳纳米吸附材料备受关注[6]。氧化石墨烯(Graphene Oxide,GO)是石墨烯的一种重要衍生物,不仅具有上述性质,而且还含有很多含氧基团,如羟基、羧基和环氧基等,所以GO具有良好的亲水性,这些含氧基团也为氧化石墨烯的功能化提供了大量接触点[7]。与其他的吸附剂相比GO的制备成本较低,合成条件温和,吸附性能优越,能更好的应用于含铅废水的处理。但是常规制备的GO存在易团聚的缺点。GO表面含有大量含氧官能团,所以在其表面可以比较容易引入一些金属离子,从而实现GO的功能化,提高GO的分散性和稳定性[8]。锰纳米粒子是一种无毒无害的材料。由于其具有催化氧化性强、吸附能力好、耐酸性等优点在环境修复方面表现出巨大的潜能。
本文提出以氧化石墨烯、氯酸钡和硫酸锰作为原料制备氧化石墨烯/二氧化锰复合材料,不仅缓解了GO的团聚,同时提高了其吸附性能。
1.实验部分
(1)试验试剂
石墨粉(C,8000目,纯度99.95%)、硝酸钠(NaNO3),上海阿拉丁生化科技股份有限公司;浓硫酸(H2SO4)、高锰酸钾(KMnO4)、盐酸(HCl,36%-38%,GR)、氢氧化钠(NaOH)西陇化工股份有限公司;30%双氧水(H2O2)、氯酸钡(Ba(ClO3)2·H2O)、硫酸锰(MnSO4)、氯化铅(PbCl2),上海国药化学试剂有限公司。以上试剂均为AR级别。
(2)主要仪器设备
精密pH计(PHS-3C),上海精密科学仪器有限公司;离心机(TG16-WS),湖南湘仪实验仪器开发有限公司;扫描电子显微镜(JSM-S4800),日本JEOL公司;火焰原子吸收光谱仪(PinAAcle 900F),美国铂金埃尔默有限公司。
(3)实验方法
①氧化石墨烯/二氧化锰的制备
氧化石墨烯是采用改良的hummer's方法制备[8]。称取12.42g Ba(ClO3)2·H2O和6.83g MnSO4,分别加入50mL和30mL去离子水中,搅拌均匀。然后将两种溶液混合搅拌15min。在离心机上以速率5000r/min离心30min,取上清液即为Mn(ClO3)2溶液。称3份GO,每份0.2g,分别加水20mL,超声分散均匀。分别加入1mL,2mL,5mL的Mn(ClO3)2溶液,于85℃磁力搅拌仪上搅拌,直至溶液没有气泡冒出;然后将溶液以5000r/min离心15min,上清液倒入表面皿,盖上保鲜膜,于冰箱冷冻后置真空冷冻干燥箱干燥48h。得到粉末GO/MnO2,根据MnO2含量命名为GO/MnO2-1、GO/MnO2-2、GO/MnO2-5。
②氧化石墨烯/二氧化锰去除Pb2+的批量实验
通过批量实验考察了不同反应条件(不同GO/MnO2投加量、pH、污染物初始浓度)对GO/MnO2去除Pb2+的影响。批量实验在装有20mL Pb2+溶液的50mL锥形瓶中进行。将锥形瓶放至反应温度为25℃的恒温震荡摇床中,转速为250rmp,取样时间分别为2min、5min、10min、15min、30min、60min、90min、120min、180min、300min。溶液按规定的时间间隔取出后,用0.22μm的滤膜过滤,溶液中残余的Pb2+浓度用火焰原子吸收光谱仪测定。去除效率的计算公式为:

式中,C0和Ct(mg·L-1)分别为溶液中Pb2+初始浓度和在t(min)时的浓度。
2.结果与讨论
(1)投加量对去除效果的影响
图1表明GO/MnO2-1、GO/MnO2-2、GO/MnO2-5的投加量分别为0.05g·L-1、0.10g·L-1、0.20g·L-1、0.40g·L-1、0.80g·L-1。随着投加量的逐渐增加,三种样品对Pb2+的去除率都在逐渐上升。当投加量小于0.2g·L-1时,三种GO/MnO2对Pb2+的去除率增加都比较迅速。投加量达到0.2g·L-1时,GO/MnO2-5的增长趋势趋于平衡,而GO/MnO2-1、GO/MnO2-2仍有增长趋势。当投加量从0.20g·L-1逐渐提高到0.8g·L-1时,三种吸附剂对Pb2+的去除率都趋于稳定,GO/MnO2-5对Pb2+的去除率最高。这是由于Pb2+离子浓度和溶液体积一定时,吸附剂较少会导致溶液中活性位点浓度较小,与Pb2+形成较大的浓度梯度,Pb2+扩散到GO/MnO2表明有较大的推动力。将吸附剂用量提升至一定程度,可增加溶液中吸附位点的数量,所以在吸附剂含量较低时,增加吸附剂的投加量,Pb2+的去除率增加得较快。吸附剂投加量大于0.2g·L-1时,GO/MnO2-5对Pb2+的去除率基本不变。溶液中吸附剂的活性位点浓度增加,且大部分Pb2+与被吸附从而导致浓度减小,降低了部分未饱和的吸附位点的有效性[6]。因此,本实验选择0.2g·L-1GO/MnO2-5中作为最佳投加量和吸附剂。

图1 不同GO/MnO2投加量对Pb2+去除效率的影响
(2)pH对去除效果的影响
图2表明,pH对Pb2+的去除影响较大。在pH为1-7范围内,随着pH的升高,GO/MnO2-5对Pb2+的去除率也逐渐升高。当pH为7时,去除效果达到最佳,Pb2+去除率为94.76%;pH为1时,去除率仅为3.85%。造成这一现象的原因可能是溶液pH增大时,H+浓度降低,GO/MnO2-5表面的负电荷增加,有利于Pb2+离子被吸附在GO/MnO2的活性点上。而pH较低时,由于溶液中H+离子浓度较大,从而导致H+离子与Pb2+产生竞争吸附,降低吸附效果,所以去除率较低[11]。因此,pH=7为GO/MnO2-5吸附Pb2+的最佳pH。

图2 pH对Pb2+去除效率的影响
(3)Pb2+浓度对去除效果的影响
图3表明,反应时间在0~15min时,GO/MnO2-5对Pb2+的去除比较迅速;15~90min内,去除速率增长缓慢;90~300min内,去除增长趋于平衡。其原因是GO/MnO2-5在吸附开始时,表面有着大量的吸附活性点位,因而去除迅速。随着去除时间逐渐增加,溶液中的Pb2+占据了大量吸附活性点位,吸附在GO/MnO2-5表面,溶液中残留的Pb2+浓度降低,所以去除速率降低。还有种可能是材料上已经被吸附的Pb2+产生的正电荷对溶液中未被吸附的Pb2+静电相斥,从而导致GO/MnO2-5吸附Pb2+的难度增加,Pb2+吸附增长逐渐缓慢[4]。

图3 Pb2+浓度对Pb2+去除效率的影响
当溶液中Pb2+浓度不大于20mg·L-1时,Pb2+的去除率差距不大,去除率的变化趋势也一致,Pb2+浓度为50mg·L-1时,去除率变化相对比较缓慢。当去除时间为300min时,10mg·L-1、20mg·L-1、50mg·L-1的Pb2+溶液的去除率分别为96.92%、93.95%和48.73%。这是由于Pb2+溶液浓度在一定的范围内,GO/MnO2-5表面的吸附活性点位数量大于Pb2+数量,吸附活性点位比较充足,所以去除速率较快,到达吸附终点时去除率也较大[9]。随着Pb2+溶液浓度的升高,GO/MnO2-5的吸附活性点位有限,所以吸附终点时去除率较小。
(4)最优条件的氧化石墨烯/二氧化锰的表征分析
SEM是一种用来观察材料的微观表面形貌的手段。从图4中可以看出GO/MnO2-5保留了GO特有的薄膜状,呈现不规则的曲面。GO表面的波纹褶皱特征,说明表面含氧官能团如羟基、羧基、环氧基较多。这一点与之前的报道一致[8]。MnO2呈现出球形,表面凹凸不平整,略显粗糙,球体的直径约为1μm。GO覆盖在球状MnO2表面,MnO2的存在增大了GO的比表面积,提高了GO/MnO2-5对Pb2+的去除性能。

图4 GO/MnO2-5的SEM图
XRD通常被用来研究材料的晶体结构。图5展示了GO/MnO2-5的XRD衍射图,从图5中可以观察到测量范围5°-80°内有三个特征峰,分别在2Theta=6.4°、2Theta=17.2°和2Theta=22.9°处。其中2Theta=6.4°处的尖峰归属于GO,这与之前的研究一致[10]。在2Theta=17.2°和2Theta=22.9°处的两个尖而广的峰,归属于MnO2,说明MnO2有着较好的晶型。这表明GO/MnO2被成功合成。
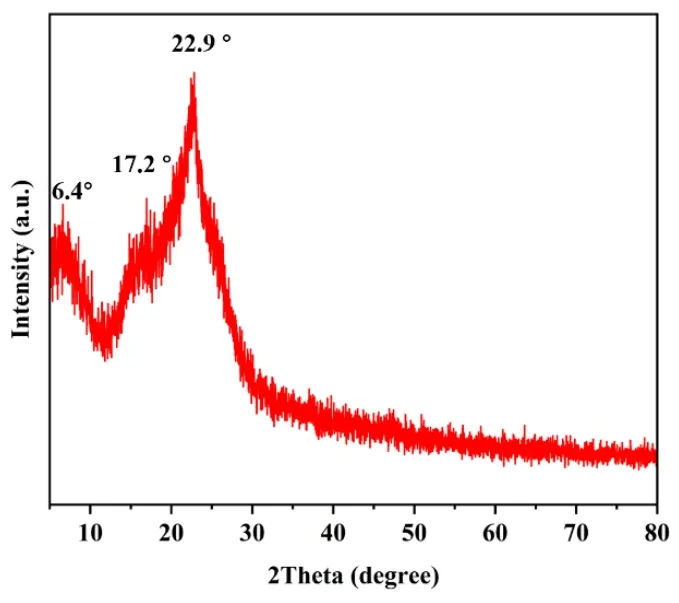
图5 GO/MnO2-5的XRD图
3.结论
本文以氧化石墨烯和硫酸锰为原料成功合成了氧化石墨烯/二氧化锰,且对Pb2+有着优异的去除性能,结果如下:
(1)添加量为5mL二氧化锰溶液合成的氧化石墨烯/二氧化锰对Pb2+的去除效果最佳;
(2)在pH=7,反应温度为25℃,投加量为0.2g·L-1时,GO/MnO2-5对Pb2+的去除率最高达到96.92%;
(3)通过SEM和XRD分析,最优吸附剂GO/MnO2-5的表面呈现典型的GO褶皱状和MnO2纳米球。
