牛奶发酵过程中阪崎克罗诺杆菌可形成活的非可培养状态
2022-03-28曹怡芳周爱莲白泓余以刚肖性龙
曹怡芳,周爱莲,白泓,余以刚,肖性龙
(华南理工大学食品科学与工程学院,广东广州 510640)
阪崎克罗诺杆菌,原名阪崎肠杆菌,隶属于肠杆菌科克罗诺杆菌属,是一种革兰氏阴性、无芽孢形成的兼性厌氧细菌[1,2]。感染阪崎克罗诺杆菌会导致新生儿脑膜炎、小肠结肠炎,甚至会造成新生儿、老年人和免疫功能低下人群的死亡[3,4]。已经从牛奶、婴幼儿配方奶粉、奶酪以及奶牛场等环境中分离出阪崎克罗诺杆菌[5-7]。为了预防阪崎克罗诺杆菌引起的相关疾病,需要更好地了解该菌在牛奶及奶制品生产加工或贮存过程中的生长状态,以便采取合适的控制措施确保乳制品的安全问题。
已经有一些研究报道了阪崎克罗诺杆菌在乳制品生产加工或贮存过程中的生存情况。Kim等[8]研究了含有乳酸菌、醋酸菌和酵母的开菲尔酸奶上清对婴幼儿配方奶粉中阪崎克罗诺杆菌的抑制情况。结果发现,用含 30%开菲尔上清的水冲泡已被污染的奶粉,在室温下孵育 1 h后平板上未检测到阪崎克罗诺杆菌的生长。研究发现可能是发酵过程中的有机酸发挥了作用[9]。Chang等[10]在四种不同品牌的酸奶中接种阪崎克罗诺杆菌和沙门氏菌,并在冷藏条件下保存5 d,结果表明开菲尔酸奶可以在冷藏过程中完全抑制致病菌的生长。Hayes等[11]将阪崎克罗诺杆菌NCTC 8155接种于复配婴幼儿配方奶粉中,然后加入不同浓度的嗜酸乳杆菌DPC 6026发酵液,实验结果显示较高浓度的发酵液可以在1 h内完全灭活阪崎克罗诺杆菌。Hsiao等[5]将阪崎克罗诺杆菌与嗜热链球菌或保加利亚乳杆菌在脱脂牛奶中混合培养,培养24 h后阪崎克罗诺杆菌活菌数量显著减少。研究还发现原味酸奶加工和贮存过程中 pH值和贮存温度是影响阪崎克罗诺杆菌存活的主要影响因素[12]。以上研究报道中对阪崎克罗诺杆菌的检测结果都基于平板计数法,但平板计数法可能会低估活菌数量。
活的非可培养状态(viable but non-culturable,VBNC)是微生物尤其是没有芽孢的细菌为了抵御不良环境时形成的一种休眠状态,当外界胁迫消除后即可恢复生长繁殖能力[13,14]。VBNC状态的细菌无法通过常规的平板培养进行检测。张竟丰等[15]总结了阪崎克罗诺杆菌进入VBNC状态的主要诱导因素:巴氏杀菌、寡营养、低温或干燥,但发酵产酸条件下该菌是否会进入VBNC状态尚不清楚。但Solomon H. Mariam等[16]的研究已经发现与乳酸菌进行共培养后,李斯特菌或沙门氏菌会进入VBNC状态,Liu等[17]和Deng等[18]也发现在啤酒发酵过程中植物乳杆菌会进入VBNC状态。
本研究选取了酸奶发酵中常用的菌株保加利亚乳杆菌,研究牛奶发酵过程中阪崎克罗诺杆菌和保加利亚乳杆菌在牛奶中的相互作用,并采用16S rDNA和PMA-qPCR技术鉴定阪崎克罗诺杆菌是否进入VBNC状态。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
阪崎克罗诺杆菌CICC 21544和保加利亚乳杆菌CICC 6045购于中国工业微生物菌种保藏管理中心。
1.1.2 培养基与试剂
乳酸细菌培养基(DeMan-Rogosa-Sharpe,MRS)、细菌基础培养基(Lysogeny Broth,LB)、胰蛋白胨大豆琼脂(TSA),购于广州环凯微生物有限公司;阪崎肠杆菌显色培养基(Druggan-Forsythe-Iversen,DFI)、酚酞指示剂,购于青岛海博生物技术有限公司;叠氮溴化丙锭(Propidium monoazide,PMA),购于北京海德创业生物科技有限公司;细菌基因组DNA提取试剂盒,购于北京天根生化科技有限公司;HiPure Soil DNA试剂盒,购于广州美基生物科技有限公司;无菌脱脂牛奶,购于当地卜蜂莲花超市。
1.2 仪器与设备
精密pH计,上海雷磁仪器有限公司;立式高压蒸汽灭菌器,上海博迅医疗生物仪器股份有限公司;超净工作台,苏州尚田洁净技术有限公司;台式高速冷冻离心机,赛默飞世尔科技有限公司;紫外可见分光光度计,上海棱光技术有限公司;卤钨灯(650 W),德国Osram公司;实时荧光定量PCR仪,美国伯乐公司;PCR仪,北京东胜兴业科学仪器有限公司;琼脂糖凝胶电泳仪,北京六一仪器厂;微量分光光度计,赛默飞世尔科技有限公司;凝胶成像系统,上海天能科技有限公司;小型高速离心机,德国艾本德股份公司;-80 ℃低温冰箱,山东青岛海尔股份有限公司。
1.3 试验方法
1.3.1 菌株活化
将保存于-80 ℃低温冰箱的阪崎克罗诺杆菌和保加利亚乳杆菌的甘油保存管取出解冻,用接种环蘸取后分别在TSA和MRS琼脂平板上划线,置于37 ℃恒温培养箱中孵育。分别挑取两种平板上的单菌落接种于LB和MRS培养基中,待其生长至稳定期后离心,用无菌生理盐水清洗菌体沉淀三次,并用生理盐水重悬浮得到菌悬液。
1.3.2 阪崎克罗诺杆菌与保加利亚乳杆菌在牛奶中的相互作用
按照1.3.1中的方法制备菌悬液,参照刘文文等[19]的方法,将100 mL牛奶95 ℃热处理15 min杀菌,冷却后接种10%的保加利亚乳杆菌进行发酵。在发酵过程中接种阪崎克罗诺杆菌,使其终浓度为 103CFU/mL。同时接种组样品,即在接种保加利亚乳杆菌的同时也接种阪崎克罗诺杆菌,发酵48 h;分开接种组样品,即在接种保加利亚乳杆菌12 h后再接种阪崎克罗诺杆菌,继续发酵48 h。以牛奶中只接种保加利亚乳杆菌或阪崎克罗诺杆菌为对照组。样品在37 ℃条件下进行发酵,每隔8 h取样测定发酵过程中牛奶pH值和酸度值的变化,酸度值的测定依照 GB 5009.239-2016《食品安全国家标准 乳和乳制品酸度的测定》[20]中的方法进行,同时取100 μL适当稀释后的发酵牛奶涂布于 DFI用于阪崎克罗诺杆菌活菌计数。
1.3.3 16S rDNA测序技术分析阪崎克罗诺杆菌和保加利亚乳杆菌在牛奶发酵过程中的分布变化情况
按照1.3.2中的方法制备测序样品,在牛奶中同时接种保加利亚乳杆菌和阪崎克罗诺杆菌,每8 h制一次样,共培养48 h。每次取样时将培养物充分振荡混匀后取适量样品,立即用液氮速冻5 min后置于-80 ℃低温冰箱保存备用。
利用细菌16S rDNA序列测序对样品中的细菌进行种属鉴定。从样品中提取基因组DNA后,用特异引物对细菌16S rDNA序列的V3-V4区进行PCR扩增,引物序列[21]为 341F(CCTACGGGNGGCWGCAG)和 806R(GGACTACHVGGGTATCTAAT)。然后将PCR扩增产物切胶回收,用QuantiFluorTM荧光计进行定量。将纯化的扩增产物进行等量混合,连接测序接头,构建测序文库,之后利用Hiseq2500 PE250上机测序。
测序得到原始数据之后,对低质量 reads进行过滤,然后进行组装和再过滤。为了研究样品的物种组成多样性信息,利用软件 Uparse对所有样品的有效tags序列进行运算分类单位(Operational taxonomic unit,OTU)聚类[22],默认以 97%的一致性将序列聚类成为 OTUs。之后根据其丰度和序列信息,开展物种注释、群落多样性等分析。
1.3.4 PMA-qPCR法检测牛奶发酵过程中的阪崎克罗诺杆菌存活状态
为了进一步验证在牛奶中与保加利亚乳杆菌共培养后,阪崎克罗诺杆菌的实际存活状态,采用 PMA与qPCR结合的方法进行检测。按照1.3.2的方法制备样品,以阪崎克罗诺杆菌在牛奶中单独培养作为对照,样品的PMA前处理参照Zhou等[23]优化后的方法,选取cgcA作为PCR扩增的目的基因,引物设计参照Hu等[24]的方法。PCR操作步骤参考Richard J. Kibbee等[25]的方法,用天根细菌基因组DNA提取试剂盒提取处理后的样品DNA,将提取的DNA模板与室温下溶解好的2X Robust SYBR Green qPCR ProMix、引物和ddH2O按照2:10:0.5:7的比例配制PCR反应液,总体积为20 μL。以不加DNA模板的反应液作为阴性对照(等量的ddH2O代替)。配制PCR反应体系的全过程均在冰上进行。按照如下条件设定Real-Time PCR的反应程序:95 ℃预变性10 min,95 ℃变性5 s然后退火至60 ℃保持20 s(收集荧光信号),该过程进行40个循环。
1.3.5 牛奶发酵过程中阪崎克罗诺杆菌对保加利亚乳杆菌产酸能力的影响
原料奶被阪崎克罗诺杆菌污染后再进行酸奶发酵,发酵菌剂的性能可能会受到影响。本实验将从保加利亚乳杆菌的产酸能力变化探究阪崎克罗诺杆菌对保加利亚乳杆菌的主要影响。产酸能力的鉴定参照罗强等[26]的方法,向100 mL无菌脱脂牛奶中,分别按5%和2%的接种量接入保加利亚乳杆菌和阪崎克罗诺杆菌,置于 42 ℃的电热恒温培养箱中发酵,直至凝乳后转移至4 ℃冰箱中存放24 h。取出后按5%的接种量转接于 100 mL新鲜的无菌脱脂牛奶中,同样42 ℃下发酵至凝乳后转移至 4 ℃冰箱中储存。重复上述操作,每重复1次算为1代,重复3次。将1、2、3代混合培养物与原保加利亚乳杆菌作对比,分别按5%的接种量接种到10 mL新鲜的无菌脱脂牛奶中,37 ℃下静置培养。用pH计每2 h测一次样品的pH值。保加利亚乳杆菌的产酸能力以单位时间内pH值的变化为评价指标。
1.4 数据处理
使用Microsoft Excel(2016)软件绘图,使用SPSS 22.0软件进行差异显著性分析,当p<0.05时,表明具有显著性差异。
2 结果与讨论
2.1 阪崎克罗诺杆菌与保加利亚乳杆菌在牛奶中的相互作用
图1是阪崎克罗诺杆菌和保加利亚乳杆菌在牛奶中共同生长时的pH值、酸度值和阪崎克罗诺杆菌存活量的变化情况图。由图1a和1b可以看出,阪崎克罗诺杆菌在牛奶中单独生长时对牛奶的pH和酸度值无明显影响,pH值维持在6.02以上,酸度值维持在27.20以下。而保加利亚乳杆菌在牛奶中单独生长时,24 h后pH可达到3.81,酸度值可达到133.80,发酵48 h后pH值可达到3.40,酸度值可达212.00。分开接种组样品中保加利亚乳杆菌在12~20 h的产酸速度明显快于同时接种组,pH和酸度值分别由 6.13和21.10变为4.20和93.80。发酵48 h后,同时接种组样品pH值和酸度值分别为3.50和193.30;分开接种组样品pH值和酸度值分别为3.47和214.30;分开接种组样品的pH和酸度值更接近保加利亚杆菌对照组。
阪崎克罗诺杆菌在牛奶中单独生长48 h后菌浓度可稳定在9.08 lg(CFU/mL);与阪崎克罗诺杆菌对照组相比,同时接种组样品中阪崎克罗诺杆菌的数量在接种24 h后达到最大值[8.85 lg(CFU/mL)],32 h后明显降低[6.24 lg(CFU/mL)],40 h后便检测不到阪崎克罗诺杆菌活菌存在;而分开接种组在接种后8 h达到最大菌落数量[5.11 lg(CFU/mL)],接种24 h后便检测不到阪崎克罗诺杆菌生长(图 1c)。结果说明,在牛奶发酵过程中,不论在早期还是中期被阪崎克罗诺杆菌污染,其生长均能完全被抑制;但在发酵中期感染阪崎克罗诺杆菌,该菌的增殖能被更好、更快地抑制。已经有研究报道了乳杆菌或其上清液的抑菌活性,Kim等[9]的研究推测可能是发酵过程中产生的有机酸营造的酸性环境发挥了抑菌作用。Lin等[27]发现蛋白酶会降低植物乳杆菌上清液的抑菌作用,推测上清液中含有肽类抑菌物质。本研究中同时接种组样品中,阪崎克罗诺杆菌数量在发酵24 h后迅速降低,可能与发酵液中有机酸和肽类抑菌物质的积累有关。
2.2 16S rDNA高通量测序技术分析阪崎克罗诺杆菌和保加利亚乳杆菌在牛奶发酵过程中的分布变化情况
样品的测序数据量和过滤分析效果如图2所示。去除由于PCR错误、测序错误等会产生的低质量数据或者无生物学意义数据(嵌合体)后,剩下的Clean tags用于后续分析,所占比例均超过93%,满足后续分析要求。
微生物物种分类一般分为界、门、纲、目、科、属、种7个等级,每个OTU代表某类型分类水平集合。Uparse在构建OTUs的过程中选取代表性序列组成集合,然后用算法与Green gene数据库进行物种注释,将置信度的阈值设定为0.80~1。根据OTU的物种注释信息,统计每个样品在各个分类水平上的tags序列数目,绘制柱状图如图3所示。
由图3可知,8 h内阪崎克罗诺杆菌在牛奶中可以大量生长,占据优势菌群位置(32.61%);发酵16 h后,阪崎克罗诺杆菌生长受到限制(13.62%),保加利亚乳杆菌成为优势菌群(29.39%),随着保加利亚乳杆菌发酵时间的延长,发酵液中保加利亚乳杆菌比例越来越高,阪崎克罗诺杆菌比例越来越低。但与2.1中DFI平板检测结果不同的是,阪崎克罗诺杆菌在牛奶中与保加利亚乳杆菌共生48 h后仍能被检测到,占比为7.17%。因此,此时的阪崎克罗诺杆菌可能处于VBNC状态,虽然不能在平板上生长,但利用分子层面的技术可以检测出来。16S rDNA高通量测序技术可以克服传统培养技术的缺陷,可以对不可培养的细菌进行序列检测,有研究报道了使用传统培养法,流式细胞术和16S rDNA高通量测序技术监测奶粉生产环境中不同清洁区域的致病菌污染情况,结果发现中等程度清洁区域可检测到VBNC状态的细菌,其中肠杆菌属占比7.02%[28]。陈燕[29]的研究发现16S rDNA高通量测序技术对沙门氏菌显色培养基上的蓝绿色菌落,即阪崎克罗诺杆菌的鉴定尤为重要,可为乳品企业中阪崎克罗诺杆菌的防治、排查及溯源提供依据。
2.3 PMA-qPCR法检测阪崎克罗诺杆菌在牛奶发酵过程中的实际状态
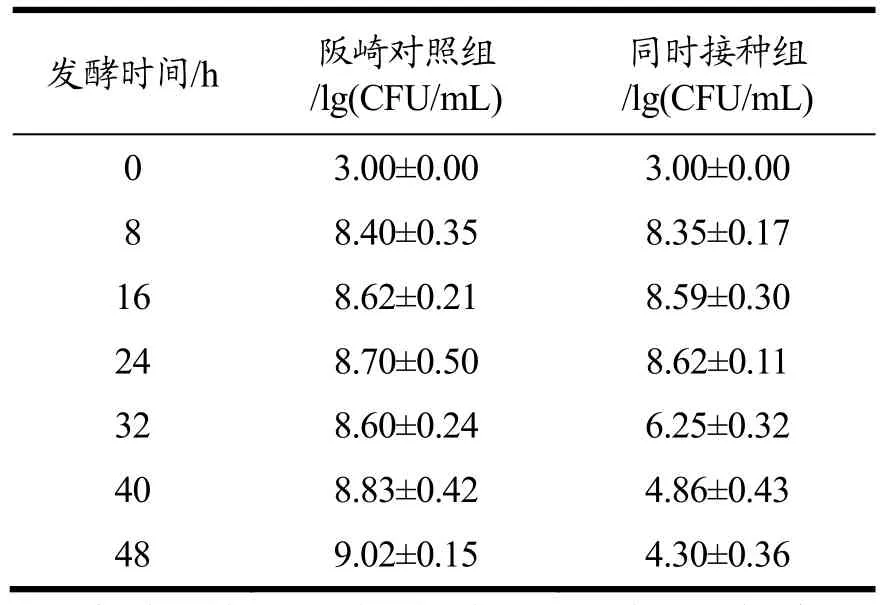
表1 PMA-qPCR法检测牛奶发酵过程中的阪崎克罗诺杆菌Table 1 Detection of C. sakazakii during milk fermentation by PMA-qPCR
与保加利亚乳杆菌在牛奶中共培养后,PMA-qPCR法检测阪崎克罗诺杆菌的结果如表 1所示。从表中可以看出,阪崎克罗诺杆菌在牛奶中单独培养时得到的结果与图1c中的结果一致,在16 h后菌落数量逐渐趋于稳定[9.02 lg(CFU/mL)];而二者同时接种组,共培养40 h后,图1c中结果显示DFI平板上无阪崎克罗诺杆菌生长,而PMA-qPCR仍检测到活的阪崎克罗诺杆菌的存在,活菌数大约为 4.30 lg(CFU/mL)。与图3中16S rDNA得到的结果一致,证实阪崎克罗诺杆菌确实进入了VBNC状态。刘艳艳等[30]的研究建立了PMA-PCR检测灭菌乳中阪崎肠杆菌的方法,确定了PMA-PCR法检测活阪崎克罗诺杆菌的可行性。本研究证明牛奶发酵过程可诱导阪崎克罗诺杆菌进入VBNC状态,除此之外,寡营养、低温或干燥等外界胁迫条件也可以诱导阪崎克罗诺杆菌VBNC状态的形成[15]。另外,有研究报道已经指出,VBNC状态下的阪崎克罗诺杆菌仍会表达相关毒力基因(hfp,ompA)[31],可对食品安全造成潜在隐患。
2.4 阪崎克罗诺杆菌对保加利亚乳杆菌产酸能力的影响
原保加利亚乳杆菌与1、2、3代样品的产酸能力如表2所示。从表2中可以看出,0 h时各样品的起始酸度相同,经过2 h发酵后,第3代保加利亚乳杆菌发酵样品 pH为 5.92,产酸能力显著低于原乳杆菌(5.65)(p<0.05);经过4 h和6 h发酵后,第2代和第 3代乳杆菌产酸能力均显著低于原乳杆菌(p<0.05);经过8 h发酵后,第3代乳杆菌产酸能力(4.93)也显著低于原乳杆菌(4.63)(p<0.05)。杨一冲等[32]对保加利亚乳杆菌的发酵特性进行研究,发现在发酵的2~6 h酸度上升的较快,pH值降低较快,与表2和图1a、1b中的结果是一致的。本研究中,经过相同的发酵时间,阪崎克罗诺杆菌在样品中存在的时间越长,保加利亚乳杆菌的产酸能力越弱。因此,待发酵的牛奶被阪崎克罗诺杆菌污染后不仅会对酸奶的安全造成威胁,也会对乳杆菌的产酸能力产生不良影响。
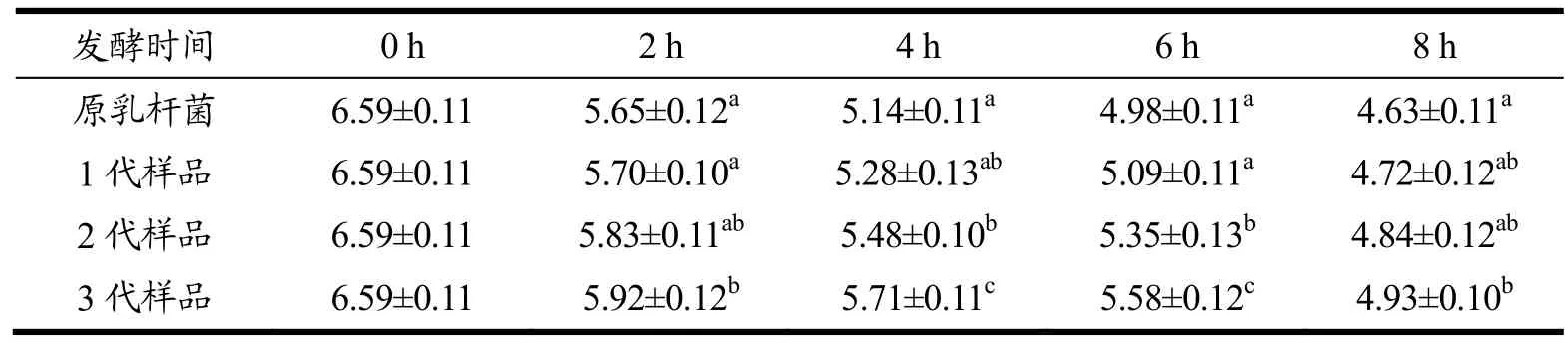
表2 不同样品的产酸能力Table 2 Acid production capacity of different samples
3 结论
本文利用保加利亚乳杆菌在牛奶中发酵对阪崎克罗诺杆菌施加胁迫。平板计数结果显示,不管在牛奶发酵过程中的前期或中期接种阪崎克罗诺杆菌,其生长都会被抑制。本文还利用16S rDNA高通量测序技术分析了这两种菌在牛奶发酵过程中的分布变化情况。结果表明,经过牛奶发酵后,虽然平板检测法检测不到阪崎克罗诺杆菌,但16S rDNA可以检测出该菌活菌的存在,故推测经发酵后阪崎克罗诺杆菌可能处于VBNC状态。结合PMA-qPCR法进一步证实了与保加利亚乳杆菌在牛奶中共培养后,阪崎克罗诺杆菌确实进入VBNC状态。本文结果还显示,阪崎克罗诺杆菌的存在会削弱保加利亚乳杆菌的产酸能力。酸奶是老少皆宜的乳制品,酸奶生产中使用的有益菌是致病菌的理想抑制剂,特别是乳酸菌对于致病菌的抑制效果已有很多研究报道,但在乳酸菌对致病菌达到良好抑制效果的同时,应始终考虑致病菌是否处于具有复苏能力的VBNC状态。所以,后续需要更详细的研究来阐明不同环境条件下致病菌与乳酸菌相互作用时的生长情况,VBNC状态的进入与复苏情况,VBNC状态下致病菌的潜在毒力以及食品加工过程中阪崎克罗诺杆菌VBNC状态细胞的防控措施。
