圆叶决明添加量对红壤可溶性氮及酶活性的影响
2022-03-28钟珍梅游小凤邢世和
钟珍梅, 杨 庆, 游小凤, 邢世和
(1.福建省农业科学院农业生态研究所, 福建 福州 350013;2.福建农林大学资源环境学院, 福建 福州 350002;3.河北省农林科学院粮油作物研究所, 河北 石家庄 050035; 4.福建省丘陵草业工程技术研究中心, 福建 福州 350013)
农业生产中,因豆科植物具有生物固氮作用,能通过根系共生的根瘤菌将空气中游离态氮转化为可被作物吸收利用的氮素形态,再通过植株翻压向土壤释放氮,提高土壤氮含量和供氮能力,同时增加土壤有机质含量[1-5],因此,豆科植物常被作为绿肥间套种于其它主栽植物周围。圆叶决明(Chamaecristarotundifolia)原产于北美洲、中美洲和南美洲北部,具有耐酸、耐贫瘠、抗性强、生长迅速等特性[6],20世纪80年代被引进中国后,在我国南方丘陵山地具有很强的适应性[7]。研究表明,圆叶决明常被间套种于山地果茶园,在提高土壤肥力、改善土壤理化性状、防治水土流失等方面具有显著的效果[8-9]。但关于圆叶决明翻压后对红壤的影响研究较少,这使得圆叶决明在应用和推广过程中依然存在管理粗放甚至不管理的现状,影响了绿肥效果的发挥。
酶是土壤中重要的组成部分,其活性不仅与土壤的理化性状、营养物质供给密切相关,还能反应土壤微生物的活性、化学过程的强度及方向[10]。水解酶是土壤酶中能将大分子有机物水解生成小分子有机物或无机盐的一类酶,其主导了土壤中有机碳(C)、氮(N)、磷(P)、硫(S)等营养物质的矿化过程,还和土壤微生物群落及营养库密切相关[11-12]。当绿肥施入土壤时,改变了土壤C,N营养物质的含量,导致土壤微生物种类和数量发生改变[13],同时改变了土壤酶活性[14-16],促进有机物料的分解,为微生物和植物的生长提供所需的营养物质,同时也促进腐殖化反应,提高土壤有机质含量[17]。土壤脲酶、蛋白酶和天冬酰胺酶等是土壤氮循环的重要水解酶,直接参与土壤中含氮有机物的分解和转化[11,18],在土壤氮循环中发挥着重要的作用。因此研究这3种土壤酶活性的变化及与土壤可溶性氮之间的关系,对评估土壤供氮能力具有重要的意义。本试验通过研究不同量的圆叶决明施入红壤后对可溶性氮及氮水解酶活性变化的影响,阐明不同量圆叶决明作用下土壤供氮能力的变化规律,旨在为圆叶决明绿肥推广应用提供科学依据。
1 材料与方法
1.1 供试材料
培养用土为福州市郊外的果园红壤。将取回的红壤去除砾石、草根等,捏碎后风干,待风干至土壤含水量约5%时过0.20 mm的筛,备用。土壤总氮(TN)1.10 g·kg-1、总磷(TP)1.62 g·kg-1、总钾(TK)23.36 g·kg-1,有机质2.13 g·kg-1,pH值5.23,速效氮7.00 mg·kg-1,有效磷<0.01%,速效钾32.10 mg·kg-1。
圆叶决明由福建省农科院农业生态研究所基地提供,为刚结荚的圆叶决明,全氮含量为23.49 g·kg-1,全碳含量为448.03 g·kg-1,粗纤维含量为306.25 g·kg-1,C/N为19.07。圆叶决明先用100℃杀青5 min,然后65℃烘干10~12 h,再用植物粉碎机粉碎成约0.2~0.5 cm的片段,备用。
1.2 试验设计
采用室内好气恒湿培养法培养。准备了108个容积200 mL的玻璃培养瓶,洗净烘干,称取100 g风干土放入玻璃培养瓶中,加入圆叶决明草粉,根据圆叶决明的亩产量估算草粉添加量。将单位面积土地上生长的圆叶决明翻压入土,其生物量与耕层土重量的比例约为1%,在此基础上设置草土比例分别为0.5%,1%和2%,设为T1,T2和T3,以未添加草粉为对照(CK),设为T0。调节培养土含水量至20%(相当于田间持水量的25%),用封口膜封口,放入25℃培养箱中培养,每处理3次重复,培养3个月。第一个月每隔7 d取一次样,第二个月每隔10 d取一次样,第三个月每隔15 d取一次样,共取样9次。取样时每处理从培养箱中取出3个培养瓶,将培养瓶中的土全部取出,根据指标的需求将取好的土样放入4℃冰箱保存或风干备用。
1.3 测定方法
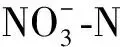
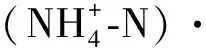
1.4 数据处理与分析
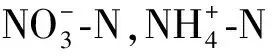
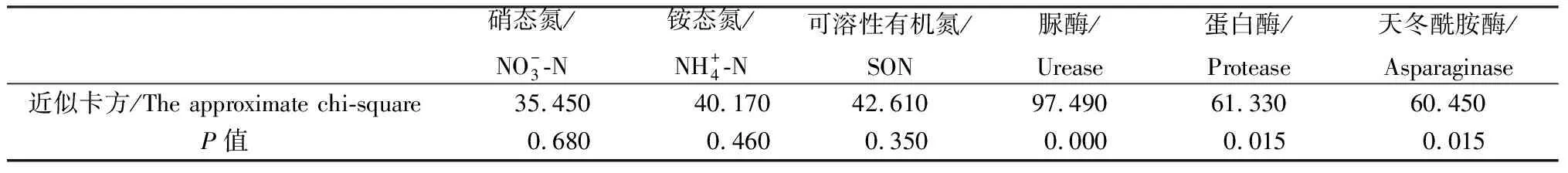
表1 Mauchly的球形度检验结果Table 1 The results of Mauchly’s test of sphericity
2 结果与分析
2.1 方差分析结果
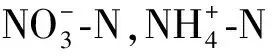
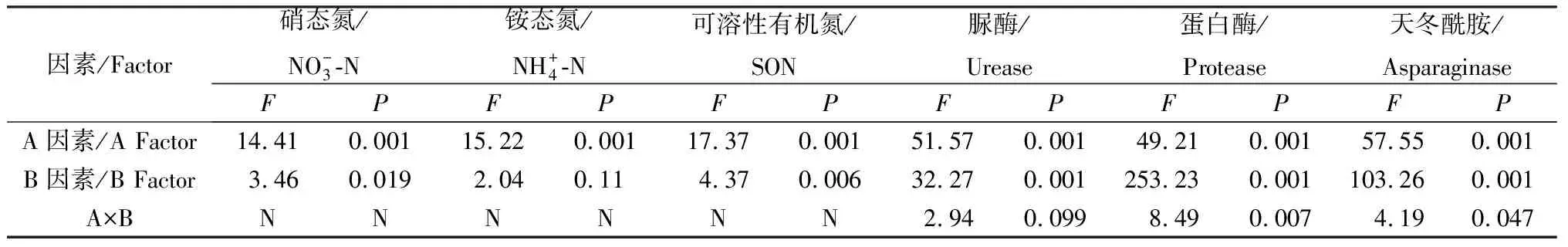
表2 可溶性氮和氮水解酶的方差分析结果Table 2 ANOVA results of soil soluble nitrogen and nitrogen hydrolase
2.2 圆叶决明添加量对红壤可溶性氮含量的影响及动态变化
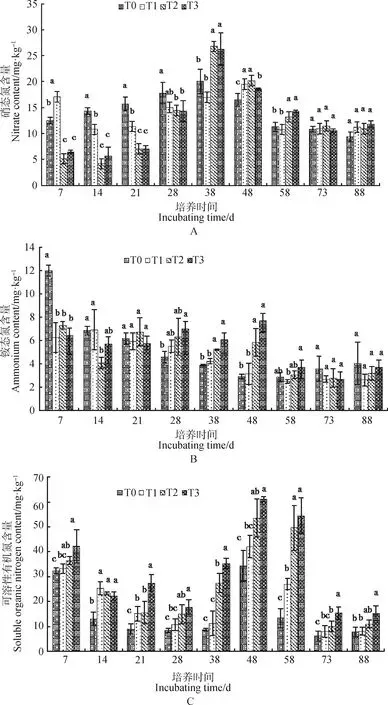
图1 圆叶决明添加后不同时期红壤可溶性氮含量的变化Fig.1 The changes of soil soluble nitrogen content in red soil at different stages after the addition of C. rotundifolia 注:图中数据均为“平均值±标准差”,同一组柱状图上的不同的字母表示不同处理差异显著,显著性水平P<0.05,下同Note:The data were all "mean±standard deviation". Different letters on the same group of bar charts indicated significant difference between different treatments,with significance level P < 0.05,the same as below
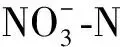

表3 不同处理红壤硝态氮、铵态氮和可溶性有机氮随时间变化的回归模型Table 3 Regression model of soil SON in red soil with incubating time under different treatments
2.3 圆叶决明添加量对红壤氮水解酶活性的影响及动态变化
圆叶决明不同添加量对红壤氮水解酶活性的影响如图2所示。培养7~88 d,T1,T2和T3处理脲酶活性均显著高于T0处理,且在培养7 d,14 d,48 d和73 d,T3处理红壤脲酶活性最高,显著高于T1和T2处理。培养7~73 d,T1,T2和T3处理蛋白酶活性均显著高于T0处理,且在培养28 d,38 d,48 d和88 d,T3处理红壤蛋白酶活性也显著高于T1和T2处理。除28 d,38 d,58 d外,培养7~73 d,T2和T3处理天冬酰胺酶活性均显著高于T0处理;培养7 d,21 d,48 d和73 d,T1处理红壤天冬酰胺酶活性也显著高于T0处理。T3处理在培养48 d,73 d和88 d,红壤天冬酰胺酶活性显著高于T1和T2处理。表明添加圆叶决明进果园红壤能显著提高脲酶、蛋白酶和天冬酰胺酶活性,且氮水解酶活性随着添加量增加而增加。
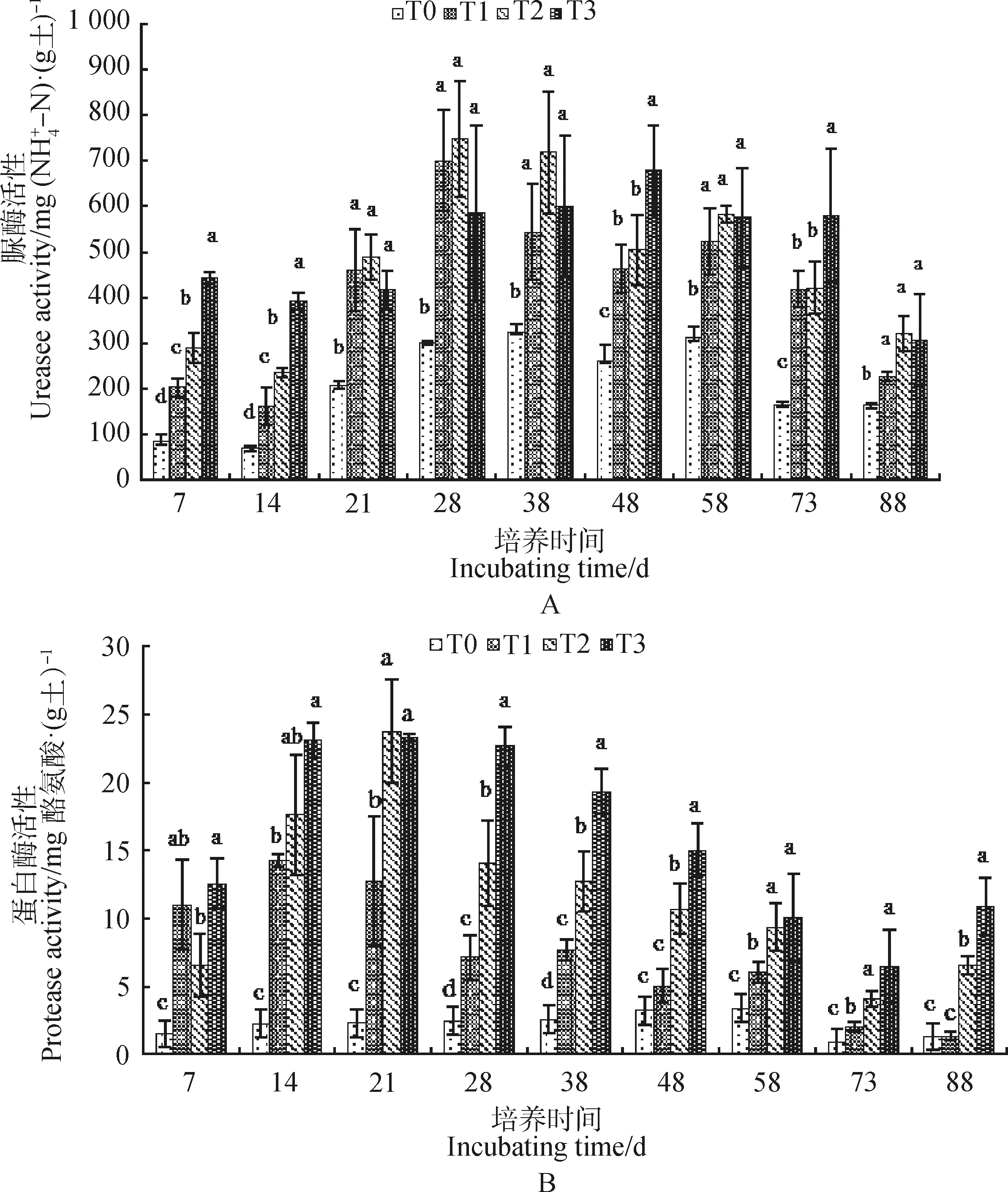
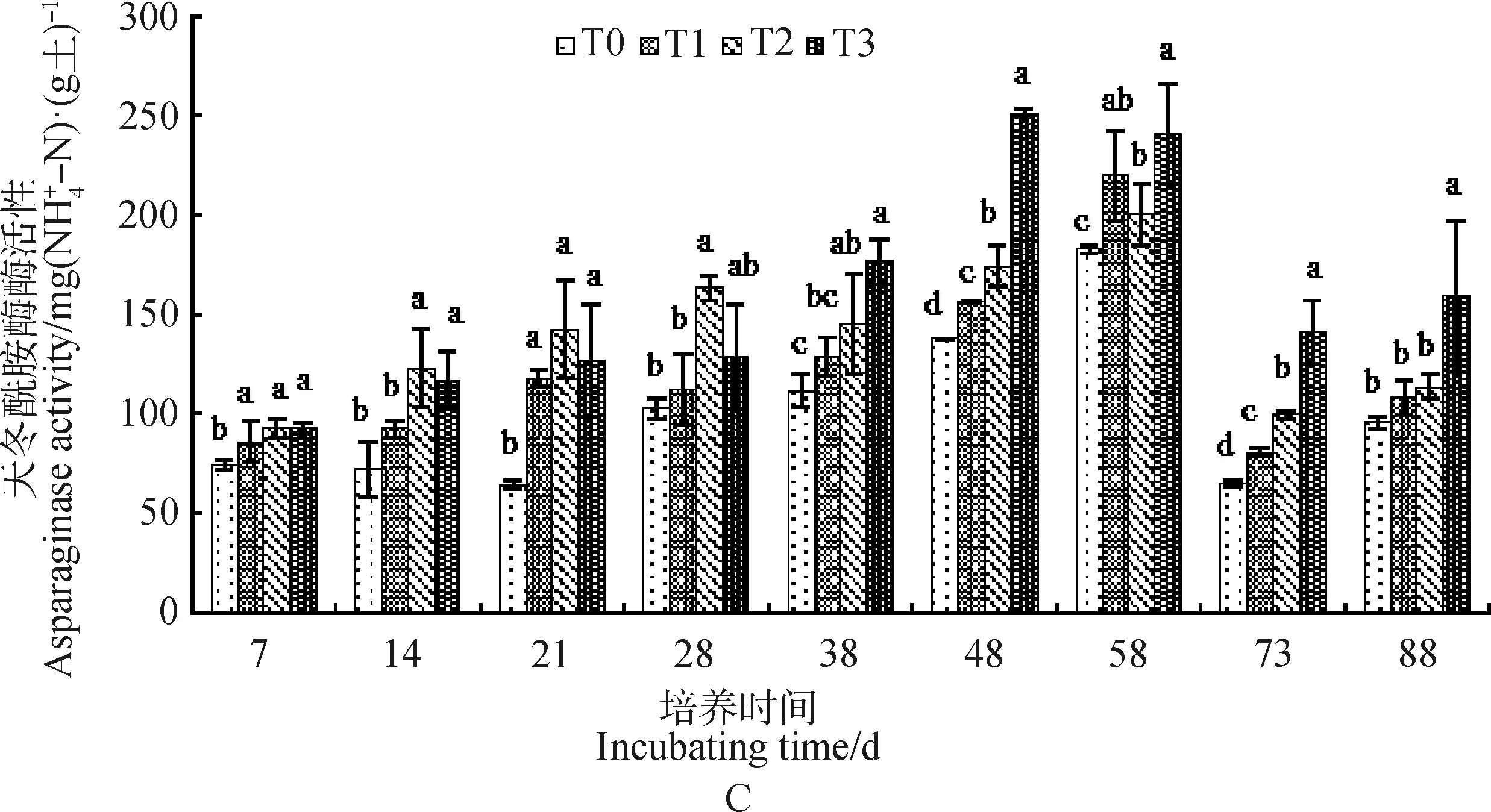
图2 圆叶决明添加后红壤氮水解酶活性的变化Fig.2 Changes of nitrogen hydrolase activity in red soil after addition of C. rotundifolia
果园红壤可溶性氮含量的动态变化如表4所示。随着培养时间延长,果园红壤脲酶、蛋白酶和天冬酰胺酶活性的变化可用2次和3次函数方程拟合,呈先增加后降低的变化趋势。所有拟合方程均有统计意义,即P<0.05。

表4 不同处理红壤脲酶、蛋白酶和天冬酰胺酶随时间变化的回归模型Table 4 Regression model urease,protease and asparaginase changes with incubating time in red soil under different treatments
2.4氮与氮水解酶的PCA分析

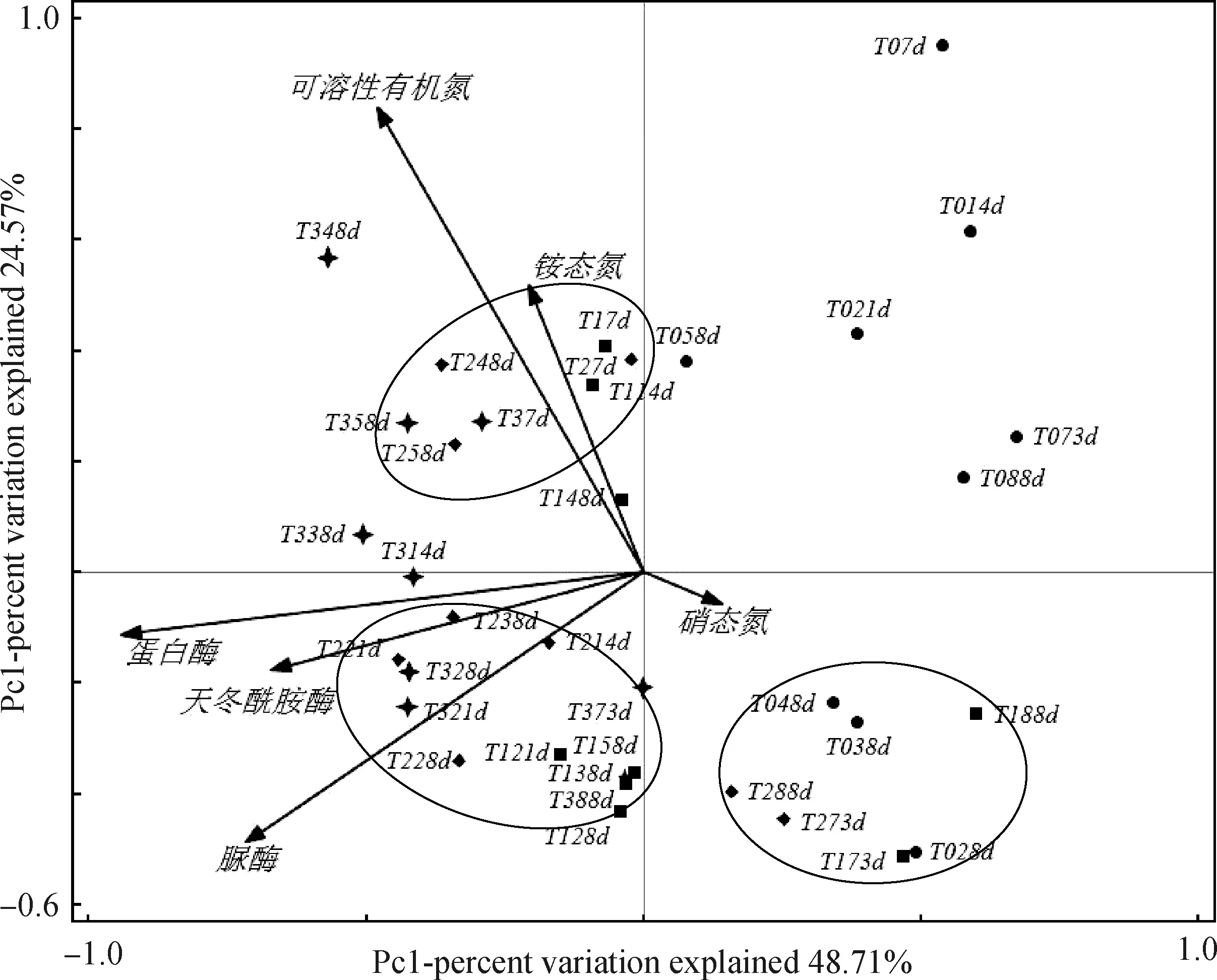
图3 各样品的主成分分析Fig.3 Principal Component Analysis (PCA) of different samplings注:样品的相关性越强,其距离越近,指标相关性越强,夹角越小。样本编号从左到右说明如下:“T+数字”表示处理,“数字+d”表示取样时间,例,T07 d表示T0处理第7天的样本,T388 d表示T3处理第88天的样本,其它类似Note:The stronger the correlation of samples,the closer the distance;and the stronger the index correlation,the smaller the included angles. Sample numbers from left to right were described as follows:“T + number” represents the treatment,“number + D” represents the sampling time. For example,T07 d showed the sample of T0 treatment collected at the 7th day. T388 d showed the sample of T3 treatment at the 88th day,and others were similar
3 讨论
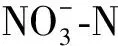
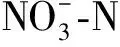
4 结论

