壳聚糖基抑菌凝胶剂的制备及其性能
2022-03-28王富平陈国宝吴基玉庞亚妮陈忠敏
张 涛, 王富平, 陈国宝, 吴基玉, 庞亚妮, 陈忠敏
(1. 重庆理工大学 药学与生物工程学院, 重庆 400054; 2. 重庆华伦医疗器械有限公司, 重庆 400039)
创伤是由多因素引起的真皮浅层及表皮层的损伤,创伤处常常会出现炎症反应及细菌感染,导致难以愈合[1-2]。抗生素是目前应用最广泛的抗菌药物,但其稳定性较差,加上不规范使用造成大量耐药菌出现[3]。无机抗菌剂如银、锌、铜、钛等金属氧化物及其离子具有广谱抑菌性,但其潜在的毒性及生物安全性还有待进一步研究[4]。凝胶剂具有润滑皮肤、保护创面的作用,且能够增加药物在皮肤局部累积作用达到持续释放,因此,从生物材料的角度制备一种在伤面处具有抑菌和促愈合的凝胶剂是非常有意义的。
凝胶剂一般要求常温时保持胶状,均匀细腻,凝胶基底与药物无理化作用,在伤面处可通过释放生物制剂促进上皮化[5]。针对皮肤表面的细菌感染和全层皮肤损伤修复,采用具有良好抑菌性能的天然聚合物制备凝胶剂是最优选择,因为天然聚合物比合成聚合物具有更好的生物相容性和更低的免疫原性。丝素蛋白(SF)和 丝胶蛋白(SS)是从家蚕蚕茧中提取的天然大分子蛋白。有研究表明,SF具有良好的生物相容性,有抑菌和促愈合作用[6];SS同样具有诸多优异的生物活性,如抑菌、抗凝血以及促进细胞黏附和增殖等作用[7]。SS、SF都具有良好的抑菌性、促创口愈合性能、可降解性和低免疫原性,适于作为伤口敷料的原料。壳聚糖(CS)是一种天然多糖,具有良好的生物相容性和抑菌性,能够生物降解且产物无毒害,可以促进伤口修复和组织再生,是良好的生物医用材料[8]。甘油磷酸钠(GP)为弱碱性化合物(pH值为6.34),无细胞毒性。壳聚糖-甘油磷酸钠体系由于高含水量、温敏特性和良好的生物相容性,已被广泛应用到组织工程领域[9],但该凝胶体系是通过物理交联形成的,存在力学性能低、黏度小和抑菌效果较差等问题。
基于以上对壳聚糖-甘油磷酸钠体系、SS和SF在医用材料方面的研究,本文以壳聚糖为基底,通过添加羧甲基纤维素钠(CMC-Na)改性制备得到黏度适中便于涂抹的凝胶剂基质,再分别加入SF、SS以提高凝胶剂基质的抑菌性能,筛选出一种具有良好生物相容性、抑菌性的复合凝胶剂。
1 实验部分
1.1 实验材料与仪器
材料:中等级蚕茧,重庆纤维检验所;透析袋(长为0.4 m,宽为44 mm,截留分子质量为8~12 ku),北京索莱宝生物技术有限公司;中性蛋白酶(活力为20万U/g),美国Sigma公司;壳聚糖(CS,脱乙酰度≥95%)、Triton X-100,生工生物股份有限公司;甘油磷酸钠(GP)、羧甲基纤维素钠(CMC-Na),成都科龙化工试剂厂;牛肉膏、蛋白胨,北京奥博星生物科技有限公司;金黄色葡萄球菌、大肠杆菌,由重庆理工大学微生物实验室提供;胰蛋白酶,美国Gibco公司;DMEM HIGH培养基、胎牛血清(FBS),美国HyClone公司;氨苄青霉素(Ampicillin)、硫酸链霉素(Streptomycin sulfate)、磷酸盐缓冲液(PBS)、二甲基亚砜(PMSO),北京Solarbio 生物科技有限公司;3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、碘化丙啶(PI),上海翔圣生物科技有限公司;实验大鼠(SD品系),重庆莱彼特生物科技有限公司;浓盐酸、碳酸钠、碳酸氢钠、异丙醚等均为分析纯,市售。
仪器:SW-CC-3F超净工作台(苏州安泰空气技术有限公司);FD-1-50真空冷冻干燥机(上海比郎仪器有限公司);Varian 640型傅里叶红外光谱仪(美国Varian公司);SHA-C水浴恒温振荡器(江苏金坛中大仪器厂);Heraeus CO2培养箱(赛默飞世尔科技有限公司);PHS-3C型pH计(上海虹益仪器有限公司);DDS-3C型台式电导率仪(上海雷磁仪器有限公司);HH-8型数显式恒温水浴锅(江苏省金坛市荣华仪器制造有限公司);Multiskan GO酶标仪(美国 Thermo公司)。
1.2 试样的制备
1.2.1 SS和SF的制备
将茧壳用异丙醚浸泡2 d除蜡后,用无水乙醇浸泡2 d除去杂质,然后放入去离子水中沸煮约6 h脱胶,去除丝素蛋白(SF)纤维余下淡黄色液体,将淡黄色液体经过超滤膜过滤后,经冷冻干燥得到SS粉末[10]。
按照文献[11]方法将蚕茧用异丙醚浸泡2 d除蜡后,用无水乙醇浸泡2 d除杂。将处理好的蚕茧放入去离子水中煮沸脱胶得到纤维状丝素(SF),将丝素纤维溶解在CaCl2/C2H5OH/H2O中,再装入透析袋在蒸馏水中透析3 d取出,用中性蛋白酶酶解,然后用超滤膜过滤,真空冷冻干燥得到SF粉末。
1.2.2 复合凝胶剂的制备
将CS溶解在0.1 mol/L的HCl中,配成质量分数为3%的CS溶液;将GP溶解在0.1 mol/L的NaHCO3溶液中,配成质量分数为50%的GP溶液。在冰浴条件下,将4.5 mL的GP溶液缓慢加入至10 mL的CS溶液中并不断搅拌,得到CS/GP体系。再向CS/GP体系中加入质量分数为1.5%的CMC-Na粉末,于37 ℃水浴锅中水浴加热3~4 min,制得外观良好,均匀无颗粒感的凝胶剂基质。向凝胶剂基质中加入不同质量分数(5%、10%、15%)的SS或SF,搅拌均匀后即可得到复合凝胶剂。
1.3 测试与表征
1.3.1 抑菌性测试
参照文献[12]方法采用浸提液法对复合凝胶剂进行抑菌性测试。将凝胶剂样品用紫外光照射30 min后,取约1 mL凝胶剂加入9 mL无菌水,封存在15 mL的离心管中。离心管置于恒温振荡器(37 ℃、100 r/min)放置3 d,随后将离心管转移至超净工作台,用针式滤膜过滤除杂、除菌,即可得到浸提液。用牛肉膏、蛋白胨、琼脂粉、NaCl、去离子水配制普通溶菌肉汤培养基(LB培养基)。先将100 μL浸提液均匀涂布在平板上,待完全吸收后,再均匀涂布100 μL细菌悬液(浓度为1×109CFU/mL)。培养基倒置培养12 h。由对照组和实验组的菌落数来确定复合凝胶剂的抑菌率,计算公式[13]为
式中:a0为涂抹含有丝素蛋白或丝胶蛋白的复合凝胶剂浸提液后平板的菌落数;a为涂抹凝胶剂基质浸提液后平板的菌落数。
1.3.2 化学结构表征
采用傅里叶变换红外光谱仪(FI-IR)测试试样的红外光谱,测试范围为4 500~400 cm-1,分辨率为4 cm-1。
1.3.3 抑菌机制分析
1.3.3.1细菌悬液吸光度(OD)测定 首先将大肠杆菌悬液(1×107CFU/mL)按每孔100 μL接种于96孔板上,分别加入不同质量分数(0%、25%、50%、75%、100%)的复合凝胶剂浸提液、阳性对照组(含0.1% Triton X-100、50 μg/mL的氨苄青霉素)各100 μL,质量分数为100%的凝胶剂浸提液加入到100 μL的无菌水中作为空白对照。再将96孔板放在生化培养箱中于37 ℃培养12 h,然后取出加入碘化丙啶(PI)使其终质量浓度为50 μg/mL。于37 ℃孵育30 min后在酶标仪上测定OD值,激发光波长为488 nm,每组测定6个平行样品,取平均值,以加入Triton X-100组测得的OD值认定透过率为100%,计算其他组中的相对透过率。其计算公式为
式中:X为细胞膜相对透过率,%;OD1和OD2分别为其他各组和Triton X-100组的吸光度平均值。
1.3.3.2细菌电导率测试 用接种环取下具有代表性的菌落,置于适量的液体培养基中,在温度为37 ℃,转速为150 r/min条件下振荡摇晃液体培养基至细菌浓度达1×107CFU/mL,分别向细菌悬液中加入10 mL含不同质量分数(5%、10%、15%)SS的凝胶剂浸提液作为材料实验组。采用台式电导率仪每隔2 h测量混匀后溶液的电导率,以菌液中加入不含SS的凝胶剂基质浸提液作为对照组,每组实验重复3次,取平均值。
1.3.4 生物安全性测试
1.3.4.1复合凝胶剂的细胞毒性检测 用MTT法检测凝胶浸提液对L929细胞增殖活性的影响。将细胞在DMEM完全培养基(DMEMHIGH培养基、胎牛血清、双抗体积比为9∶1∶0.2)中培养,当90%细胞贴壁后用胰蛋白酶(0.05%)去除贴壁,将处于对数增长期的细胞悬液(5×104个/mL)按每孔200 μL接种于96孔板,置于CO2培养箱中。待细胞完全贴壁后弃去原培养基,分别加入材料实验组(含不同质量分数(0%、25%、50%、75%、100%)浸提液的DMEM完全培养基)、空白对照组(DMEM完全培养基)各200 μL继续在相同条件培养,4 h后用移液枪移除96孔板内液体,加入150 μL的DMSO放入酶标仪中振荡10 min,检测在波长为490 nm处的OD值,每组平行测定6个样品,取平均值。以细胞相对增长率(Gr)来评定复合凝胶剂的细胞毒性,其计算公式为
式中,OD和OD0分别为材料实验组和空白对照组的吸光度平均值。参考文献[14]以空白对照组细胞相对增长率Gr为标准对复合凝胶剂划分安全等级。
1.3.4.2复合凝胶剂的皮肤刺激性测试 选取成年健康雌性SD大鼠9只(体重为220 g,饲养温度为(23±3) ℃,每日光照12 h,自由饮食),3只1组随机分为3组,实验前以大鼠脊柱为中线,剪去背部毛发制作一个1.5 cm×1.5 cm的皮肤暴露面,作为实验和观察部位。用吸收2 mL甲醛溶液(质量分数为10%)的医用纱布作为阳性对照,均匀涂抹2 cm3复合凝胶剂的医用纱布作为实验组,将纱布包裹在大鼠的实验部位,在接触0、(8±0.5)、(24±2)、(48±2) h后,取下纱布作观察记录。
2 结果与讨论
2.1 凝胶剂的抑菌性能分析
图1示出加入含SS或SF的复合凝胶剂浸提液涂布平板后形成的菌落分布。可以看出,随着SS或SF在凝胶剂中质量分数的增加,平板上菌落数越少。但是实验过程中发现,随着SS或SF质量分数的增加,复合凝胶剂的黏度降低甚至无法交联,这可能是因为SS和SF表面存在的许多可以交联和修饰的活性基团,在温度为37 ℃ 时与CS部分基团相结合,影响到CS链间片段的物理结合,导致凝胶剂黏度下降[15-17],因此,本文实验没有进一步在凝胶剂基底中添加更高质量分数的SS或SF。
与未添加SS和SF的凝胶剂基质浸提液相比,加入SS、SF后凝胶剂的浸提液都表现出了更好的抑菌效果,抑菌统计结果如图2所示。通过计算平板上的菌落数来评估凝胶剂的抑菌性能发现,随着SS和SF质量分数的增加,复合凝胶剂的抑菌性能提高。但相比之下,加入SS复合凝胶剂的抑菌效果更加优异,当SS质量分数为15%时对金黄色葡萄球菌(革兰氏阳性菌)的抑菌率达到(86.30±2.51)%,对大肠杆菌(革兰氏阴性菌)的抑菌率为(96.20±3.40)%。
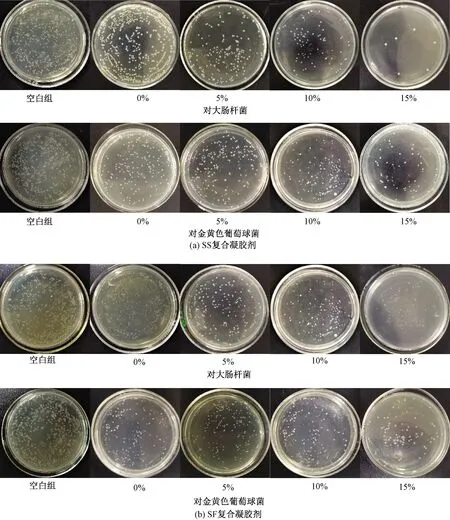
图1 不同质量分数的SS和SF复合凝胶剂浸提液抑菌效果Fig.1 Antibacterial effects of different mass fractions of SS (a) and SF (b) composite gel extracts
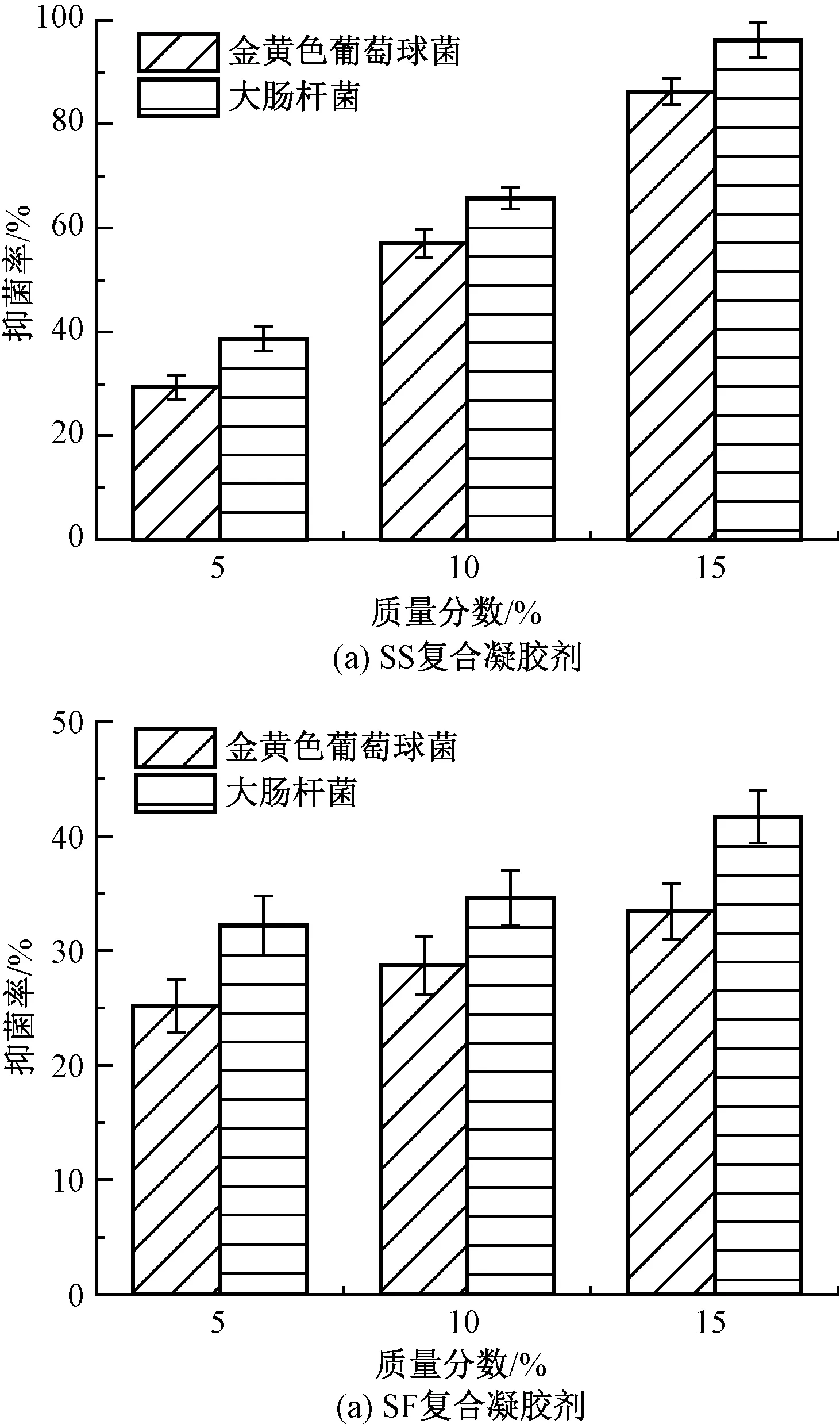
图2 不同质量分数的SS和SF 复合凝胶剂浸提液抑菌性Fig.2 Antibacterial properties of different mass fractions of SS (a) and SF (b) composite gel extracts
2.2 凝胶剂的二级结构分析
本文采用红外光谱法来分析凝胶剂中各单一组分与SS复合凝胶剂(SS质量分数为15%)在二级构象上的差异性。图3示出本文实验所用的原材料及复合凝胶剂的红外光谱。可以看出,CS在1 667 cm-1处的特征峰归属于酰胺Ⅰ,而在1 056和985 cm-1处的特征峰归因于C—O拉伸的骨骼振动。SS具有的β-折叠结构对应于1 653 cm-1(酰胺Ⅰ)、1 542 cm-1(酰胺Ⅱ)和1 230 cm-1(酰胺Ⅲ)处的特征峰。复合凝胶剂红外光谱中酰胺Ⅰ的特征峰偏移至1 624 cm-1处且强度降低,表明有大量强氢键形成。此外,CS(3 345 cm-1)、SS(3 304 cm-1)、GP(3 218 cm-1)、CMC-Na(3 302 cm-1)中均出现—OH的伸缩振动特征峰,而在复合凝胶剂中未出现新峰,但该特征峰向左偏移至3 355 cm-1处。
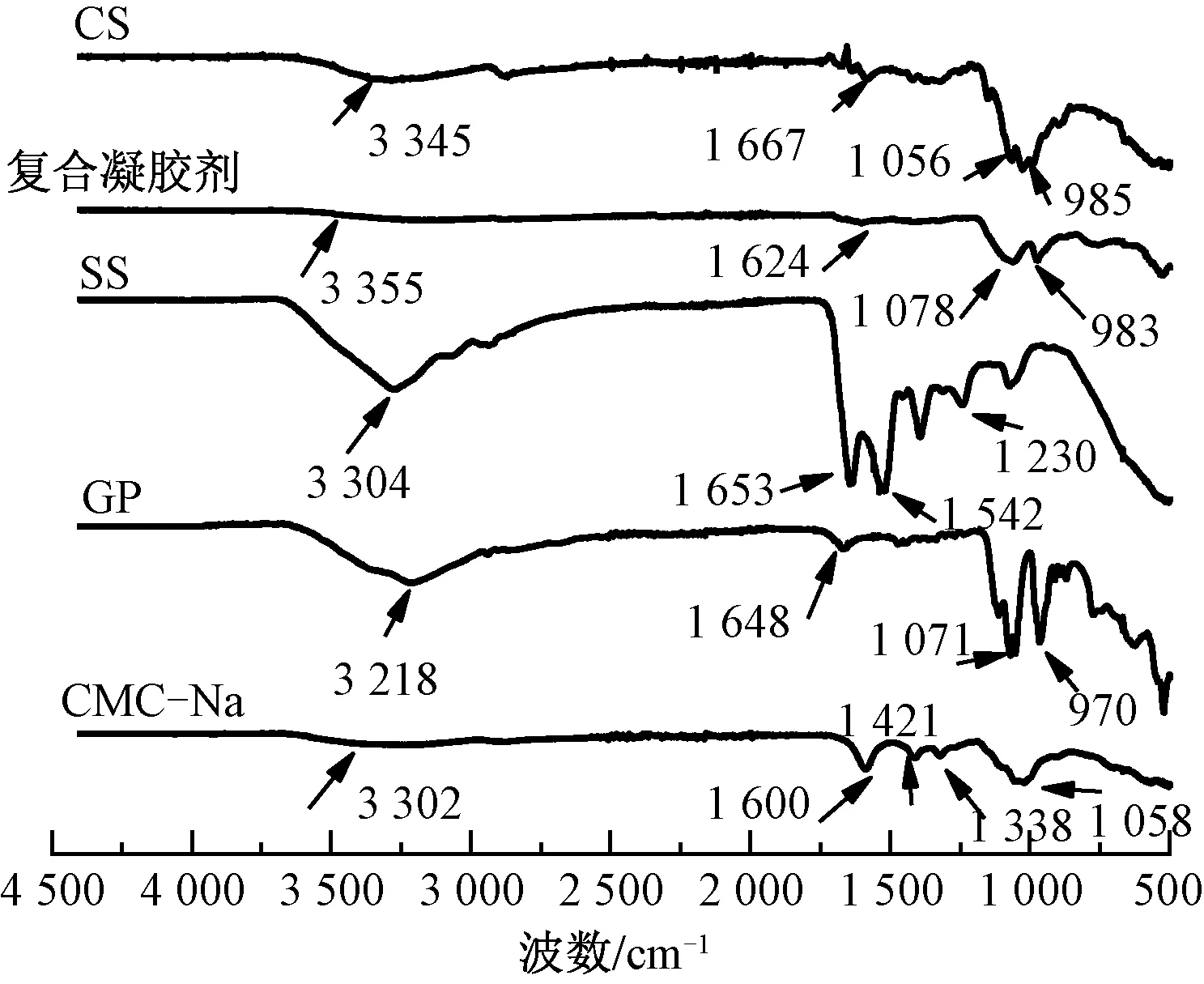
图3 复合凝胶剂及其各组分的红外光谱Fig.3 Infrared spectra of composite gel and its component
2.3 凝胶剂的抑菌机制分析
CS和SS的抑菌机制都是改变了细菌外膜的通透性,导致细菌外膜的电导率和完整性改变[18]。为研究复合凝胶剂的抑菌机制特别是对细菌细胞结构的影响,选取革兰氏阴性菌大肠杆菌,测定加入不同质量分数的复合凝胶剂浸提液后细菌悬液的OD值,结果如表1所示。对多组数据间比较采用单因素方差分析(P<0.05认为差异具有统计学意义)发现经浸提液处理后的大肠杆菌悬液OD值明显升高,且随着浸提液质量分数的升高,OD值呈梯度上升(以Triton X-100为阳性组作为参考),OD值的上升显示了大肠杆菌胞内成分的大量释放,说明细菌细胞膜的通透性增加,复合凝胶剂破坏了细菌细胞膜的完整性,从而发挥抑菌效果。

表1 不同质量分数浸提液对细菌细胞膜完整性的影响Tab.1 Effect of different mass fraction extracts on integrity of bacterial cell membrane
为进一步验证复合凝胶剂的抑菌机制是其破坏了细菌细胞膜的完整性,测定了复合凝胶剂浸提液处理大肠杆菌8 h内电导率的变化,结果如图4所示。
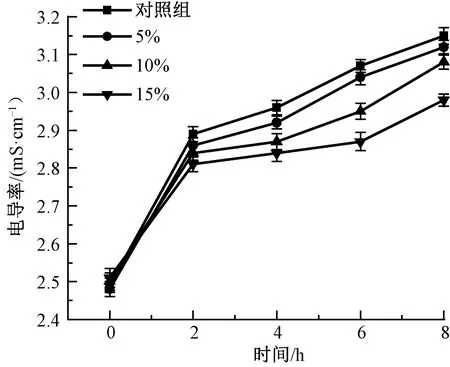
图4 凝胶剂浸提液处理大肠杆菌8 h内电导率的变化Fig.4 Change of electrical conductivity of gel in 8 h after treatment of Escherichia coli
从图4可以看出,在0~8 h内,实验组和对照组的细菌悬液电导率都增加,这是由于细菌在生长过程中通过代谢作用将不带电或带弱电物质(碳水化合物、蛋白质等)转化为电活性物质,因此,随着细菌的生长,培养液的电导率上升。在实验最初的2 h内含不同质量分数SS的复合凝胶剂浸提液处理后的菌液电导率增加最为显著,而后增速减慢。由此可见,凝胶剂的抑菌作用主要发生在最初的2 h内。随着SS质量分数的提高,对应时间内电导率降低,表明SS能够阻碍细菌代谢过程中的离子交换,细菌悬液电导率的降低可能是由于含有丝氨酸、天冬氨酸、甘氨酸的SS通过静电相互作用与大肠杆菌细胞膜发生诱导效应。SS的加入使带电离子减少,细菌膜的渗透性下降,细菌细胞膜的完整性被破坏[19],由此确认了复合凝胶剂破坏细菌细胞膜完整性的抑菌作用机制。
2.4 凝胶剂的生物安全性分析
2.4.1 凝胶剂的细胞毒性
作为潜在的外用创伤凝胶剂,应具有促进细胞增殖和细胞分化的作用。图5示出采用MTT法检测不同质量分数的复合凝胶剂浸提液对L929细胞增殖的影响结果。可以看出,细胞在含有不同质量分数SS复合凝胶剂浸提液的培养基中相对增长率均大于100%。根据GB/T 16886.5—2017《医疗器械生物学评价 第5部分:体外细胞毒性试验》,经实验材料处理后,细胞的相对增长率大于75%即可被认为无细胞毒性[20],因此,本文制备的凝胶剂无细胞毒性。在加入浸提液24 h后各实验组细胞生长情况均比空白组要好,且随着浸提液中SS质量分数的增加,OD值也在相应增大。说明该凝胶剂具有良好的生物相容性并且能够促进细胞增殖,满足外用创伤的基本要求,可作进一步的应用研究。

图5 L929细胞在含不同质量分数的 浸提液培养基中的生长情况Fig.5 Growth of L929 cells in extract medium containing different mass concentration
2.4.2 凝胶剂的皮肤刺激性
图6示出复合凝胶剂对大鼠皮肤刺激性结果。可以看出:涂抹甲醛部位皮肤在8 h时出现红肿,随着时间延长皮肤肿块增大,24 h时皮肤出现红斑且随时间增加红斑越明显;而涂抹凝胶剂部位皮肤一直未出现红肿和红斑,并且随着时间延长,涂抹处皮肤更加红润光滑。这可能是因为SS降解为各种氨基酸被机体吸收,为表皮细胞提供营养物质而促进表皮修复[21]。
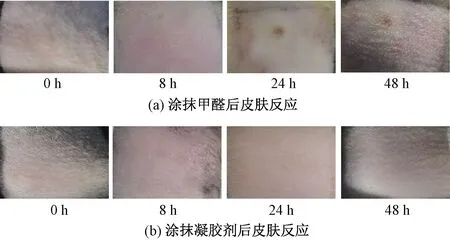
图6 大鼠皮肤刺激反应图Fig.6 Rat skin irritation response chart.(a) Skin reaction after applying formaldehyde; (b) Skin reaction after applying gel
3 结 论
本文以壳聚糖(CS)为基材通过改性制备了壳聚糖基抑菌凝胶剂,并探讨了凝胶剂的抑菌性、二级构象、抑菌机制及生物相容性。研究结果表明:在以CS为凝胶剂基质中加入丝胶蛋白(SS)比加入丝素蛋白(SF)表现出更加优异的抑菌性,当丝胶蛋白质量分数为15%时对金黄色葡萄球菌的抑菌率为(86.30±2.51)%,对大肠杆菌的抑菌率为(96.20±3.40)%;所制备的复合凝胶剂的二级构象中有大量强氢键形成,表明其黏度和稳定性增强;复合凝胶剂通过改变细菌细胞膜的完整性从而发挥抑菌作用;复合凝胶剂无细胞毒性,无皮肤刺激性。本文实验制备的复合凝胶剂性能较优,在生物材料领域具有潜在的应用价值。
