炭载水铁矿吸附剂高效除砷性能及机理研究
2022-03-27白中强范晓亮孟凡跃
白中强,范晓亮,孟凡跃,赵 炎,宋 兵,宋 敏
(东南大学能源与环境学院能源热转换及其过程测控教育部重点实验室,江苏 南京 210096)
长期以来,火山喷发、矿物冶炼及农药的使用等使得环境中的砷日益增加,已成为土壤和水环境中的一种突出污染物。砷具有极高的毒性和致癌性,不同剂量的砷均会导致人体健康受到危害。世界卫生组织明确规定,居民用水ρ(砷)应低于10 μg·L-1[1]。据报道,冶金废水中ρ(砷酸盐)可高达17.56 mg·L-1[2],远高于我国废水允许排放的0.5 mg·L-1,严重威胁着人类健康。因此,迫切需要找到一种有效的方法对砷污染环境进行治理。常用除砷措施有化学沉淀、氧化-凝聚、离子交换和吸附等,其中,吸附法因具有经济效益高、操作简单、可重复使用等特点而被广泛用于砷污染水体的修复[3]。
目前,已开发出多种吸附剂用于修复砷污染水体,如YAMANI等[4]利用混合金属氧化物改性的壳聚糖吸附砷酸盐、BEESLEY等[5]利用生物炭吸附溶液中的砷等。然而,由于所报道的吸附剂具有相对低的吸附能力或较高成本,因此,需努力开发更有效的吸附剂进行实际应用。
铁(氢)氧化物是常用的除砷材料之一,众多铁(氢)氧化物中,水铁矿具有表面活性较高、吸附能力强,对砷表现出强的吸附和络合作用等特点[6]。然而,由于水铁矿颗粒在环境中易团聚,影响其对砷的吸附效果,且使用单一水铁矿作为吸附剂,成本较高。因此,需将水铁矿负载在载体上,如活性炭[7]等,以克服材料本身易团聚的缺陷,提高材料性能并降低总体成本。
生物炭因具有成本低、比表面积大、表面带负电荷等特点,被广泛用于吸附水体中的重金属阳离子[8]。然而,因大多数生物炭表面带负电荷而对砷阴离子的吸附效果有限[9]。因此,需对生物炭进行改性以提高其对砷的吸附性能,如WANG等[10]利用生物炭负载赤铁矿用于砷的吸附等。
目前,将水铁矿与生物炭进行复合以提高其对砷吸附性能的研究较少,因此,该文以砷为目标污染物,以人工制备的水铁矿(Fh)和花生壳生物炭(BC)为原料,合成了水铁矿@生物炭(Fh@BC)。水铁矿与生物炭的复合克服了纯水铁矿易团聚的缺陷,也降低了整体成本。考察Fh@BC的除砷性能并揭示相关机制,以期为砷吸附材料的制备及砷污染环境的修复提供参考。
1 材料与方法
1.1 材料
供试花生壳购自河南郑州,经去离子水清洗后干燥备用。供试九水合硝酸铁[Fe(NO3)3·9H2O]、氢氧化钾(KOH)、氢氧化钠(NaOH)、盐酸(HCl)、碳酸氢钠(NaHCO3)和亚砷酸钠(NaAsO2)均为分析纯,试验用水为去离子水。
1.2 材料的制备
生物炭[11](BC):将清洗后的花生壳进行洗涤、粉碎、过筛(孔径为0.42 mm),然后使用管式炉于800 ℃ N2气氛下进行热解,期间需要保持N2氛围。研磨后存储备用。
水铁矿[12](Fh):将40 g Fe(NO3)3·9 H2O溶解于500 mL去离子水中;然后添加330 mL 1 mol·L-1KOH以使pH值达到7~8。其中,最后20 mL KOH以滴加方式添加,期间剧烈搅拌,同时不断检测pH值。将上述体系稳定2 h后,离心、过滤、洗涤、干燥后保存。
水铁矿@生物炭(Fh@BC):首先将BC均匀分散在KOH溶液中进行活化,然后将Fe(NO3)3·9 H2O溶解在溶液中(调节铁炭质量比为0.5、1、2、3),混匀,最后添加1 mol·L-1KOH使pH维持在7~8。其余步骤同Fh的制备。材料分别记为Fh@BC0.5、Fh@BC1、Fh@BC2和Fh@BC3。
1.3 测试与表征
采用电感耦合等离子体发射光谱仪(ICP-OES,8000 dv,PerKin Elmer,USA)对溶液中砷浓度进行检测。
采用扫描电子显微镜(SEM,Inspect F50,FEI,USA)观察材料形貌特征;采用全自动比表面积与孔隙度分析仪(BET,ASAP 2020M,Micromeritics,USA)分析吸附材料的比表面积与孔径;分别采用傅里叶变换红外光谱仪(FTIR,Fisher Scientific Nicolet IS10,Thermo,USA)、X射线光电子能谱仪(XPS,Scientific K-Alpha,Thermo,USA)和X射线衍射仪〔XRD,Smart lab(3),Rigaku,Japan〕对吸附材料官能团、元素的化学状态及晶体结构进行分析。
1.4 吸附试验
首先,在每个离心管各自分装好20 mL As3+储备溶液,质量浓度均为100 mg·L-1。然后,在各个离心管中添加0.02 g吸附材料,最后将容器置于设定条件为125 r·min-1振荡速度和25 ℃恒定温度的摇床中,持续进行24 h。在筛选试验中,通过比较各材料饱和吸附量,优选出效果最好的材料。之后考察优选材料在各因素下对砷的吸附性能:通过调节优选材料的剂量(0.01~0.10 g)、溶液pH(借助于1 mol·L-1NaOH和HCl溶液控制溶液pH为3~11)、砷质量浓度(5、10、20、40、60、80、100、140和200 mg·L-1)、反应时间(5、10、20、30 min,1、2、3、6、12和24 h)来考察其对吸附性能的影响。上述样品经离心、过滤(0.22 μm水系滤头)后使用ICP-OES检测As3+浓度,所有试验重复3次。
采用Langmuir和Freundlich等温模型对试验数据进行拟合分析。
(1)
qe=kFcen。
(2)
式(1)~(2)中,qe为吸附达到平衡时的吸附量,mg·g-1;Qm为吸附材料对As3+的最大吸附量,mg·g-1;ce为平衡时溶液中As3+浓度,mg·L-1;kL为Langmuir 吸附平衡常数,mg·g-1;kF为Freundlich 吸附平衡常数,L·mg-1;n为表征吸附强度的等温线指数。
采用伪一级动力学、伪二级动力学模型对试验数据进行拟合。
qt=qe(1-e-k1t),
(3)
(4)
式(3)~(4)中,qe为平衡吸附量,mg·g-1;qt为时间t时吸附量,mg·g-1;t为反应时间,h;k1为拟一级动力学速率常数,h-1;k2为拟二级动力学速率常数,g·mg-1·h-1。
1.5 吸附稳定性试验
砷饱和Fh@BC2的制备:在100 mg·L-1As3+溶液中,加入1 g·L-1Fh@BC2,常温下于摇床中反应24 h后,离心、过滤、干燥。
采用Shiowatana法分析被吸附As的稳定性,WAN等[13]认为吸附到吸附剂上的砷大致分为水溶态砷(高风险)、表层吸附态砷(潜在风险)和稳定态砷(风险极低)3种形态。为考察Fh@BC2上所吸附砷的稳定性能,对吸附饱和的Fh@BC2进行简化萃取试验。
(1)用30 mL去离子水(pH =6)萃取1 g砷饱和Fh@BC2,室温振荡16 h后,将溶液离心、过滤,检测As浓度,即为水溶态砷。
(2)将步骤(1)中材料烘干后,添加30 mL NaHCO3溶液(0.5 mol·L-1,pH=9)萃取,室温下振荡16 h后,将溶液进行离心、过滤,检测As浓度,即为表层吸附态砷。
通过从总吸附量(等温线结果中获得)中减去水溶态砷和表层吸附态砷,计算Fh@BC2上吸附的稳定态砷的量。
1.6 数据处理
试验所得数据采用Excel 2016 和 Origin 2018 进行处理。砷的吸附量计算公式为
(5)
式(5)中,qe为生物炭对砷的吸附量,mg·g-1;ρ0和ρe分别为砷的初始和平衡质量浓度,mg·L-1;V为溶液体积,L;m为生物炭质量,g。
2 结果与讨论
2.1 吸附性能评价
如图1所示,BC、Fh和Fh@BC2对砷的吸附能力由大到小依次为Fh@BC2、Fh和BC,生物炭最低,仅为1.080 mg·g-1;与水铁矿相比,各复合材料饱和吸附量均增加,这主要是因为生物炭的引入,克服了纯水铁矿存在的团聚缺陷。随着Fh@BC2中铁含量占比的逐渐增大,其对砷的吸附容量亦增加,且当铁炭比值为2时,Fh@BC2对砷的吸附量最大,为68.67 mg·g-1,因此,选择Fh@BC2复合材料用于后续研究。
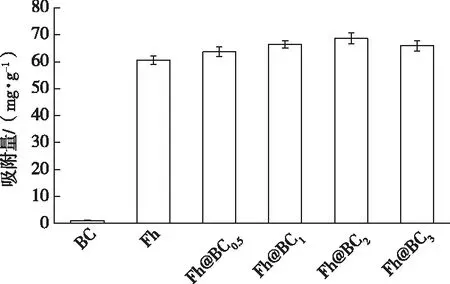
BC为生物炭,Fh为水铁矿,Fh@BC0.5、Fh@BC1、Fh@BC2和Fh@BC3指炭载水铁矿的铁炭质量比分别为0.5、1、2和3。
2.2 吸附材料表征
图2为各材料形貌特征及Fh@BC2反应前后的SEM及X光微区分析(EDS)谱图。由图2(a)、(b)和(c)可以明显观察到BC呈蜂窝状,具有微米级多孔结构并且大小及形状各异;Fh表面粗糙呈块状;Fh@BC2表面出现BC独特蜂窝结构,作为负载Fh的骨架。EDS分析表明,Fh@BC2表面存在Fe、C、O、K等元素〔图2(d)〕;吸附As3+后,在Fh@BC2表面发现As元素〔图2(f)〕,说明As被吸附在Fh@BC2表面。

BC为生物炭,Fh为水铁矿, Fh@BC2指炭载水铁矿的铁炭质量比为2。
BC、Fh和Fh@BC2的比表面积和孔径分布见表1。由表1可知,Fh@BC2比表面积最大,为301.78 m2·g-1,微孔体积为0.031 cm3·g-1,平均孔径为2.19 nm。与BC和Fh相比,Fh@BC2比表面积和微孔体积均增大,而平均孔径减小。因为BC经强碱活化后,更利于增大材料的比表面积和微孔体积,但微孔、大孔的组合会导致平均孔径的降低[14]。研究发现,经过KOH活化的BC,比表面积和微孔体积均有明显增加,这种改性不仅增加了BC表面吸附位点和与污染物接触能力,还有利于新官能团的引入[15]。另外,水铁矿易于团聚[16],BC作为负载水铁矿的骨架,为水铁矿的负载提供了附着位点,提高了Fh的分散性。

表1 BC、Fh、Fh@BC2比表面积和孔径分布
2.3 Fh@BC2投加量的影响
复合材料的添加量能够改变有效点位数量,使其对污染物的吸附产生差异[17]。由图3可知,当反应体系砷浓度一定时,Fh@BC2的砷吸附容量随添加量的增加先增大;当投加量为0.02 g(即固液比为1 g·L-1)时,材料吸附量达到最大(68.67 mg·g-1),而后逐渐降低。因为当Fh@BC2添加量处于一个较低水平时,其吸附位点不满足吸附所需,大量砷竞争吸附位点,随着Fh@BC2的添加,其吸附位点数量也在不断增多[18],竞争趋缓,因此,其吸附量也呈现上升趋势;随着Fh@BC2继续添加,其砷吸附位点过剩,因而吸附容量随之下降[19],故以0.02 g为后续试验的添加量。

图3 Fh@BC2投加量对As3+吸附的影响
2.4 溶液初始pH的影响
溶液pH值能够影响吸附剂表面电荷和砷形态,且溶液pH能够通过改变材料表面的结合位点,使其作用效果产生差异[20]。由图4可知,Fh@BC2等电点(pHPZC)为5.5,反应后溶液pH均有不同程度降低,但变化不大,这表明吸附剂对反应体系pH的影响较小,更易维持反应体系的稳定。

图4 Fh@BC2的等电点及溶液pH变化
pH为3~11条件下,As3+的主要存在形态为H3AsO3(pH 3~9.7)和H2AsO3-(pH 9.7~11);As5+的主要存在形态为H2AsO4-(pH 3~6.8)和HAsO42-(pH 6.8~11)[21]。溶液pH对砷吸附的影响见图5,pH为3~11时,Fh@BC2对砷均具有良好的吸附效果(72.03~58.52 mg·g-1),这表明复合材料具有较宽的pH适用范围。此外,Fh@BC2在酸性条件下具有更高的砷吸性能。当pH

图5 溶液pH对Fh@BC2吸附As3+的影响
2.5 吸附等温线
Fh@BC2在不同砷浓度下的吸附性能见图6。由图6可知,随着As初始浓度的升高,Fh@BC2砷吸附容量也增大。Langmuir模型中,Qm、kL和RL2分别为80.09 mg·g-1、0.180 mg·g-1和0.998。Freundlich模型中,kF、n和RF2分别为19.78 L·mg-1、0.308和0.573。Fh@BC2的砷吸附过程更加符合Langmuir模型,这表明Fh@BC2材料表面反应位点均等,对砷的吸附机理为单层吸附[23]。根据Langmuir模型,经拟合,Fh@BC2的最大砷吸附容量为80.09 mg·g-1。

图6 Fh@BC2对As3+的等温吸附拟合曲线
2.6 吸附动力学
不同反应时间Fh@BC2的砷吸附容量见图7。
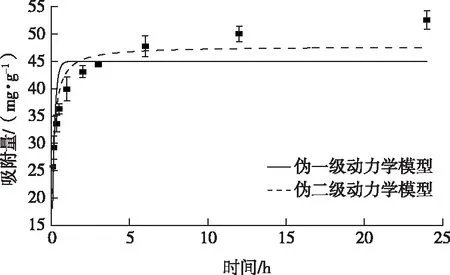
图7 Fh@BC2对As3+的吸附动力学拟合曲线
由图7可知,Fh@BC2对砷的吸附过程可以简要分为两个阶段:首先在0~2 h内,有着较高的吸附速率,85.7%的砷在2 h内被复合材料吸附;随后,在24 h内逐渐达到吸附平衡。这归因于吸附初期,复合材料表面具有大量吸附点位用于砷的吸附,吸附量快速增加[24];随着Fh@BC2对砷吸附量的增加,吸附点位减少,砷逐渐扩散到复合材料Fh@BC2内部,传质阻力增大,因而吸附速率随之降低[25]。这一吸附过程与WU等[26]研究中描述的吸附过程相一致。
伪一级动力学模型中,qe、k1和R2分别为44.98 mg·g-1、6.18 h-1和0.65;伪二级动力学模型中,qe、k2和R2分别为47.71 mg·g-1、0.19 g·mg-1·h-1和0.88。拟合结果更加符合伪二级动力学模型,这表明限制砷反应速率的可能是化学吸附过程[27]。
2.7 吸附稳定性分析
Fh和Fh@BC2上水溶态砷、表层吸附态砷、稳定态砷占比分别为0.45%、0.94%、98.61%和0.29%、0.53%、99.18%。与纯水铁矿相比,复合材料上固定的有效态砷减少为纯水铁矿的59%,而稳定态砷增加。连续提取试验结果表明,Fh@BC2吸附的砷99%为稳定态砷,根据WAN等[13]的研究,稳定态砷生物利用性低,说明Fh@BC2上固定的砷在环境中风险较低。
2.8 不同As吸附剂性能比较
不同材料对砷的去除能力见表2[28-33],所制备的Fh@BC2较其他文献研究的材料显然具有很好的吸附效果。此外,笔者研究中Fh@BC2对砷的吸附有较宽的pH适用范围,且其吸附的砷较稳定,可认为是一种有前途的砷吸附剂。
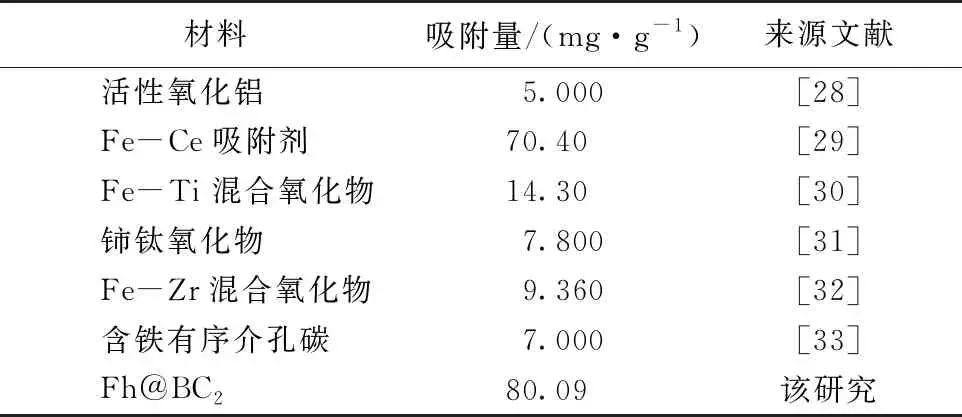
表2 不同材料As去除能力的比较
2.9 吸附机制
由图8可知,BC的2θ峰对应的晶面与CaCO3(PDF No.71-2396)相符,这是由于花生壳含有较高的Ca元素所致[34];合成的Fh与文献[35]报道的2线水铁矿的XRD谱图相一致,无明显衍射峰,仅在2θ为35°和62°处有明显宽峰;Fh@BC2吸附As前后的XRD谱图均与Fh相似,结晶度均较差,这表明Fh在BC上成功合成,且在吸附砷后没有形成新的结晶相。
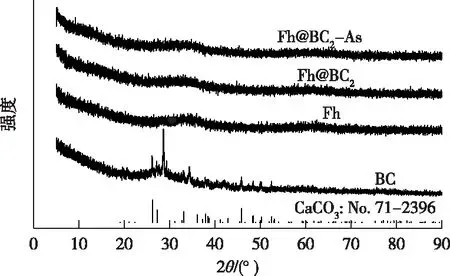
BC为生物炭,Fh为水铁矿, Fh@BC2指炭载水铁矿的铁炭质量比为2。


BC为生物炭,Fh为水铁矿, Fh@BC2指炭载水铁矿的铁炭质量比为2。


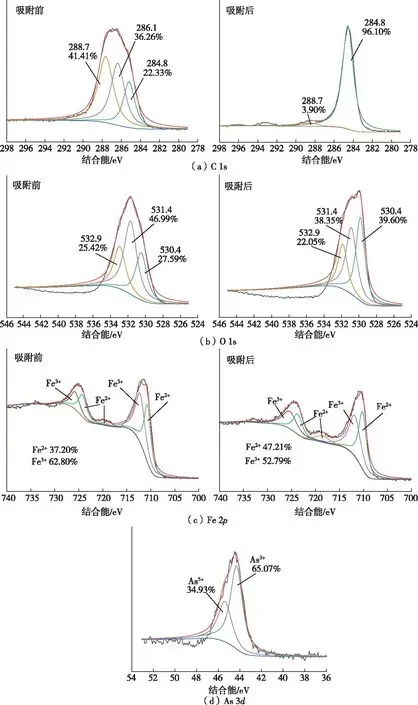
图10 Fh@BC2吸附As前后C 1s、O 1s、Fe 2p和As 3d的XPS谱图
如图10(c)所示,Fh@BC2表面Fe2+和Fe3+相对含量分别为37.20%和62.80%。吸附后,Fh@BC2中Fe2+相对含量增加到47.21%,Fe3+相对含量下降为52.79%,表明吸附过程中Fh@BC2表面的Fe3+发生了夺电子反应,使As3+向As5+转化。
如图10(d)所示,44.8和45.2 eV处的峰分别与As3+和As5+对应。As3+和As5+占比分别为65.07%和34.93%,进一步表明Fh@BC2具有氧化As3+的能力。
综上所述,Fh@BC2砷吸附机制主要包括静电吸附和配位络合。
3 结论
以花生壳和水铁矿为原料,制备Fh@BC2复合材料,其对砷具有很好的吸附效果。BET、SEM-EDS、XRD和FTIR分析结果表明,水铁矿和生物炭成功复合,复合后水铁矿的团聚现象得到改善。Fh@BC2具有较宽的pH适用范围。Langmuir拟合结果显示Fh@BC2吸附容量可达68.67 mg·g-1。吸附稳定性研究结果表明,Fh@BC2对砷的吸附更加稳定,吸附后材料对环境的风险更低。Fh@BC2对砷的吸附机制主要包括非特异性吸附(静电引力)和特异性吸附(配位、络合等),吸附过程以化学吸附为主。
