鳗草WRKY基因家族的筛选与生物信息学分析❋
2022-03-26王鸿睿唐学玺
薛 颂,尚 帅,2,臧 宇,陈 军,王鸿睿,唐学玺❋❋
(1.中国海洋大学海洋生命学院,山东 青岛 266003; 2.滨州学院黄河三角洲生态环境研究中心,山东 滨州 256600;3.自然资源部第一海洋研究所,山东 青岛 266061)
植物在长期进化过程中,形成了多种调控机制和复杂的信号网络,能够通过调控基因的表达来调节自身生长发育,并适应、抵抗和耐受各种生物和非生物胁迫[1]。转录因子(Transcription factor)通过在基因的启动子区域与顺式作用元件发生特异性相互作用,激活或抑制特定靶基因的转录速率,从而参与植物对环境胁迫的响应[2]。WRKY转录因子是高等植物中最重要的转录因子之一[3],其特征是N端具有高度保守的WRKYGQK氨基酸序列,可与(T)(T)TGAC(C/T)序列(通常称为W-box)特异性结合,精确调控功能基因的表达。第一个WRKY转录因子(SPF1)由Ishiguro和Nakamura[4]从甘薯中鉴定出来。近年来,WRKY基因家族成员也在番茄(Solanumlycopersicum)[5]、枣(Ziziphusjujuba)[6]、鹰嘴豆(Cicerarietinum)[7]和黄瓜(Cucumissativus)[8]等植物中被鉴定出来。WRKY转录因子通过激活或抑制相关基因的表达,或者通过与其他蛋白相互作用,广泛参与调节植物种子萌发[9]、叶片衰老[10]、花药和胚胎发育[11]以及对生物和非生物胁迫的响应[9-11]等多种生理生化过程,增强植物对环境的适应性。目前,植物WRKY基因家族的研究主要集中在陆生作物中[12-14],在海洋高等植物中研究较少。
鳗草(ZosteramarinaL.)作为一种多年生海洋高等被子植物,是浅海生态系统重要的初级生产者[15]。此外,鳗草在稳定沉积物、净化水体方面也具有重要的生态功能[16-17]。目前的研究表明鳗草是由陆生植物再次进入海洋进化而来,能够在陆海过渡地带的潮间带地区生存和繁殖,其独特的进化历程使其演化出与陆生高等植物和藻类所不同的海洋环境适应机制。
为了解WRKY转录因子在鳗草适应海洋环境过程中的转录调控作用,本研究利用生物信息学手段,深入研究了WRKY基因家族信息及其分子进化特征,包括鳗草WRKY基因家族的鉴定及特征分析、基因结构和蛋白保守序列分析、系统发育分析、启动子区顺式作用元件分析以及在不同器官中的表达分析。本研究将为研究WRKY基因家族的功能提供基础,对于揭示高等被子植物适应海洋环境的内在机制具有重要意义。
1 材料与方法
1.1 鳗草WRKY基因家族的鉴定及特征分析
从phytozome v12.1数据库(https://phytozome.jgi.doe.gov)和NCBI网页(https://www.ncbi.nlm.nih.gov)下载所需的鳗草基因组序列、cDNA序列以及蛋白质序列文件。以拟南芥(Arabidosisthaliana)WRKY基因家族的氨基酸作为种子序列,搜索鳗草基因组和蛋白质组数据库,筛选获取e值小于-20的序列作为ZmWRKY候选基因。为更好确定获取基因的准确性,本研究结合Pfam蛋白结构域数据中WRKY基因家族的DNA结构域,利用HMMER软件构建隐马尔可夫模型,并以此作为种子序列检索鳗草蛋白质序列,获取ZmWRKYs的候选基因。综合两种筛选方式获取候选基因,利用SMART软件对该候选基因进行保守结构域的鉴定,最后筛选出ZmWRKY基因。此外,利用ExPASy生物信息学资源门户网站(https://web.expasy.org/protparam/)对ZmWRKY蛋白进行理化性质的分析[18-19]。
1.2 鳗草WRKY基因家族结构和蛋白保守序列分析
使用基因结构显示系统GSDS(http://gsds.cbi.pku.edu.cn/)构建ZmWRKYs基因的结构示意图。使用MEME(http://meme-suite.org/doc/download.html)对选定的ZmWRKY蛋白进行保守序列分析,基序搜索数目为5,其他参数默认设置。
1.3 鳗草WRKY基因家族的系统发育分析
为了进一步分析鳗草WRKY基因家族的进化关系,以拟南芥WRKY基因(AtWRKY)保守结构域的氨基酸序列作为参考序列[3],使用MEGA 7.0软件,利用邻接法构建鳗草和拟南芥WRKY基因家族的系统发育树。拟南芥WRKY蛋白来自TAIR数据库(http://www.arabidopsis.org/)。自检值设置为1 000,并使用iTOL在线软件(http://itol2.embl.de)分析。
1.4 鳗草WRKY基因家族启动子区顺式作用元件分析
从鳗草基因组数据库中获得ZmWRKYs基因转录起始区上游2 000 bp的启动子序列。利用PlantCARE在线数据(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)和MEME对鳗草WRKY基因启动子区的顺式作用元件进行分析。
1.5 鳗草WRKY基因家族的表达分析
为研究鳗草WRKY基因家族的表达模式,对ZmWRKYs在4个不同器官中的表达情况进行分析。WRKY基因家族在鳗草不同器官中的表达数据来源于NCBI数据库(http://www.ncbi.nlm.nih.gov/sra)。利用TBtool程序分析ZmWRKY基因的表达数据并绘制基因表达热图。
2 结果与分析
2.1 鳗草WRKY基因家族成员的鉴定及其蛋白理化性质
在鳗草基因组序列中共鉴定出44个ZmWRKY基因。根据结构域数量和特定锌指结构的特征,ZmWRKYs被分为Ⅰ组、Ⅱ组和Ⅲ组(见表1)。其中:Ⅰ组成员包含两个带有C2H2锌指结构的WRKY结构域(除ZmWRKY41外);Ⅱ组成员包含一个带有C2H2锌指结构的WRKY结构域;Ⅲ组包含一个特定C2HC锌指结构的WRKY结构域。Ⅱ组为最大的类群,共有30个成员,根据保守基序的差异及进化关系,Ⅱ组可进一步划分为5个亚组(Ⅱa、Ⅱb、Ⅱc、Ⅱd和Ⅱe)。所有ZmWRKY蛋白均含有完整的WRKY结构域。亚细胞定位结果显示,所有的WRKY蛋白均位于细胞核。在43种ZmWRKY蛋白中发现了高度保守的WRKYGQK结构域,而ZmWRKY5存在WRKYGKK结构域序列变异。
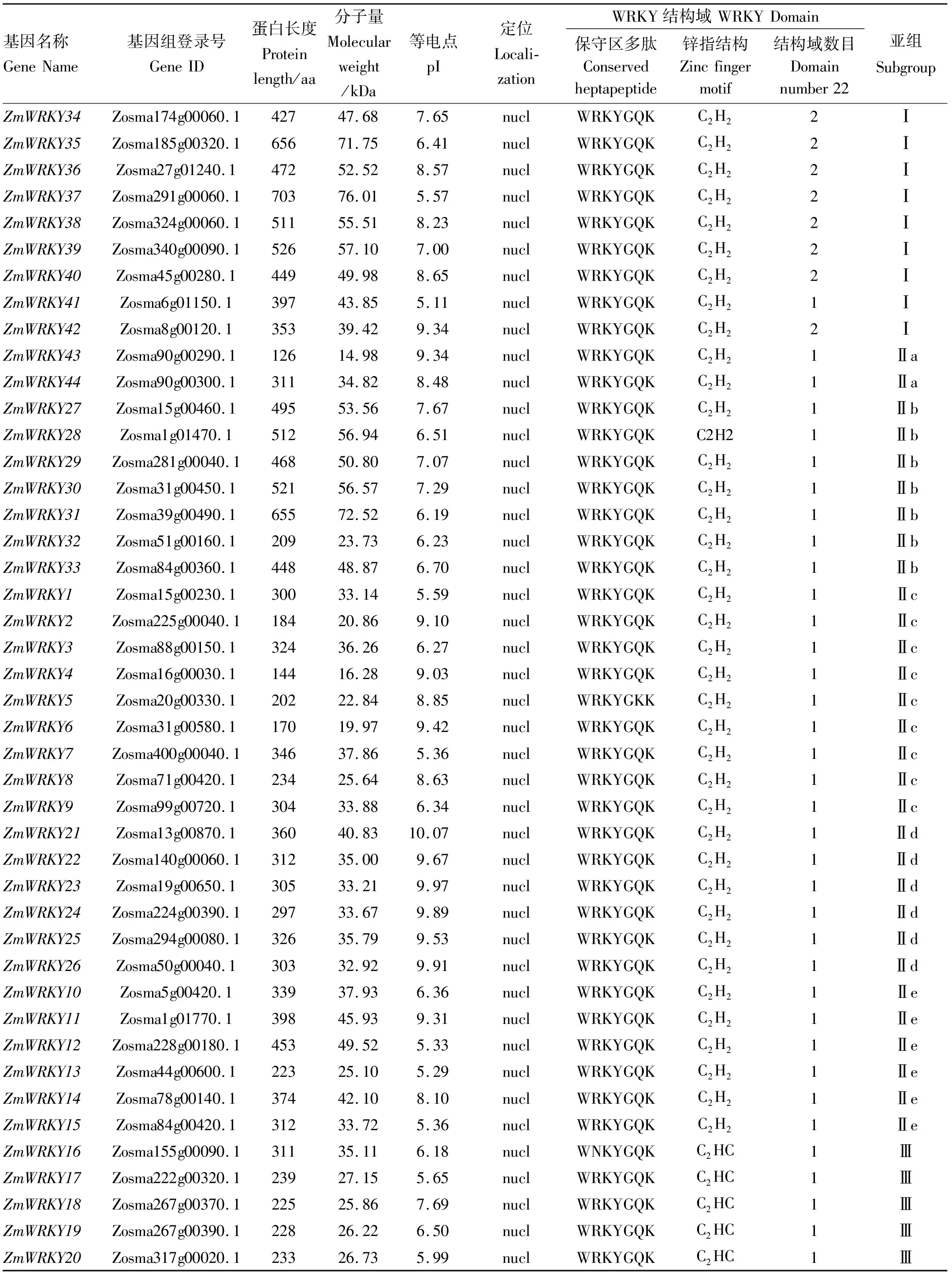
表1 鳗草WRKY基因家族成员及其理化性质
鳗草WRKY转录因子的理化特性分析表明,ZmWRKY转录因子的大小差异较大,其中,ZmWRKY43编码的蛋白最短,仅有126个氨基酸,其分子量也最小(14.98 kDa);ZmWRKY37编码的蛋白最长,有703个氨基酸,其分子量也最大(39.55 kDa)。ZmWRKYs等电点在5.10(ZmWRKY11)~10.07(ZmWRKY21)之间,平均pI值为7.53,表明该家族蛋白趋向于弱碱性。
2.2 鳗草WRKY家族基因结构与蛋白保守基序分析
基因结构分析表明,所有ZmWRKYs基因均含有内含子,并且内含子数量表现出多样性,1~7个不等(见图1)。在所有的ZmWRKYs基因中,ZmWRKY11包含7个内含子,内含子数量最多。同一ZmWRKYs亚组成员具有相似的基因结构。例如,Ⅰ组成员均包含3个内含子(ZmWRKY35和ZmWRKY36),Ⅱa、Ⅱd和Ⅲ组的成员均包含2个内含子(ZmWRKY17除外),具有4个内含子的ZmWRKYs基因成员仅在Ⅱb组中发现。

图1 鳗草WRKY基因结构示意图
鳗草WRKY蛋白保守基序分析结果表明,Motif 1、Motif 2和Motif 7在所有44个ZmWRKYs蛋白中表现为绝对保守(见图2)。同一亚组的WRKY蛋白的保守基序较为相似,体现出WRKY基因家族进化的保守性。Motif 6和Motif 10只存在于Ⅰ组中,Motif 3在Ⅱa组中高度保守(ZmWRKY43除外),Motif 5在Ⅱc组中高度保守(ZmWRKY4除外)。Motif 4分布于Ⅰ组、Ⅱb组和Ⅱc组,Motif 9只分布于Ⅱd组和Ⅲ组。同一组的WRKY蛋白具有相似的基序组成,表明同一组的成员可能具有相似的功能。
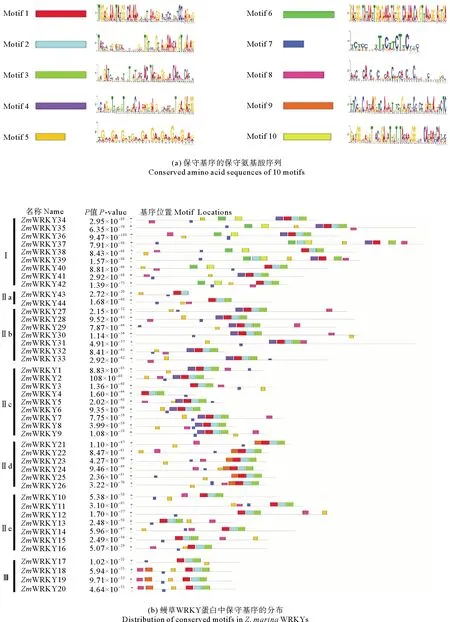
图2 鳗草WRKY蛋白保守基序分析
2.3 鳗草WRKY基因家族的系统发育分析
系统发育分析结果显示,ZmWRKYs被划分为7个亚组,这与鳗草WRKY基因分类结果一致(见图3)。在各亚组内部,大部分ZmWRKY基因与AtWRKYs聚到一起。ZmWRKY3不能聚成任何类群。值得注意的是,ZmWRKY41只包含一个WRKY结构域,但在进化树中与Ⅰ组成员更接近。
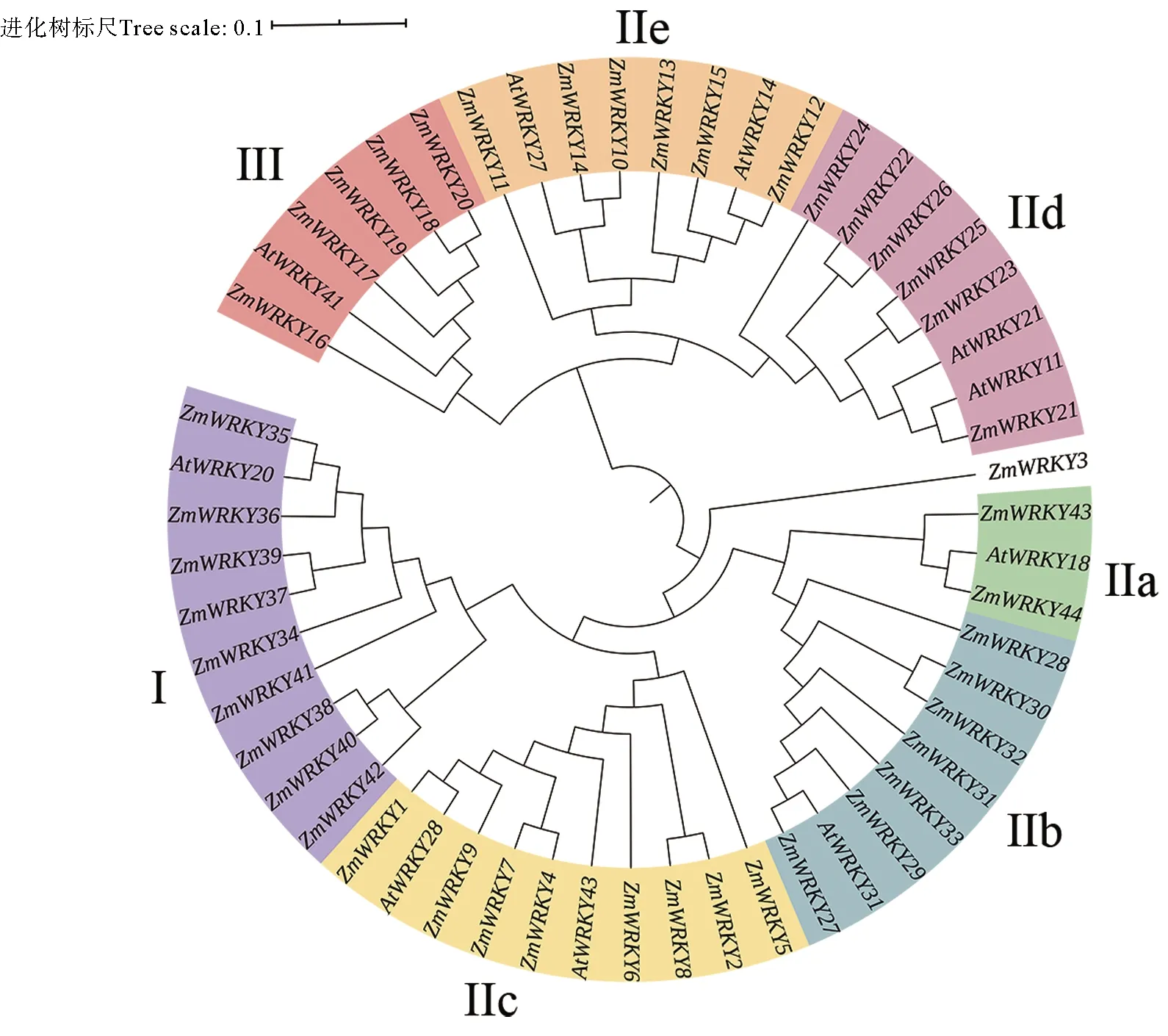
(Zm:鳗草;At:拟南芥。Zm: Z. marina; At: A. thaliana.)
2.4 鳗草WRKY基因家族启动子顺式作用元件分析
ZmWRKYs的启动子顺式作用元件分析结果表明,所有的ZmWRKYs基因的启动子区都含有多种与植物防御反应相关的顺式作用元件(见表2)。ZmWRKYs均含有与非生物胁迫响应相关的MYB和MYC。大部分ZmWRKYs基因启动子中都含有W-box,为WRKY结构域特异性结合的部位。参与激素调节的相关的调控元件,如ABRE、CGTCA-Motif、ERE、G-box、GARE-Motif、TCA-element、TGA-element和TGACG Motif,广泛存在于ZmWRKYs中。此外,与低温、干旱、盐胁迫等非生物胁迫有关的LTR和MBS元件存在于多种ZmWRKYs中。
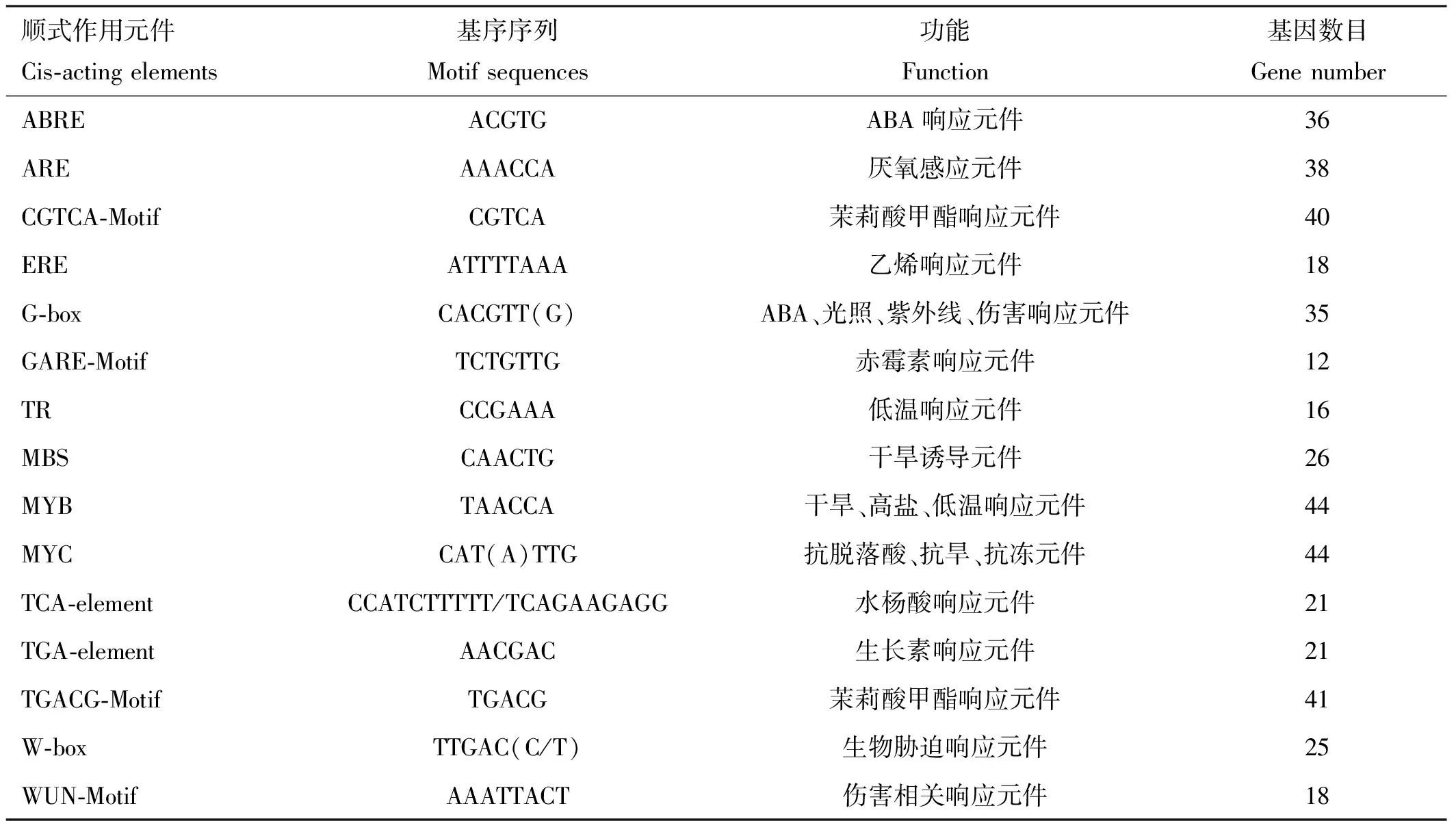
表2 鳗草WRKY基因启动子顺式作用元件核心序列与功能
2.5 鳗草WRKY基因家族的表达分析
鳗草WRKY基因在不同器官中的表达分析表明,鳗草WRKY基因在所有器官中均有表达(见图4)。ZmWRKYs在根和营养枝中的表达量较高,在雌花和雄花中的表达量较低,其中ZmWRKY20仅在根中表达。此外,同一基因在不同器官中存在表达差异。相比于其他器官,ZmWRKY24在雄花中表达量较高,ZmWRKY4在雌花中表达量较高,ZmWRKY15和ZmWRKY36在根中具有较高表达量,ZmWRKY31和ZmWRKY39在营养枝中表达量相对较高。Ⅱd和Ⅲ组成员在营养枝中具有较高的表达量,而在其他器官中表达量较低。鳗草雌花发育前期和后期的表达结果表明,部分ZmWRKYs(如ZmWRKY22和ZmWRKY42等)在雌花发育前后的表达量存在差异,均表现为雌花发育前期表达量较低,雌花发育后期表达量较高。
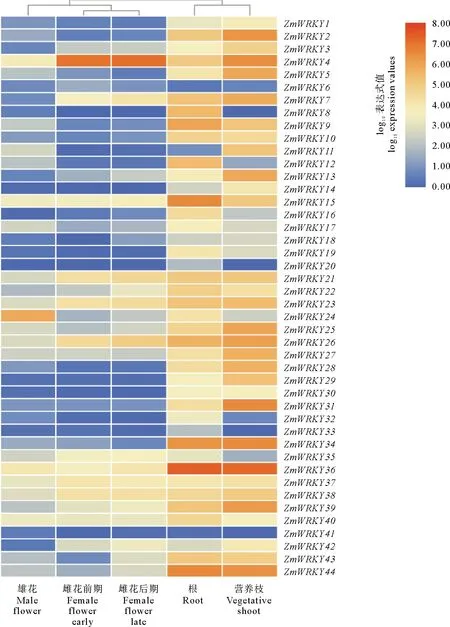
图4 鳗草WRKY基因在不同器官中的表达分析
3 讨论
WRKY转录因子作为关键调控因子参与调节植物的生长发育[20-22],在植物抵抗生物和非生物胁迫中具有重要作用[23-25]。WRKY基因家族的功能目前在多种高等植物中得到了广泛的研究,但在海洋植物中,尤其是在对近岸海洋生态具有重要作用的海草中研究较少。
基因复制不仅可以增加基因的数量,还是产生新基因的途径,在基因家族的扩展和进化中起着重要的作用[26]。为更好的探究陆地和海洋植物WRKY基因的数目规律,本研究汇总WRKY基因家族在22个物种中的数目特征(见表3)。结果表明,WRKY基因数目在不同物种中具有差异性。与陆生高等植物相比,WRKY基因在藻类、苔藓和蕨类等低等植物中数目较少,说明WRKY基因数目与植物的进化程度有关[27]。鳗草WRKY基因家族有44个成员,少于大部分高等植物,多于藻类、苔藓和蕨类等低等植物。已有研究表明,Ⅰ组WRKY基因起源最早,Ⅱ、Ⅲ组WRKY基因是随着物种进化及基因复制扩大而来,从而帮助植物增强对环境的适应性[18]。植物中WRKY基因家族成员的数量随着物种的进化而增加,这可能与基因组复制有关[26]。Ⅲ组作为一个最具活力的且具有许多重复事件的动态类群,其WRKY基因数目的差异是WRKY基因家族大小的主要原因[22]。鳗草Ⅲ组WRKY基因数量为5个,低于大多数单子叶植物和双子叶植物[28-30]。除此之外,植物在进化过程中的选择性压力可能影响WRKY基因家族的数目。鳗草在进化过程中至少经历了3次平行进化事件,适应陆地生活后又返回海洋环境中。因此本文作者推测,鳗草WRKY基因家族数量相比于其他陆生植物较低的原因是其在进化过程中二次进入海洋,导致部分WRKY基因丢失。研究表明,与陆生植物相比,漂浮水生植物少根紫萍(Landoltiapunctata)很少受到干旱胁迫、盐胁迫和寒冷胁迫,因此少根紫萍会失去与这些应激相关的WRKY基因,并保留应对水生环境胁迫相关的基因,如抗病基因[31]。

表3 不同物种WRKY基因家族的数量特征
WRKY结构域的缺失通常发生在单子叶植物中[49],鳗草中ZmWRKY41也表现出一个N端WRKY域的丢失。WRKY结构域的WRKYGQK氨基酸序列高度保守,几乎所有的ZmWRKY基因都具有WRKYGQK的特征序列。然而,ZmWRKY5存在WRKY域序列变异(WRKYGKK),这种轻微的变异也在水稻(O.sativa)和枣(Z.jujuba)中发现[6,50]。研究表明,WRKYGKK结构域可以特异性结合WK-box,这与WRKYGQK特异性结合的W-box有显著差异[51],因此WRKY保守序列的变异可能会影响WRKY基因与下游靶基因的正常相互作用和结合特异性[52]。
基因结构多样性是基因家族进化和多样化的重要组成部分。在木薯(M.esculenta)[37]和小麦(Triticumaestivum)[53]中,WRKY基因内含子的数量分别为0~5和1~5。在本研究中,鳗草WRKY基因内含子数量从1~7个不等,基因结构显示出较高的多样性,表明鳗草基因组在长期进化过程中经历了很大的选择变异,这可能与鳗草从陆地回归到海洋的进化过程有关。
植物体内具有复杂的防御信号通路来调节植物对外部环境胁迫的适应性[54]。环境胁迫条件下,WRKY转录因子可以通过与下游基因中相应的顺式作用元件特异性结合,调控目的基因在特定时空的表达,参与多种代谢途径和胁迫响应过程,从而增强植物对环境的适应性[55]。本研究中ZmWRKYs中均存在一系列与生长发育、生物胁迫、非生物胁迫和激素调节相关的顺式元件,表明WRKY基因家族成员可能参与调节鳗草生长发育和激素诱导,并参与应答生物胁迫和非生物胁迫。所有ZmWRKYs均包含与干旱响应相关的MYB和MYC元件,这可能与鳗草周期性失水复水有关,因此WRKY基因家族在鳗草适应潮间带生活中可能发挥重要作用。WRKY蛋白作为转录调控蛋白,可以特异性结合W-box调控防御相关基因的表达。近60%的ZmWRKY基因的启动子区含有W-box元件,表明这些WRKY转录因子可能具有自我调节或交叉调节机制。
系统发育树中同源性较高的基因通常具有相似的功能[56]。ZmWRKYs与AtWRKYs存在同源关系,且AtWRKYs的功能已被广泛研究,因此利用比较系统发育树可以推测ZmWRKYs的基因功能[57]。ZmWRKY3与拟南芥中发现的AtWRKY38、AtWRKY52相似[3],不能聚成任何类群。Ⅰ组WRKY基因被认为是植物中其他WRKY基因的祖先,更有可能在不同器官中存在特异性表达特征[58]。本研究Ⅰ组ZmWRKYs具有明显的器官表达差异性,在根和营养枝中的表达量较高,在雌花和雄花中的表达量较低。ZmWRKY36与AtWRKY20亲缘关系较近,且在根和营养枝中的表达量高于其他器官。AtWRKY20可以影响ADP-葡萄糖焦磷酸化酶(AGPase)的活性,该酶催化淀粉生物合成过程的第一个限速步骤,并参与拟南芥(A.thaliana)叶片淀粉合成过程[59],因此推测ZmWRKY36可能与鳗草叶片淀粉合成有关。鳗草作为潮间带被子植物,随着潮汐的变化,其营养枝周期性暴露于空气中并伴随着阶段性失水和复水,其根部深入泥沙中吸收水分维持生物体对水分的需求。研究表明,AtWRKY20能够增强拟南芥(A.thaliana)对水淹、失水和盐胁迫的耐受性[60]。本文作者推测ZmWRKY36在低潮过程中能够增强鳗草对失水和盐度变化的耐受性,有助于鳗草在漫长的进化过程中适应潮间带生活。
在Ⅱa组中,AtWRKY18作为信号途径调控基因能正向调节抗病相关基因表达,帮助植物抵抗病原体丁香假单胞菌的侵染[61]。与AtWRKY18同源的ZmWRKY43和ZmWRKY44在根中表达量相对较高,表明鳗草的根部相对于其他器官可能易受病原体侵染,ZmWRKY43和ZmWRKY44可能在鳗草抵抗病原体侵染中发挥重要作用。前人研究表明Ⅱd组中AtWRKY11参与植物维管束发育过程[62]。鳗草WRKY基因家族中Ⅱd组成员在营养枝中的表达量普遍较高,表明Ⅱ组成员可能参与调控鳗草维管束的发育。除此之外,大多数参与开花调控的WRKY基因属于Ⅱ组[60,63-68]。鳗草雄花中ZmWRKY24的表达量较高,雌花中ZmWRKY4的表达量较高,ZmWRKY7和ZmWRKY22在雌花开花后期的表达水平显著高于前期,这些结果均表明鳗草Ⅱ组WRKY基因可能参与调节植物中花的发育过程。
Ⅲ组成员是WRKY基因家族中最活跃的类群,在植物抵抗非生物和生物胁迫、增强免疫防御方面发挥重要作用[69]。例如,拟南芥(A.thaliana)中Ⅲ组大多数成员对病原菌感染都有响应[58]。研究发现,在生物和非生物胁迫下,WRKY转录因子可以与丝裂原活化蛋白激酶(MAPK)相互作用,激活级联反应,显著影响植物免疫功能[70]。在本研究中Ⅲ组成员的启动子区域具有MYB、MYC、TGACG-Motif、G-box、CGTCA-Motif等与光照、干旱、低温及生物胁迫相关的作用元件,且Ⅲ组成员在根中的表达量高于其他器官的表达量,推测鳗草WRKY基因在根部参与调节植物对应答生物胁迫和非生物胁迫的响应。
4 结语
本研究利用生物信息学方法,结合已发表的鳗草基因组信息,对鳗草WRKY基因家族进行鉴定与分析。研究表明,鳗草WRKY基因家族共有44个成员,包含Ⅰ组、Ⅱ组和Ⅲ组3个类群。鳗草WRKY基因家族数目明显少于其他陆生高等植物,可能是由于二次入海导致鳗草WRKY基因数目丢失。鳗草基因结构的多样性,表明鳗草基因组在长期进化过程中经历了很大的选择变异,这可能也与鳗草从陆地回归到海洋的进化过程有关。ZmWRKYs的启动子存在MYB、MYC、ABRE、CGTCA-Motif、TGACG Motif、LTR、MBS等顺式作用元件,表明WRKY基因家族成员可能参与调节鳗草生长发育和激素诱导,并参与应答生物胁迫和非生物胁迫。转录表达分析表明,鳗草WRKY基因存在基因表达差异和器官表达差异,ZmWRKYs在根和营养枝中的表达量较高,在雌花和雄花中的表达量较低。
