一株南方红壤区杉木根际高效解钾菌的筛选、鉴定及其培养条件优化
2022-03-26饶惠玲冯清玉吴承祯
赵 君,饶惠玲,冯清玉,黄 伟,吴承祯,李 键*
(1.福建农林大学林学院,福建 福州 350002;2.武夷学院生态与资源工程学院,福建 南平 354300;3.福建省高校森林生态系统过程与经营重点实验室 福建 福州 350002)
氮、磷、钾三大营养元素在植物的生长发育过程中起着不可或缺的作用,而钾元素在提高关键光合酶活性、提高叶绿素含量、维持细胞电荷平衡[1]等方面的作用尤为突出。我国南方红壤区92%~98%的钾元素以矿物质的形式存在[2],不易被植物吸收利用,进而影响植物的生长、产量、品质等。目前,优化提升土壤钾素含量多以施用钾肥为主,但我国钾肥储量并不富余,需以进口手段满足需求[3],且随着钾肥频繁使用,土壤污染加重。因此,如何高效转化土壤中的缓效钾元素,从而低成本高效的促进植物的吸收利用和生长发育,是近来土壤和植物营养学界关注的热点之一。
土壤微生物组通过自身代谢参与植物养分元素循环[4]、通过竞争或合作关系等促进根际微环境稳定[5],对植物的生长和健康有明显增益作用。解钾菌作为土壤微生物的重要组成部分,对含钾硅酸盐矿物具有分解作用,是将土壤中的缓效钾转化为速效钾的有效绿色微生物肥料[6]。在探索利用解钾菌改善农作物低钾胁迫方面,前人已有诸多尝试[7-9],但微生物肥料种类繁多并具专一性,不同作物根际筛选出的解钾菌能力各不相同,只有以土壤环境、植物种类等为选择依据,施用最适解钾菌才能产生最大效益[10]。
我国南方红壤区主要造林树种杉木(Cunninghamia lanceolata(Lamb.) Hook.)具有经济、速生、丰产的特点,在提供生产用材、建筑用材、水土保持等方面具有较高的经济、生态价值。杉木多采用实生苗进行造林[11],在育苗和造林初期往往存在立地困难,诸如幼苗需水量大、固碳能力不完善等[12],而钾素在调节其细胞吸水[13]、加速植物木质化速率[14]、促进根系生长发育[15]等方面发挥着不可或缺的作用,能够显著提升杉木幼苗抗性和存活率。近年来,微生物组技术在解决农田养分匮乏、提高植物抗性、缓解农业废弃物污染等方面已有了大量探索和初步成效[16],这为利用林木生物工程菌种解决钾素匮乏问题提供了全新的思路,因此,本研究以南方红壤区杉木人工林下根际土壤为研究对象,分离筛选高效解钾菌并分析其解钾能力,经16S rDNA 鉴定确定其属,通过单因素实验与正交试验来优化高效解钾菌的生长条件,以期获得高效解钾菌的最佳培养量,为解钾工程菌的开发奠定研究基础,亦为改善南方红壤区杉木人工林下根际土壤营养元素环境提供新的路径。
1 材料与方法
1.1 实验材料
本实验土壤样品采集于福建省南平市建阳区小湖镇溪东国有林场,26°40′~27°20′ N,118°08′~120°31′ E,位于武夷山脉南侧。为中亚热带季风气候,季风气候显著,春暖秋凉,夏季高温多雨,冬季温和少雨。实验地土壤为花岗岩发育的暗红壤,土层厚度在90 cm 以上,海拔高度350 m 左右,坡度范围20°~35°。相关研究表明,杉木人工林幼龄到中龄的全钾含量增加[17],即幼龄阶段杉木低钾胁迫更为严峻,因此本研究选取南方红壤区不同林龄(2,4,10,15 a)杉木人工林下根际土壤作为实验样品,以便更为全面的筛选高效解钾菌株。
1.1.1 土壤样品采集及理化性质测定 采用五点取样法选取取样点,采用分层取样法[18]以及抖落法[19]采集根际土壤,采用四分法去除多余土样,新鲜根际土样置于冰箱(4℃)保存以备菌株的筛选,非根际土样待风干后测定土壤理化性质。其中,分别采用钼锑抗比色法、盐酸-硫酸浸提法测定全磷、有效磷,采用重铬酸钾-外加热法测定有机质,分别采用半微量凯氏法、碱解-扩散法测定全氮、水解氮,分别采用碱熔-火焰光度法、乙酸铵浸提-火焰光度法测定全钾、速效钾,采用电位法测定pH[20]。
1.1.2 培养基 解钾菌的初筛采用亚历山大硅酸盐初筛培养基[21]:蔗糖5.0 g,硫酸镁0.5 g,磷酸氢二钠2.0 g,碳酸钙0.1 g,三氯化铁0.005 g,钾长石粉1.0 g,琼脂18.0 g,去离子水1 000 mL,pH 7.0~7.5。
培养初筛得到的解钾菌采用种子液培养基[22]:蔗糖10.0 g,硫酸镁0.5 g,碳酸钙1.0 g,硫酸铵1.0 g,氯化钠0.l g,酵母膏0.5 g,磷酸氢二钾2.0 g,pH 7.2~7.4,去离子水1 000 mL。
解钾菌的复筛采用摇瓶复筛培养基[23]:蔗糖10.0 g,硫酸镁0.5 g,碳酸钙1.0 g,硫酸铵1.0 g,氯化钠 0.l g,酵母膏0.5 g,磷酸氢二钠2.0 g,钾长石粉10.0 g,pH 7.2~7.4,去离子水1 000 mL。
发酵基础培养基采用LB 培养基[24]:胰蛋白胨10.0 g,酵母浸出粉5.0 g,葡萄糖0.5 g,氯化钠 0.5 g,pH 7.0~7.2。
1.2 解钾菌的筛选、鉴定及培养条件优化
1.2.1 解钾菌分离与纯化 菌株分离:配置一定浓度(10-3、10-4、10-5)的土壤悬液,将其涂于亚历山大硅酸盐培养基平板中央,将涂布后的平板倒置并转移至恒温培养箱(30℃,4 d)培养。每个梯度设3 个重复并编号,培养过程中观察菌落形态,以菌落形态呈圆形、透明、凸起较高、表面湿润粘稠且富有弹性为筛选指标挑取菌落。
菌株纯化:采用划线法纯化分离筛选后的解钾菌并于30℃培养箱培养3~7 d,反复纯化2~3 次,于电子显微镜下观察菌落形态。将纯化后的解钾菌转移至LB 培养基,保存于冰箱(4℃)备用[25]。
1.2.2 解钾菌筛选 将上述挑选好的解钾菌进行摇瓶液体培养释钾实验以测定其解钾能力。各取10 mL 解钾菌培养液经离心处理(4℃,6 000 r·min-1,10 min)后取上清液,加入5 mL 浓硫酸与2 mL 30%过氧化氢溶液消煮,并反复加30%过氧化氢溶液数次至粘性物质完全消化后,定容至50 mL后用火焰原子吸收分光光度法测定菌株培养液中可溶性钾的含量[26]。

R为解钾率(%),K为接种发酵液中的钾含量(μg·mL-1),CK为未接种解钾菌培养液的钾含量(μg·mL-1)。
1.2.3 菌株16S rDNA 鉴定 利用天根细菌基因组提取试剂盒(DP302-02)提取菌株的总DNA 并进行PCR 扩增,将产物经2% 琼脂糖凝胶电泳,割取目的条带,按照天根回收试剂盒(DP214-03)纯化回收,送往上海迈浦生物科技有限公司进行测序。将测序结果提交至RDP 及NCBI 数据库中进行序列比对分析,选取与Genbank 中同源性最高的序列,确定菌株类型。
1.2.4 培养条件优化 培养基组分优化:将基础培养基中的碳源分别用葡萄糖、蔗糖、乳糖、可溶性淀粉、麦芽糖、甘露醇代替,依据菌液OD600确定最佳碳源。选用最佳碳源设置浓度梯度(0.5%、1.0%、1.5%)并根据菌液OD600值确定最适浓度。利用硫酸铵、氯化铵、硝酸钾、蛋白胨、酵母粉、尿素替换基础培养基中的氮源以确定最佳氮源,改变最佳氮源浓度(0.5%、0.8%、1.0%、1.3%、1.5%)确定其最适浓度。
培养条件优化:基础培养基组分保持不变,分别对菌株发酵液培养条件进行梯度设置(pH 为5.0、6.0、6.5、7.0、7.2、7.5、8.0、9.0;装液量为10、20、30、40、60 mL;接种量为1%、3%、5%、7%、9%;培养温度为20℃、25℃、28℃、30℃、35℃、40℃),记录各组处理菌液OD600值,确定最适培养条件。
正交试验:根据单因素实验结果,设计L9(34)四因素(A:初始pH;B:装液量;C:接种量;D:培养温度)三水平正交试验,每组处理设置3 个重复。
1.3 数据处理与方法
采用Exce1 2010 进行原始数据的整理与分析,运用SPSS 19.0 进行单因素方差分析(One-Way ANOVA)比较不同菌株解钾量的差异进行方差分析,正交试验数据处理采用正交设计助手ⅡV3.1。采用Pearson 相关系数法确定pH 与溶磷量之间相关关系,采用最小显著差异法(LSD 法)进行显著性检验和多重比较,显著性水平0.05。
2 结果与分析
根据1.1.1,得出研究区土壤基本理化性质(表1)。
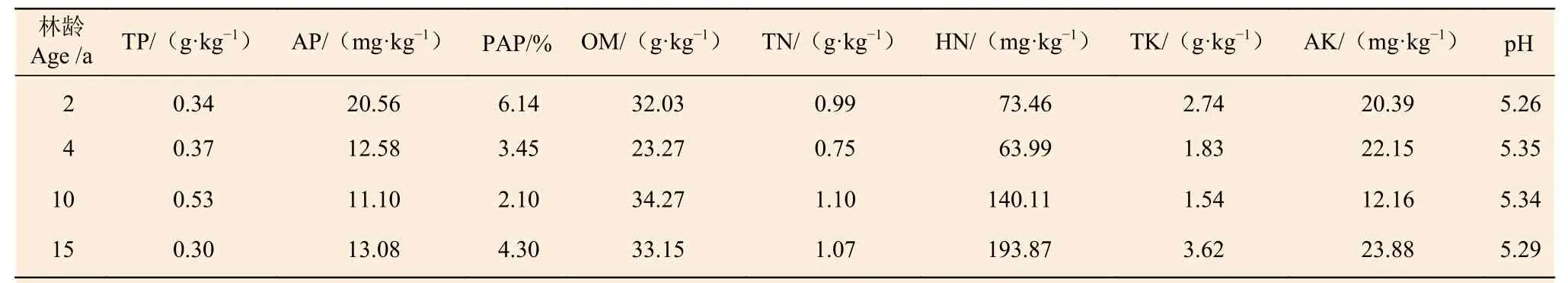
表1 杉木人工林土壤基本理化性质Table 1 Basic physiochemical properties of Chinese fir plantation soil
2.1 解钾菌的分离与形态学特征
从不同林龄杉木人工林下根际土壤中共分离出79 株解钾菌,根据分离纯化过程中菌株的形状、颜色、大小、生长速度快慢等特征[11],挑选出20 株优势菌株(编号JK1-JK20)用于摇瓶液体培养,测定其解可溶性钾含量并计算解钾率以筛选高效解钾菌。本次实验筛选出的解钾菌都为细菌,绝大多数菌株的菌落形态呈现圆形、透明、凸起、边缘整齐、表面湿润粘稠且富有弹性,亦存在颜色为淡红色、乳白色半透明的情况;菌体形态多为长杆状,两端钝圆,常成对状、链状排列;绝大多数菌株具备芽孢,芽孢呈椭圆或卵圆状,并有肥厚荚膜存在。
2.2 解钾菌的解钾能力测定与筛选
测定不同菌株发酵液的可溶性钾含量(图1),不同菌株解钾量存在差异。各菌株发酵液的可溶性钾含量范围为38.29~81.06 μg·mL-1。整体来看,20 株菌株中共有13 株解钾量显著高于CK,占比65%,可溶性钾含量较CK 增加量的范围为1.66~30.55 μg·mL-1,分解钾长石矿能力明显。JK13 解钾量 为81.06 μg·mL-1,为CK 的1.6 倍,显著高于其他菌株(P< 0.05),其次为JK2、JK16。以上13 株菌株中,解钾率高于20%的菌株共计7 株,占比53.85%,解钾率低于10%的菌株共计3 株,占比23.08%(图2)。
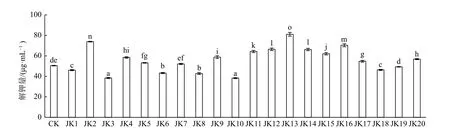
图1 不同解钾菌解钾量Fig.1 The amount of potassium in different solutions
不同菌株解钾率(图2)存在显著差异(P<0.05),大部分菌株解钾率为正。综合解钾率与解钾量二者来看,JK13 解钾率最高,为60.49%,其次JK2 和JK16 的解钾率为46.37%、39.33%。此外,菌株JK1、JK3、JK6、JK8、JK10、JK18、JK19 这7 株菌的培养液可溶性钾含量低于CK,说明这7 株菌株不具备解钾能力,原因可能是这些菌株本身在成长繁殖过程中需要吸收一定量的钾素[27]。另外,前期处理过程中的H2O2灰化处理并不能使菌株体内的钾完全释放,也可能在转移过程中有部分速效钾被破坏导致流失。

图2 不同解钾菌解钾率Fig.2 The potassium solvability of different potassium-solubilizing bacteria
对上述20 株菌株发酵液进行pH 测定,发现各菌株pH 值显著低于CK(P< 0.05),解钾菌在代谢过程中会产生酸性物质,进而提高对钾长石矿中不可溶钾向可溶性钾转化的效率,提高溶液钾离子含量[28]。其中,JK15 的pH 值最低,为4.12,其解钾率为22.93%,具有较好的解钾能力,其次JK20 的pH 值为4.20,但其解钾率为12.54%。对13 株有效解钾菌的解钾量与发酵液pH 值进行相关性分析(图3),得出二者之间不存在相关关系(R2=0.852,P> 0.05)。由此可见,虽然解钾菌株在解钾过程中都能分泌酸性物质,但是菌株解钾能力的强弱与发酵液pH 值大小并无直接相关关系。

图3 溶解量与培养液pH 的关系Fig.3 Relationship between pH and potassium-solubilizing ability
2.3 菌株鉴定结果
经鉴定,菌株JK13 属芽孢杆菌属(Bacillus altitudinis),且进行比对的序列片段与高地芽孢杆菌(Bacillus altitudinis)、枯草芽孢杆菌(Bacillus subtilis)相似性达到100%,与嗜气芽孢杆菌(Bacillus aerophilus)、同温层芽孢杆菌(Bacillus stratosphericus)、地衣芽孢杆菌(Bacillus licheniformis)及空气芽孢杆菌(Bacillus aerius)4 个种的相似性达到99%(图4)。
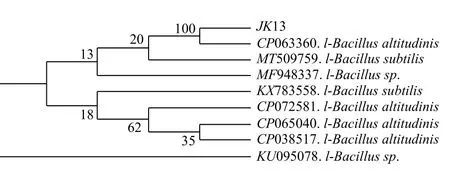
图4 菌株JK13 系统发育树Fig.4 Phylogenetic tree of strain JK13
2.4 解钾菌培养条件优化
2.4.1 单因素筛选 不同培养条件下菌株JK13 生长量差异显著(P< 0.05)(图5)。碳源是微生物生长发育、新陈代谢的主要能量来源[29-30],JK13 对葡萄糖、蔗糖、麦芽糖、乳糖、甘露醇均能吸收利用,但以0.5% 浓度的甘露醇为碳源时OD600值显著高于其他碳源,菌株生长量最大(图5a、b),生长情况最好;经单因素方差分析和LSD 多重比较表明,0.5% 浓度的甘露醇与1.5%浓度之间存在显著差异。氮源在微生物生长过程中也发挥着重要的作用[31],经单因素方差分析和LSD 多重比较表明,以酵母粉为氮源时JK13 菌液浓度显著高于其余5 种氮源(P< 0.05)。对菌株JK13 而言,氯化铵、硝酸钾、尿素3 个处理之间无显著差异(P> 0.05);而氯化铵处理同硫酸铵、硝酸钾、尿素3 个处理间呈显著差异,后三者之间则无显著差异(图5c)。菌株JK13 对1.0%浓度的酵母粉吸收利用效率更高,生长情况最好,而0.75%、1.0%、1.25%这3 种浓度处理之间差异不显著(图5d)。
初始pH 对菌株生长量影响差异性显著(P<0.05)(图5e),菌株JK13 的最适pH 值为9.0,菌液OD600值随pH 的增加呈上升趋势;经单因素方差分析和LSD 多重比较,pH 为9.0 的处理同其余处理呈显著差异。不同菌株对氧气的需求量存在差异,摇瓶环境中氧气含量的多少是影响菌株生长速率的重要因素之一[32]。菌株JK13 生长量在30~40 mL 间无显著差异;30 mL 装液量与10 mL、60 mL 处理间的差异达到显著水平(P< 0.05)(图5f)。经单因素方差分析和LSD 多重比较表明,JK13 的不同接种处理间差异并不显著(图5g)。JK13 的最适温度范围为28~35 ℃,但在35 ℃处理下的菌液OD600值显著高于其他温度处理(P< 0.05)(图5h)。

图5 不同培养条件对菌株生长量的影响Fig.5 The influence of different culture conditions on the growth of strains
2.4.2 正交试验 基于上述单因素实验,设计4 因素(初始pH、装液量、接种量、培养温度)3 水平正交试验(表2)。其中因素A 为初始pH 值(7.5、8.0、9.0),因素B 为装液量(20 mL、30 mL、40 mL),因素C 为接种量(1%、3%、5%),因素D 为培养温度(25℃、30℃、35℃)。极差分析结果为RA>RD>RB>RC,表明对菌株JK13 的菌体生长程度影响最大的因素为初始pH 值,其次为培养温度、装液量、接种量。菌株JK13 的最佳培养条件优化方案为A3B2C1D3,即初始pH 值为9.0,装液量为30 mL·100 mL-1,接种量为1%,培养温度为35℃。菌株JK13 在最佳优化方案下的菌液OD600值为1.059,其在未优化的普通培养条件下为0.672,增长幅度为57.56%。
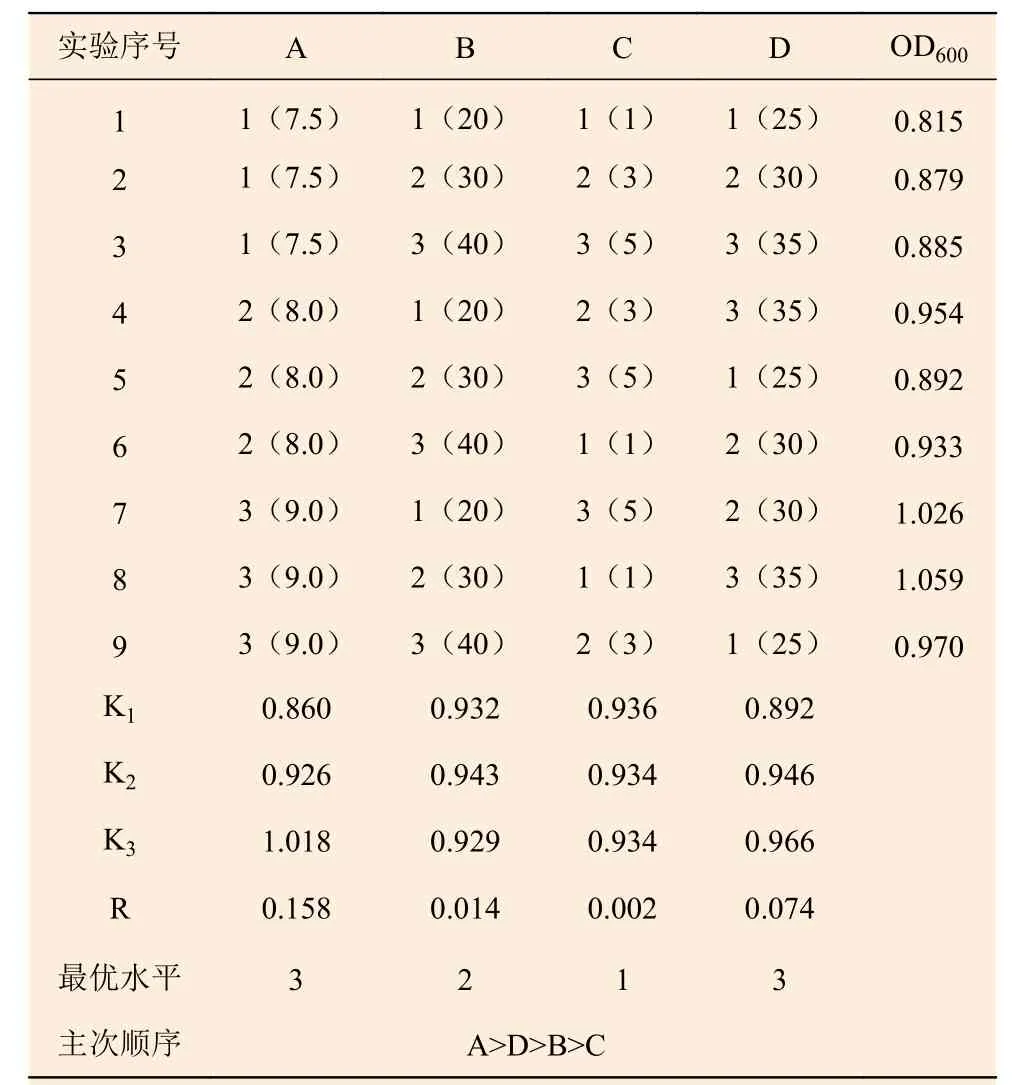
表2 菌株JK13 培养条件的正交试验结果Table 2 The results of orthogonal test on culture condition for strain JK13
3 讨论
现有研究表明,植物自身一般通过产生大量的ABA、水分再分配[33]、动态改变根系内部基因[34]等应对不同的逆境胁迫,植物共生微生物则基于以上自我修复起到辅助和协同作用[35],而微生物肥料的开发利用可以大大加速植物的逆境修复速度,为植物保持正常生理化学过程提供动力,发挥外在推动器的作用。
一般认为,生物的丰富的遗传多样性会为种间及种内个体间带来遗传分化与遗传差异,进而表现为生物培养特征的多样性。本实验从南方红壤区不同林龄杉木人工林下根际土壤筛选出的解钾菌菌落颜色具有多样性,呈现乳白色半透明、淡黄色,这与吴凡等[36]在桑树根际筛选出具有乳白色、淡黄色等颜色特征的解钾菌以及燕红等[37]在农田中筛选出呈乳白色的K-6-4 和呈淡黄色的K-1-1 的实验结果一致。但仅将菌落颜色作为解钾菌筛选的判断标准并不严谨,据此并不能十分准确分离得到具备解钾能力的菌株,如狄义宁[38]在甘蔗根部筛选出菌落颜色为黄白色的解钾菌,姜霁航等[39]在苹果根际筛选出的解钾菌呈灰色、不透明。换而言之,种类各异的高效解钾菌菌落颜色也各不相同,因此,利用菌落颜色特征筛选解钾菌还需借助测定速效钾含量来做进一步判断。
土壤空间异质性为微生物多样性提供了生境基础,二者存在显著正相关关系[40]。在不同类型土壤中生存的解钾菌无论是在数量还在种类上均存在差异[41],不同菌株的溶钾效果也存在差异。本实验在20 株解钾菌中筛选出13 株具解钾能力的菌株,最高效解钾菌JK13 发酵液可溶性钾含量为81.06 μg·mL-1。吕睿等[8]在猕猴桃园农田中筛选出高效解钾菌株JK3 的解钾量3.7 μg·mL-1,较空白对照组增加94.74%,解钾量显著低于本实验筛选出的JK13。闫雅楠等[9]在入侵植物加拿大一枝黄花(Solidago canadensisL.) 根际分离出的15 株菌株中,9 株具有解钾能力,最优解钾菌株H2-20 的解钾量为10.657 μg·mL-1,显著低于JK13。陈易等[10]在紫色土样中筛选出的XD-K-2 菌株发酵液可溶性钾含量为23.2 μg·mL-1。对比上述研究,本实验筛选出的解钾菌(81.06 μg·mL-1)具有显著解钾优势。此外,本实验所筛选出的不具备解钾能力的菌株占35%,而李海龙等[42]实验中不具解钾能力的菌株占70%,相关研究表明,微生物的解钾能力受土壤类型、钾矿类型及含量、土壤pH、土壤温度、环境中钾离子浓度、钾矿粉粒径大小等诸多因素的影响[43],因此,进一步分析以不同植物为研究对象筛选出的解钾菌的解钾能力差异的原因,对于今后工程菌的普适性具有重要的参考价值。
经16S rDNA 鉴定(见附图),JK13 为芽孢杆菌属(Bacillus altitudinis),而李海龙等[42]在秦岭山区筛选出的QL21、胡洲等[44]在不同作物根际筛选出的K1 和K3、任建国等[45]在太子参根际筛选出的ATS-2-5和KTS-2-4均亦属芽孢杆菌属,陈易等[10]在紫色土中筛选出的XD-K-2 为环状芽孢杆菌属(Bacillus circulanssp.),李新新等[46]筛选出的G4 为类芽孢杆菌属(Paenibacillussp.),上述实验结果证明芽孢杆菌属微生物在硅酸盐细菌中占据较大比例,同时其促生、增产作用效果具有显著优势[44]。但随着研究的深入与展开,解钾菌大多局限于芽孢杆菌属这一结论[47]被逐渐推翻,如张妙宜等[48]在蓖麻根际筛选出的MY-1 为嗜线虫赛雷氏菌(Serratia nematodiphila),陈丰宇等[49]在香蕉根际筛选出的1 株具解钾作用的放线菌为陕西链霉菌(Streptomyces shaanxiensis)。
现有研究认为解钾机制与产生有机酸、产胞外多糖、生物膜形成[50]以及低分子能量酸性物质产生[51]有关,但本实验中各菌株培养液pH 值同可溶性钾含量无显著性相关关系,这与党雯[52]得出的解钾能力强弱与pH 相关性不显著的结论一致,据此推测产酸并不是硅酸盐细菌发挥解钾效用的主要因素,菌株可能是以破坏钾矿石晶体构造、表面接触发生交换作用等方式溶解无效钾。谷付旗等[53]对菌株WS-FJ9 的研究则表明解钾能力由多因素决定,解钾菌通过分泌有机酸、氨基酸来溶解缓效钾或利用氨基酸、有机酸、胞外的荚膜多糖三者络合作用促使钾源分解。基于以上分析,本实验筛选出的高效解钾菌JK13 的具体解钾机制还有待结合苗期实验和分子手段进一步研究与验证。
4 结论
本实验基于亚历山大培养基筛选得到的高效解钾菌JK13 具有较强的的解钾能力,经16S rDNA鉴定为芽孢杆菌属。采用单因素实验与正交设计实验优化其培养基组分及培养条件,即0.5% 甘露醇、1.5% 酵母粉,初始pH 值为9,装液量为30 mL·100 mL-1,接种量为1%,培养温度为35℃。菌株的筛选和培养条件优化丰富了解钾微生物资源库,亦为林木附生功能菌的开发和利用提供了研究基础和数据支持。
附录

图 附图 JK13 菌株16S rDNA
