‘麦缘锦楸’叶色表型qRT-PCR 内参基因筛选及验证
2022-03-26杨英英赵林姣杨桂娟付鹏跃胡继文
杨英英,赵林姣,杨桂娟,张 玉,付鹏跃,4,胡继文,刘 莹,王 楠*
(1.三峡大学生物技术研究中心,湖北 宜昌 443002;2.林木遗传育种国家重点实验室,中国林业科学研究院林业研究所,国家林业和草原局林木培育重点实验室,楸树国家创新联盟,北京 100091;3.西南林业大学林学院,云南 昆明 650224;4.东北林业大学林木遗传育种国家重点实验室,黑龙江 哈尔滨 150040)
实时荧光定量PCR(qRT-PCR)是一种常见的检测基因表达水平的技术手段,它可以将常规PCR 和荧光检测技术相结合,实时监控PCR 扩增的过程[1],具有成本低、灵敏度高、特异性强等特点[2],被广泛应用于新基因挖掘及功能研究[3]。由于qRT-PCR 技术的检测结果受到样本、实验条件、RNA 质量及纯度、反转录效率等因素的影响[4],因此,想要获取准确度高的试验结果,就必须使用合适的内参基因进行校准[5]。
在大多数基因表达分析研究中,常选用能够维持细胞骨架或参与细胞基本生命过程的管家基因作为内参基因,如肌动蛋白基因(Actin)、α/β 微管蛋白基因(TUA/TUB)、3-磷酸甘油醛脱氢酶基因(GAPDH),多聚泛素酶基因(UBQ)以及18S核糖体RNA(18S)等[6]。然而,近年来有研究发现,这类管家基因的表达稳定性也会受到物种和组织差异的影响[7]。如在连翘叶片中UKN1的表达最稳定,但在花和花蕾中最稳定的基因是ACT和SDH[8];在茉莉不同器官(根、茎、叶及花)中筛选出的理想内参也存在差异[9]。此外,同一物种内参基因的选择也受不同胁迫条件的影响,如EXP1和PP2A在高盐胁迫后的北沙参中是最稳定的内参基因,而在MeJA 处理后CYP2和α-TUB是最稳定的内参基因[10]。杨树不同发育时期中筛选到的理想内参基因是U6-1、EIF4A和PP2A-2[11],而苏晓娟等发现,锌胁迫下杨树的actin、ubiquitin、EF1α和18S r RNA基因表达最为稳定[12],储文渊等发现,杨树在盐和干旱胁迫下,其新内参基因PtRG1,PtRG3和PtRG5比传统内参基因的表达更加稳定[13]。因此,内参基因并不具有通用性,在开展特定研究材料或实验条件的实时荧光定量分析前,首先应进行该物种特异性内参基因的筛选[14]。
灰楸(Catalpa fargesiiBur.)是紫葳科、梓属落叶乔木,是我国珍贵的用材树种和著名的园林观赏树种,素有“木王”之称。‘麦缘锦楸’是从灰楸实生苗选育出的新品种,其叶片呈现中间绿边缘黄的特征,目前已通过高干嫁接技术广泛应用于园林绿化等方面。课题组前期对‘麦缘锦楸’和灰楸的生理生化指标进行测定,发现不同颜色部位叶片的色素含量及叶绿素荧光参数存在显著差异[15]。想要进一步揭示该生理现象的分子机理,就需要分析‘麦缘锦楸’叶色形成途径中差异基因的表达模式[16],然而,目前尚未见梓树属对不同叶色表型筛选内参基因的相关报道,因此,开展‘麦缘锦楸’叶片内参基因的选择研究,以提高基因表达量的可靠性是十分必要的。本研究借助课题组前期的转录组数据,通过比较‘麦缘锦楸’和灰楸不同组织部位的基因表达量,初步筛选出表达相对稳定的6 个基因CfUBC、CfActin11、>CfPP2A、CfMADH、CfGADPH、CfEF-1以及本课题组常用的内参基因CbuActin[17],共7 个候选内参基因进行qRT-PCR 分析,利用GeNorm、NormFinder 和BestKeeper 等软件综合分析并筛选出‘麦缘锦楸’不同叶色中表达相对稳定的内参基因;接着以萜类合成相关基因(CfGES)进一步验证上述分析结果的可靠性。本研究将使‘麦缘锦楸’与灰楸叶片基因表达的标准化和定量化更加准确,并为后期开展‘麦缘锦楸’黄绿叶色分区形成的分子研究奠定基础。
1 材料与方法
1.1 试验材料
试验材料取自河南省洛阳市扁担赵基地。样品采集后,立即用刀片将‘麦缘锦楸’叶片黄绿部分切分,分别命名为Y1(黄色)、Y2(绿色),灰楸叶片对应部位分别命名为G1、G2(图1)。切好的叶片用锡箔纸包裹后立即置于液氮中速冻,并转至-80℃保存。所有的样品均设置3 次生物学重复。
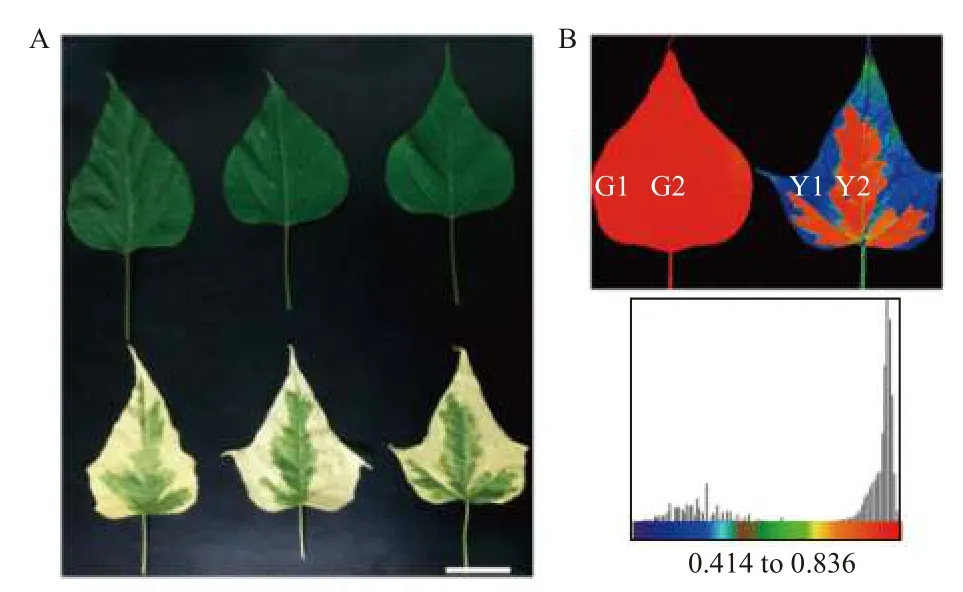
图1 灰楸及‘麦缘锦楸’叶片取样图[15]Fig.1 Samples of leaves of 'Maiyuanjinqiu' and C.fargesii.[15]
1.2 方法
1.2.1 RNA 提取与cDNA 合成 RNA 提取按照EASY spin 植物RNA 快速提取试剂盒(北京艾德莱生物科技有限公司)的操作说明进行。通过1%琼脂糖凝胶电泳检测RNA 样品的完整性,并利用超微量紫外分光光度计探头(Nanodrop 2000)检测所提取RNA 的浓度与纯度。利用PrimeScript™RT reagent Kit with gDNA Eraser 试剂盒(Takara,RR047A),将RNA 样品反转录为cDNA,获得的cDNA 样品置于-20℃保存备用。
1.2.2 候选内参基因的筛选 以课题组前期未发表的‘麦缘锦楸’和灰楸转录组数据为依据,选取FPKM 值大于100 且在样品间无显著差异表达的6 个基因(CfUBC、CfActin、CfPP2A、CfMADH、CfGADPH、CfEF-1)为候选基因,加上课题组前期常用的CbuActin[17]共7 个内参基因。
1.2.3 引物设计及特异性检测 根据引物设计原则,利用在线工具Primer 3 Plus 设计内参基因及CfGES基因引物,引物大小为18~27 bp,Tm 值在58~61℃,扩增长度为150~250 bp,GC 含量为40%~60%,并在NCBI 上对引物进行特异性检测。引物由北京擎科生物科技有限公司合成,引物序列见表1。以各候选基因引物做普通PCR 扩增,并用1%琼脂糖凝胶电泳检测。
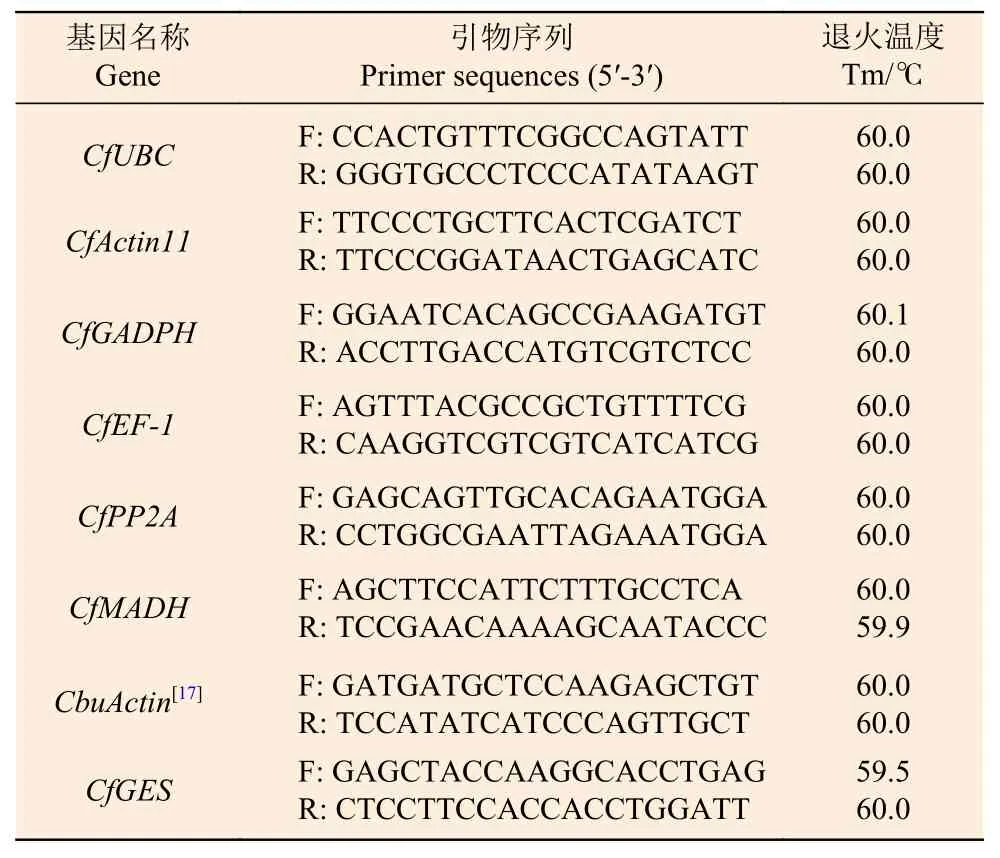
表1 内参基因及CfGES 基因的引物设计Table 1 Primer design for internal reference genes and CfGES gene
1.2.4 实时荧光定量PCR 将cDNA 模板混合稀释8 倍后,按照Takara 公司的TB Green Premix Ex Taq (Tli RNaseH Plus) 试剂盒(Takara,RR420A)说明书进行实时荧光定量PCR 实验。反应体系为20 μL:TB Green Premix Ex Taq 10 μL,上游引物(10 μmol·L-1)0.8 μL,下游引物(10 μmol·L-1)0.8 μL,DNA 模板1 μL,dd H2O 7.4 μL。每个样品设置3 个重复,所有操作均在冰上进行。利用LightCycler480 实时荧光定量PCR 仪对各样品进行扩增,PCR 扩增程序为:95℃预变性30 s;定量分析40 个循环:95℃ 变性5 s,60℃退火30 s;融解曲线:95℃ 5 s,60℃ 1 min 后缓慢上升至95℃;降温:50℃ 30 s。
1.2.5 数据处理和分析 将各样品得到的Ct值按公式Q=E(minCt-sampleCt)(E为扩增效率,默认值为2;minCt为基因在样品中的最小Ct值;sampleCt为基因在样品中的Ct值)进行计算,将得到的Q值导入GeNorm 和NormFinder 软件中进行稳定性分析。将各样品得到的Ct值输入到BestKeeper软件中,得到候选内参基因的表达稳定性(M值)、稳定值(SV 值)、变异系数(CV 值)和标准差(SD 值),进行表达稳定性分析。使用3 款软件分析后,将各样品得到的Ct值输入到在线网站RefFinder(https://www.heartcure.com.au/forresearchers/)中进行综合分析,得出最适合‘麦缘锦楸’不同叶色部位稳定表达的内参基因。
1.2.6 内参基因稳定性验证 分别以综合分析排名最靠前的2 个基因为内参,对萜类合成基因CfGES的表达情况进行分析,qRT-PCR 方法参照1.2.4,结合CfGES基因的转录组数据,对2 个内参基因进行表达稳定性验证。
2 结果与分析
2.1 RNA 提取与质量检测
Nanodrop 检测到所有样品总RNA 的OD260/280及OD260/230值均在1.8~2.2 之间,说明所提RNA纯度较好,1% 琼脂糖凝胶电泳检测RNA 样品完整性(图2),各样品的28S 和18S 条带明显,说明总RNA 完整性较好,均可用于后续试验。

图2 ‘麦缘锦楸’和灰楸不同叶色部位总RNA 电泳图Fig.2 Total RNA electrophoresis of different leaf color parts of 'Maiyuanjinqiu' and C.fargesii.
2.2 内参基因引物的特异性筛选
图3 显示:所有引物均能扩增出单一且亮的条带,无引物二聚体,条带大小与预期相符,引物特异性完好,可用于后续检测分析。对7 个候选内参基因在各个样品的qRT-PCR 分析表明:各基因Ct值均在23~35,且溶解曲线都呈现显著单一的峰(图4),表明qRT-PCR 所用引物可与模板cDNA特异性结合并扩增靶基因。
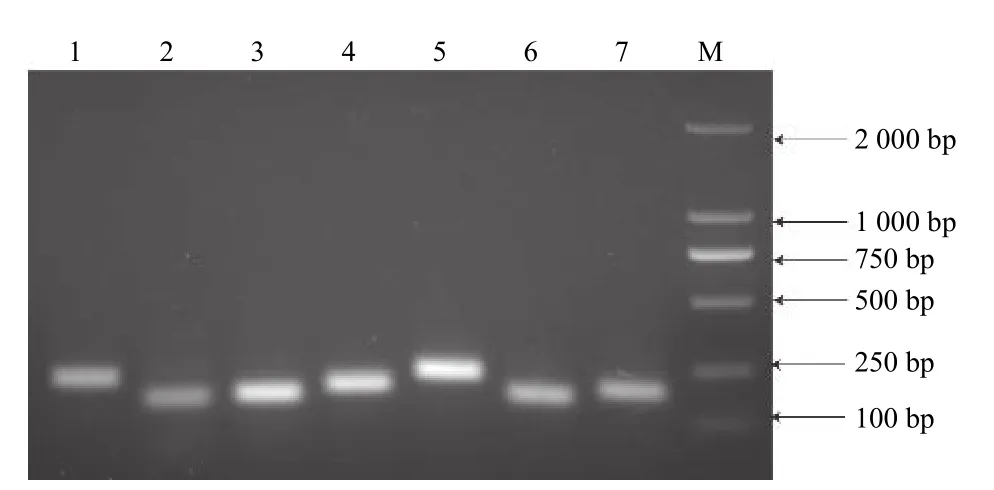
图3 7 种内参基因的PCR 扩增产物Fig.3 PCR products of seven reference genes.
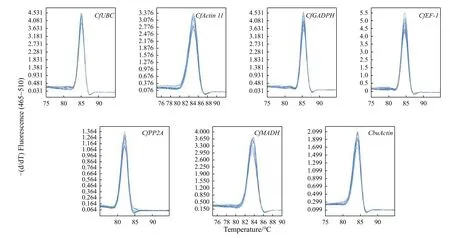
图4 7 个内参基因溶解曲线Fig.4 Real-time PCR melting curves of seven reference genes
2.3 内参基因稳定性分析
2.3.1 候选内参基因的表达丰度分析 7 个候选内参基因中,CfActin的平均Ct值最大,为26.459,说明该基因的表达丰度最低;CfGADPH的平均Ct值最小,为20.91,说明该基因的表达丰度最高。7 个内参基因的表达丰度大小排序依次是:CfGADPH > CbuActin > CfEF-1 > CfMADH> CfPP2A >CfUBC > CfActin(图5)。
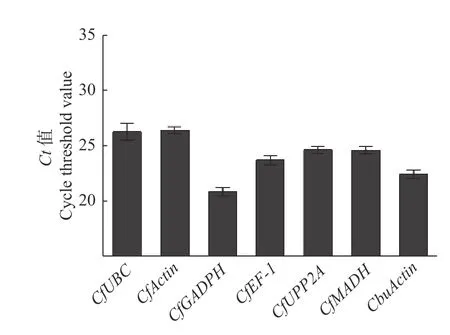
图5 7 个内参基因平均Ct 值Fig.5 Average Ct values of seven reference genes
2.3.2 GeNorm 分析 GeNorm 是通过比较计算内参基因稳定性的M 值,以确定表达最稳定的内参基因。该软件以M=1.5 作为临界点,低于该值表明基因的表达相对稳定,且M 值越小表示内参基因的表达越稳定[18]。GeNorm 分析结果表明:7 个候选内参基因的M 值均小于1.5(表2),即各候选内参的表达都相对稳定,稳定性排名从高到低依次是:CfMADH>CfEF-1>CfGADPH>CfPP2A>CfActin11>CfUBC >CbuActin。为确定内参基因的最佳数量,进一步通过配对变异系数Vn/ (n+1),得出以4 个候选基因同时做为内参基因的效果最佳,2 个组合使用次之(图6)。
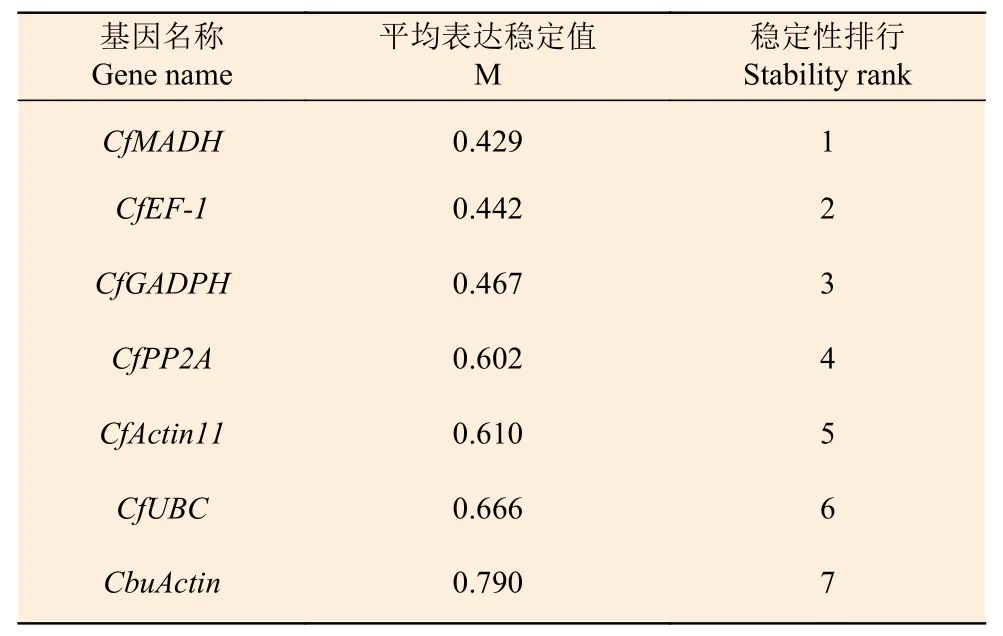
表2 GeNorm 软件分析下内参基因的表达稳定性Table 2 Analysis of the expression stability of reference genes in leaves by GeNorm

图6 GeNorm 软件分析最适合内参基因数目Fig.6 The number of the most suitable reference genes analyzed by GeNorm software
2.3.3 NormFinder 分析 NormFinder 的计算原理与GeNorm 相似,该软件是基于Excel 结合组间方差与组内方差计算SV 值,来确定内参基因的稳定性。SV 值的大小与基因的稳定性呈负相关。Norm-Finder 分析结果(表3)显示:CfUBC、CbuActin、CfActin11、CfPP2A、CfGADPH、CfEF-1、CfMADH基因在叶片不同颜色部位的表达稳定值分别为0.406、0.520、0.329、0.340、0.068、0.095、0.062,其中,CfMADH、CfEF-1和CfGADPH的SV 值最小,说明这3 个基因的稳定性较强。

表3 NormFinder 软件分析‘麦缘锦楸’及灰楸不同叶色部位内参基因的表达稳定性Table 3 Analysis of the expression stability of reference genes by NormFinder software
2.3.4 BestKeeper 分析 BestKeeper 通过计算变异系数(CV)和标准偏差(SD)来反映内参基因的稳定性,CV 和SD 的值与基因的稳定性负相关,其中,SD 值的默认阈值为1.0,低于该值即认为表达稳定[19]。BestKeeper 分析结果(表4)显示:在灰楸及‘麦缘锦楸’叶片中,7 个基因的SD 值均小于1.0,说明各基因的表达均较为稳定,并且稳定性从高到低排序依次是:CfActin11、CfMADH、CfGADPH、CfEF-1、CbuActin、CfPP2A、CfUBC,其中CfActin11的CV 和SD 值最小(CV=0.80;SD=0.21),表达最为稳定;CfUBC的CV 和SD 值最大(CV=2.35;SD=0.62),其表达最不稳定。
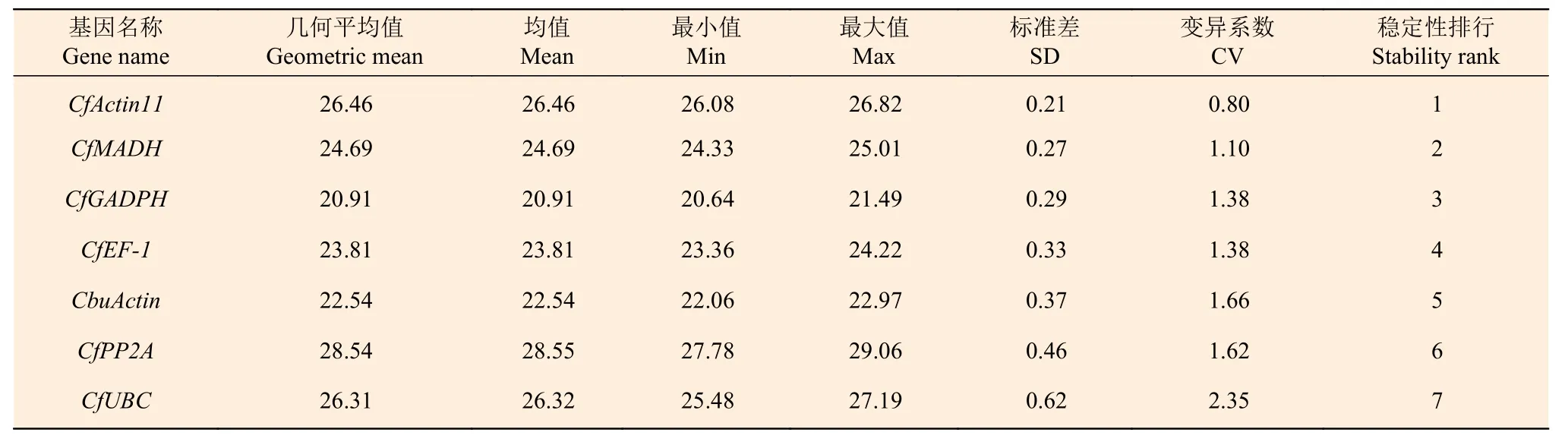
表4 BestKeeper 软件分析灰楸及‘麦缘锦楸’不同叶色部位内参基因的表达稳定性Table 4 BestKeeper software was used to analyze the expression stability of internal reference genes in different leaf color sectors of Maiyuanjinqiu and C.fargesii.
2.3.5 综合性分析 对GeNorm、NormFinder 以及BestKeeper 3 种软件的数据进行整合分析,综合评估基因的表达稳定性。将各基因在不同样品中的Ct值导入在线网站RefFinder(https://www.heartcure.com.au/for-researchers/)中。结果显示,各基因稳定性综合排名由高到低依次为CfMADH>CfEF-1>CfGADPH>CfActin11>CfPP2A>CfUBC>CbuActin(图7),其中,CfMADH和CfEF-1的表达稳定性最好,符合qRT-PCR 实验内参基因的选择标准。
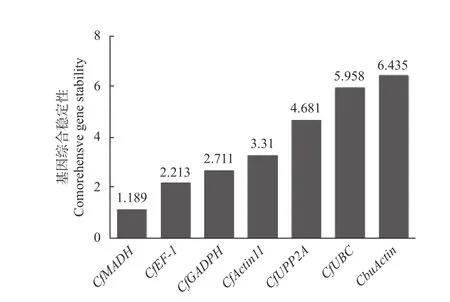
图7 RefFinder 分析7 个候选内参基因的稳定性综合排名Fig.7 Stability ranking of seven genes by RefFinder analysis
2.4 内参基因稳定性验证
分别以CfMADH和CfEF-1为内参,分析萜类合成酶基因CfGES在‘麦缘锦楸’和灰楸不同叶色部位(Y1、Y2、G1、G2)的表达量差异,以验证软件预测结果的可靠性。结果表明:单独或组合使用CfMADH及CfEF-1基因为内参时,CfGES基因的表达差异与转录组测序结果趋势一致(图8)。因此,本研究结果表明:单独使用CfMADH、CfEF-1基因或组合使用这2 个基因,能够准确校准‘麦缘锦楸’不同叶色部位的荧光定量结果。
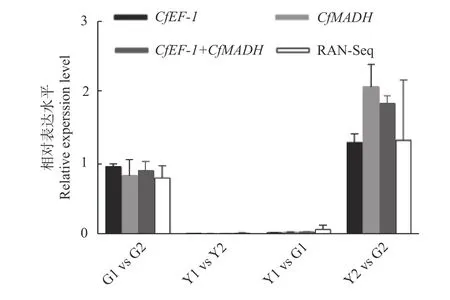
图8 CfGES 在‘麦缘锦楸’和灰楸不同叶色部位的基因表达量差异Fig.8 The expression differences of CfGES among different leaf color sectors of 'Maiyuanjinqiu'and C.fargesii .
3 讨论
基因表达分析是分子生物学科中最为重要的研究内容之一,qRT-PCR 是当前最常用的检测基因表达情况的技术手段,常用来检测基因在不同样品、组织、生长发育时期及特定实验条件下的表达模式[20]。对基因进行表达情况分析时,必须选择准确的内参基因做标准化分析[21-22]。众多研究中发现,管家基因可作为内参基因来进行表达量分析。然而近年来有研究发现,内参基因并不具有通用性,需要根据特定的物种或实验条件来确定最适宜的内参基因[23-24]。如GADPH在黄山栾树、银杏、肉桂和大叶清化桂中稳定表达[25-27],但在丝瓜和苎麻中却被认为是最不理想的内参基因[28-29]。18SrRNA基因在红豆杉多种处理下都表现出较好的稳定性[30],但在稻瘟病菌侵染的水稻、灵芝及红木不同处理下该基因的表达最不稳定[31-32]。目前尚未发现能在各类实验条件下都稳定表达的内参基因,所以研究者需要根据自己的实验条件找到可以作为标准化的基因进行定量分析。
GeNorm、NormFinder 和BestKeeper 是基因组研究中筛选稳定内参基因最常见的计算软件,本研究应用3 款软件及1 个分析网站对7 个候选内参基因的稳定性分析发现,这7 个内参基因在‘麦缘锦楸’和灰楸叶片中均稳定表达,但稳定性排名略有差异:在GeNorm 和NormFinder 中均得出CfMADH和CfEF-I是最稳定的内参基因,而在BestKeeper中CfMADH和CfEF-I的排名却分别居于第2 和第4名,排名的差异可能是由于3 款软件所设定的统计学算法不同所导致的。GeNorm 和NormFinder 的原理基本相似,都是将qRT-PCR 所得到的Ct值转化为基因相对表达量,再进行最适内参的分析,每个候选基因的稳定性取决于单个样品的最小Ct值;而BestKeeper 则直接在内置公式中输入各基因表达的Ct值来进行分析,候选基因的稳定性与每个样品Ct值的离散程度相关,因此,该算法易受极端值影响,无法规避系统误差[33-34]。考虑到每款软件的局限性,笔者利用RefFinder 对这3 款软件得出的结果进行综合分析,确定了7 个候选内参基因在‘麦缘锦楸’叶片中的稳定性排名依次是:CfMADH>CfEF-1>CfGADPH>CfActin11>CfPP2A>CfUBC>CbuActin。在GeNorm 分析的内参基因变异系数配对值来看,n=4 时,Vn/ (n+1)的比值最小,是最佳的内参基因组合数量,n=2 次之,但综合考虑实验成本及样品用量问题本文认为组合使用2 个候选基因作为内参更为合适,此前也有研究认为以2 个或2 个以上基因为内参更能校准定量分析实验上的系统偏差[35]。
萜类物质(叶绿素、胡萝卜素)在叶色形成过程中有重要的作用。在本课题组转录组数据中发现,萜类合成酶基因CfGES在‘麦缘锦楸’和灰楸不同叶色部位中差异表达,可以验证候选内参基因的稳定性。CbuActin是课题组前期利用同源克隆法获得的内参基因[17],在‘麦缘锦楸’和灰楸叶片中其M<1.5(M=0.790),符合作为内参基因的标准,但本研究通过软件分析排名最好的内参基因是CfMADH和CfEF-1。笔者分别以这2 个最适合的内参基因及其组合来校准CfGES的表达量,结果表明单独或组合使用CfMADH和CfEF-1时,CfGES的表达差异与转录组数据一致,进一步表明了本实验结果的可靠性。本研究所筛选到的最适内参基因CfMADH和CfEF-1均为真核生物中常见的管家基因,在其他观赏性树种(紫薇、花叶唐竹等)的不同叶色叶片中也被报道可作为理想内参基因[36-38]。此外,本研究材料中CfUBC和CfActin11在‘麦缘锦楸’叶片中稳定性不佳,但在其他物种(如景宁木兰、板栗)中却表现出很好的稳定性[39-40],这些结论也体现了内参基因不具有通用性的特点。
4 结论
本研究根据课题组前期研究及转录组数据筛选出7 个候选基因(CfUBC、CfActin11、CfPP2A、CfMADH、CfGADPH、CfEF-1及CbuActin),结合qRT-PCR 技术及GeNorm、NormFinder和BestKeeper等内参分析软件对各候选基因进行稳定性分析,结果表明CfMADH和CfEF-1是最适合‘麦缘锦楸’和灰楸不同叶色部位的内参基因,萜类合成基因CfGES验证了软件分析结果的可靠性。本研究优化了紫葳科植物‘麦缘锦楸’内参基因的选择,将为‘麦缘锦楸’叶色形成的分子生物学机制提供理论基础,也将为课题组及其它植物研究选择合适内参基因提供参考依据。
