基于转录组学比较研究甜高粱幼苗响应干旱和盐胁迫的生理特征
2022-03-26王志恒魏玉清赵延蓉王悦娟
王志恒,魏玉清,赵延蓉,王悦娟
(北方民族大学生物科学与工程学院,宁夏 银川 750021)
干旱和盐胁迫是限制植物生长发育和产量的两大非生物逆境,也是我国西北干旱和半干旱地区农业发展的主要障碍之一[1]。植物对盐分和干旱胁迫的响应机制是一个复杂的生物过程,植物会从生长发育、形态结构、生理生化、活性氧代谢、渗透调节、信号转导、基因的表达调控、次生代谢产物、膜运输和能量代谢等多个层次对胁迫做出响应[2-5]。以往植物耐盐性和抗旱性的研究主要在生态学、生理学、生物化学和分子生物学水平上进行。近年来大量与干旱和盐胁迫响应相关的基因和代谢途径已被发现,这些胁迫响应基因涉及光合作用(1,5-二磷酸核酮糖、磷酸烯醇式丙酮酸羧化酶、丙酮酸磷酸双激酶)、水分运输(水通道蛋白)、离子转运(质膜H+-ATP 酶)、细胞膜完整性(脯氨酸、甜菜碱、甘露醇)、植物激素(脱落酸、生长素、细胞分裂素、赤霉素)、清除自由基(超氧化物歧化酶、过氧化物酶、过氧化氢酶)以及其他蛋白质(转录因子、蛋白激酶)等,以不同的方式帮助植物抵御干旱和盐胁迫[6-8]。渗透调节和细胞壁相关基因的表达是玉米(Zea mays)幼苗耐旱性较强的主要原因[9],玉米幼苗通过上调表达清除活性氧的过氧化物酶、谷胱甘肽基转移酶、过氧化氢酶和超氧化物歧化酶基因增强了其耐盐性[10];高粱(Sorghum bicolor)的类黄酮生物合成代谢途径可能是其耐盐性强弱的重要原因之一[11-12],植物激素信号转导、碳代谢、苯丙素的生物合成在甜高粱(Sorghum dochna)幼苗抵御干旱胁迫中起到主要作用[13];盐胁迫下,甜高粱幼苗根系通过编码质膜ATPase 和液泡膜质子泵相关基因表达促进多余Na+的排出,并且清除活性氧的水通道蛋白和抗氧化剂基因也参与了盐胁迫下甜高粱幼苗根系的拒盐分子机制[14];可见通过研究植物对不同非生物胁迫的耐受性是挖掘植物抗逆相关基因的常用策略。
甜高粱属C4高光效植物,是普通粒用高粱的一个变种,具有抗逆性强、生长速度快、生物产量高等特点,作为饲料青贮后质地细软,适口性极好,有较高的饲用价值,在我国西北地区种植前景广阔[15-16]。目前对甜高粱的抗逆分子机制主要集中在抗旱或耐盐基因挖掘方面,对于比较分析甜高粱在干旱和盐胁迫下的生理变化和转录组测序分析方面研究较少。本研究以‘辽甜1 号’甜高粱为材料,通过测定中度干旱和盐胁迫下甜高粱幼苗光合气体交换参数、有机渗透调节物质、内源激素含量和抗氧化物酶活性变化,并采用RNA-seq 方法分析不同胁迫下的差异基因,比较其生物学功能及所参与的代谢途径,期望在生理生化和分子水平上揭示甜高粱适应干旱和盐胁迫的共同机制和不同机制,以期为甜高粱抗逆栽培和育种奠定研究基础,这对于发展甜高粱作为草食家畜的优质饲草具有重要意义。
1 材料与方法
1.1 试验材料
由辽宁省农业科学院提供‘辽甜1 号’甜高粱。
1.2 试验处理
本试验于2019 年7-9 月在北方民族大学植物逆境生理生态学实验室进行。采用盆栽试验方法,将种子用体积分数为10%的次氯酸钠溶液浸泡20 min,用无菌水冲洗7~8 次,直至干净无味,将种子移至装有等量石英砂(直径约为0.3 cm 左右)的塑料花盆中,每盆15 粒种子,后置于光照周期为光照12 h(25 ℃)/黑暗12 h(20 ℃)的室内智能人工气候箱(上海博讯,BIC800)内进行光照培养,培养过程中每周更换1 次Hoagland 营养液。待苗四周龄时,每盆定苗8 株,根据前期预实验结果,确定了10%的PEG-6000 和0.9%的NaCl 分别为甜高粱幼苗中度干旱和盐胁迫浓度,在本试验中共设置了3 个处理,分别为:1)对照(CK),正常施加Hoagland 营养液;2)干旱胁迫(drought,D),采用10%的PEG-6000 进行模拟中度干旱胁迫,将其与Hoagland 营养液混合后施加;3)盐胁迫(salt,S),采用0.9%的NaCl 进行模拟中度盐胁迫,将其与Hoagland 营养液混合后施加。在处理后的第2 天和第7 天,将甜高粱幼苗叶片包入锡箔纸,做好编号后用液氮速冻,贮存于-80 ℃超低温冰箱中,用于内源激素含量、有机渗透调节物质和抗氧化物酶活性测定。
1.3 光合气体交换参数
在试验处理第2 天和第7 天的9:00-11:00,选择甜高粱幼苗受光方向一致、大小相同的最上面完全展开叶,采用美国LI-COR 公司LI-6400XT 便携式光合作用测定系统进行净光合速率(net photosynthetic rate,Pn)、气孔导度(stomatal conductance,Gs)、胞间CO2浓度(intercellular CO2concentration,Ci)和蒸腾速率(transpiration rate,Tr)测定,设定温度为25 ℃,Flow 值为500 μmol·s-1,CO2为400 μmol·mol-1,光强为1000 μmol·mol-2·s-1,具体参考郝正刚[16]的方法,重复3 次。
1.4 内源激素含量的测定
脱落酸(abscisic acid,ABA)、生长素(auxin,IAA)、细胞分裂素(cytokinin,CTK)含量通过中国农业大学提供的酶联免疫吸附(enzyme linked immunosorbent assay,ELISA)试剂盒进行测定[17],重复3 次。
1.5 有机渗透调节物质含量的测定
使用北京索莱宝科技有限公司的试剂盒对可溶性糖和脯氨酸(proline,Pro)含量进行测定,采用考马斯亮蓝G-250 法测定可溶性蛋白含量,重复3 次。
1.6 抗氧化物酶活性的测定
采用氮蓝四唑光还原法测定超氧化物歧化酶(superoxide dismutase,SOD)活性;采用愈创木酚显色法测定过氧化物酶(peroxidase,POD)活性;采用紫外吸收比色法测定过氧化氢酶(catalase,CAT)活性;参考孙云[18]的方法测定抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活性;每个处理重复3 次。
1.7 转录组测序
在甜高粱幼苗处理第2 天和第7 天时,将新鲜叶片组织置入液氮中,送往上海美吉生物医药科技有限公司,采用TRIzol(Invitrogen)法提取样本中的总RNA,通过质量检测进入Illumina Novaseq 6000 平台进行测序,使用Illumina Truseq TM RNA sample prep Kit 方法进行文库构建,将质控后的原始数据,即过滤后数据(clean data,reads),与参考基因组(https://www.ncbi.nlm.nih.gov/genome/?term=sorghum)比对,获得用于后续转录本组装、表达量计算等的数据,同时对RNA-seq 的比对结果进行质量评估,转录组数据使用上海美吉生物医药科技有限公司自主研发的云平台进行分析。
1.8 差异基因的筛选
将样品处理两两比较得到差异表达基因(differentially expressed genes,DEGs),使用DEG-Seq 软件进行计算,使用FDR(false discover rate)作为筛选差异变量的评价指标体系矫正最后的P值,利用RSEM 得到的基因reads 数目数据开展差异表达计算DEGs,基因发生显著差异表达的筛选标准为:表达倍数≥2、P-value<0.05。
1.9 差异基因GO 和KEGG 富集分析
使用软件Goatools 进行GO 富集分析,使用方法为Fisher 精确检验,当经过校正的P值≤0.05 时,认为此GO功能存在显著富集情况。使用KOBAS(https://kobas.cbi.pku.edu.cn/home.do)进行KEGG 富集分析,计算原理同GO 富集分析,使用Fisher 精确检验进行计算,经过校正的P值以0.05 为阈值,满足此条件的KEGG 通路定义为在差异表达基因中显著富集的KEGG 通路。
1.10 实时荧光定量PCR 验证
随机挑选10 个差异基因,由上海美吉生物医药科技有限公司完成引物设计(表1)及合成,内参基因β-Actin,引物序列为:β-Actin-F AGATGGTGTCAGCCACACTG,β-Actin-R CGAGCTTCTCCTTCATGTCC,扩增体系:95 ℃3 min;95 ℃30 s,52 ℃30 s,72 ℃40 s,35 个循环。

表1 差异基因引物序列Table 1 Differential gene primer sequences
1.11 数据处理与分析
利用Microsoft Office Excel 2016 进行数据统计处理,GraphPad Prism 5.0 进行作图,结果以平均值±标准差表示。
2 结果与分析
2.1 干旱和盐胁迫下甜高粱幼苗叶片光合气体交换参数的变化
干旱和盐胁迫下,甜高粱幼苗叶片Pn显著下降,Gs和Tr也均低于CK,而Ci高于CK;Pn和Tr在CK 和干旱胁迫下随胁迫时间延长呈逐渐升高趋势,在盐胁迫下呈逐渐降低趋势;CK 处理的Gs随胁迫时间的延长呈升高趋势,干旱和盐胁迫下呈逐渐降低趋势;不同处理下的Ci随胁迫时间的延长呈降低趋势,其中盐胁迫下降低幅度最大(图1)。
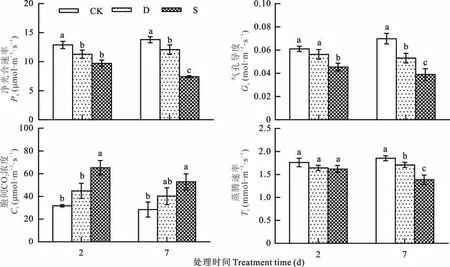
图1 干旱和盐胁迫下甜高粱幼苗叶片光合气体交换参数的变化Fig.1 Changes in leaf photosynthetic parameters of sweet sorghum seedlings under drought and salt stress
2.2 干旱和盐胁迫下甜高粱幼苗叶片内源激素含量的变化
干旱和盐胁迫下,甜高粱幼苗叶片ABA 含量均高于CK,其中盐胁迫下最高,IAA 和CTK 含量均低于CK,其中盐胁迫下均最低。ABA 含量在CK 和盐胁迫下随胁迫时间的延长呈降低趋势,干旱胁迫下呈升高趋势;IAA 含量在CK 处理下随胁迫时间的延长呈降低趋势,在干旱和盐胁迫下呈升高趋势;CTK 含量在CK 处理下随胁迫时间的延长呈升高趋势,在干旱和盐胁迫下呈降低趋势(图2)。

图2 干旱和盐胁迫下甜高粱幼苗叶片内源激素含量的变化Fig.2 Changes in leaf endogenous hormone content of sweet sorghum seedlings under drought and salt stress
2.3 干旱和盐胁迫下甜高粱幼苗叶片主要有机渗透调节物质含量的变化
干旱和盐胁迫下甜高粱幼苗叶片的可溶性糖、可溶性蛋白和Pro 含量均高于CK,并随胁迫时间延长呈逐渐升高趋势,其中干旱胁迫下可溶性糖含量显著高于CK 和盐胁迫,而可溶性蛋白和Pro 含量低于盐胁迫,说明甜高粱幼苗在干旱胁迫下可溶性糖是其主要渗透调节物质,而盐胁迫下可溶性蛋白和Pro 起主要渗透调节作用(图3)。
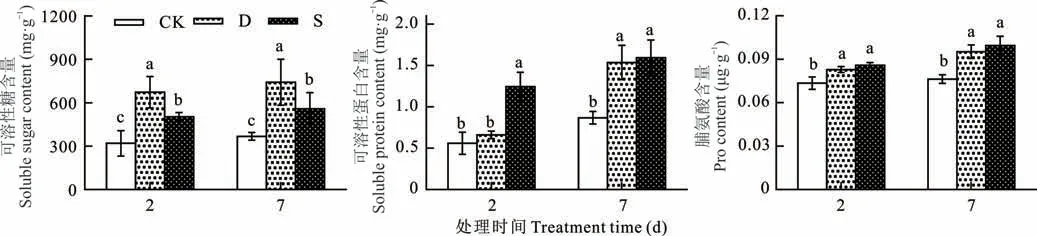
图3 干旱和盐胁迫下甜高粱幼苗叶片主要有机渗透调节物质含量的变化Fig.3 Changes in leaf osmotic adjustment substance content in sweet sorghum seedling under drought and salt stress
2.4 干旱和盐胁迫下甜高粱幼苗叶片抗氧化物酶活性的变化
干旱和盐胁迫下甜高粱幼苗叶片的SOD、POD、CAT 和APX 活性均高于CK,并随胁迫时间延长呈逐渐升高趋势,其中干旱胁迫下升高幅度低于盐胁迫,说明甜高粱幼苗在盐胁迫下活性氧产物多于干旱胁迫,因而抗氧化物酶活性较高,能够清除多余的活性氧产物,从而减轻对甜高粱幼苗的伤害(图4)。
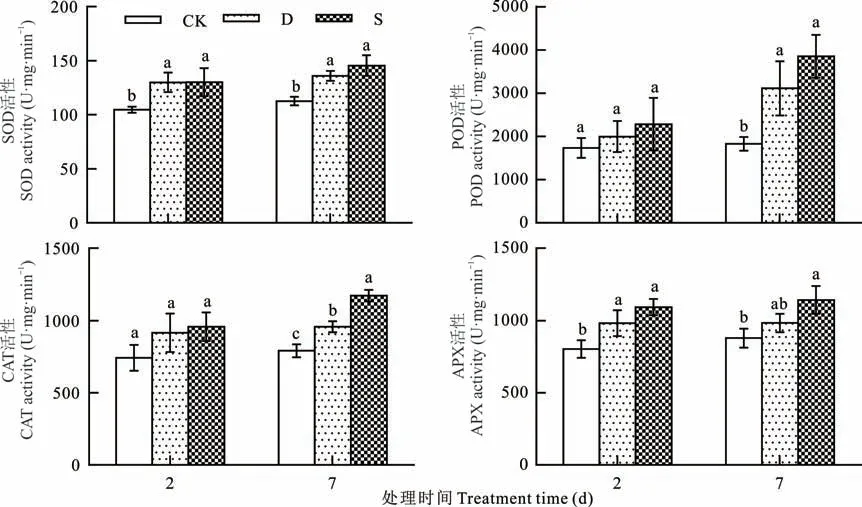
图4 干旱和盐胁迫下甜高粱幼苗叶片抗氧化物酶活性的变化Fig.4 Changes in leaf antioxidant enzyme activity of sweet sorghum seedlings under drought and salt stress
2.5 转录组测序数据评估
为了研究干旱和盐胁迫下甜高粱幼苗基因表达情况的变化,分别对CK、D、S 处理2 和7 d 时甜高粱幼苗叶片进行RNA-seq,RNA-seq 共建立18 个cDNA 文库,每个测序文库的原始测序数据见表2。18 个样品RNA-seq 过滤后数据为48330116~60983370,Q20值均超过98.29%,Q30值均超过94.98%,GC 含量为54.97%~57.72%,错误率不超过0.0226%,分别将各样品的clean reads 与指定的参考基因组进行序列比对,比对率为95.88%~96.78%,测得的数据准确度较高,数据质量好,利于后期数据的分析。
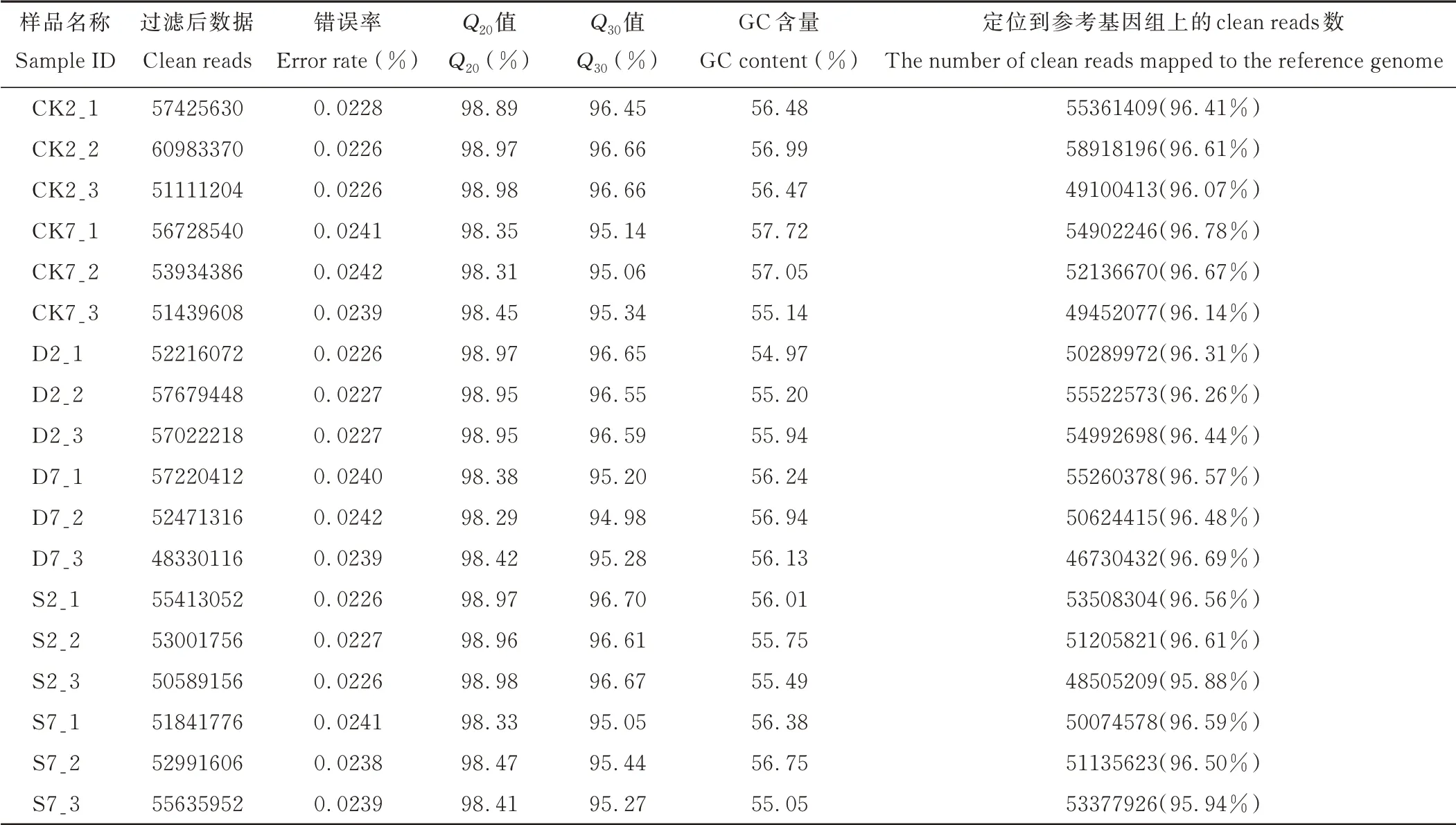
表2 样品测序和数据比对统计Table 2 Sample sequencing and data comparison statistics
2.6 差异基因筛选
干旱胁迫响应基因相关分析显示(图5),甜高粱幼苗在干旱胁迫2 d 时共有1897 个差异基因,包括922 个上调基因和975 个下调基因,干旱胁迫7 d 时共有211 个差异基因,其中包括157 个上调基因和54 个下调基因,CK 处理7 d 相比于2 d 产生861 个上调基因和556 个下调基因,在CK2_vs_D2 和CK7_vs_D7 两组两两比较的重叠差异基因CK2_vs_CK7 相比有40 个差异表达基因,称其为干旱胁迫响应基因。甜高粱幼苗在盐胁迫2 d 时共有3761个差异基因,包括2047 个上调基因和1714 个下调基因,盐胁迫7 d 时共有1517 个差异基因,其中包括795 个上调基因和722 个下调基因,在CK2_vs_S2 和CK7_vs_S7 两组两两比较的重叠差异基因CK2_vs_CK7 相比有493 个差异表达基因,称其为盐胁迫响应基因。
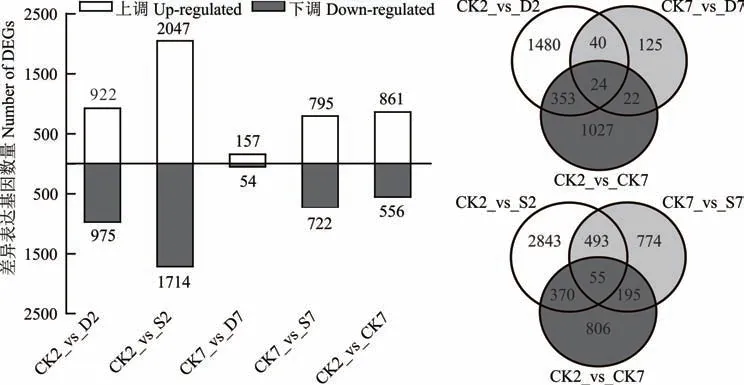
图5 差异表达基因统计和韦恩图Fig.5 DEG statistics graph and Venn diagram
2.7 GO 富集分析
干旱胁迫响应基因GO 富集分析结果表明(图6),在40 个干旱胁迫响应基因中共有31 个GO 条目显著富集,其中生物过程包括24 个,分子功能包括7 个;而细胞组分无显著富集的GO 条目,富集程度前10 的基因均分布在生物过程中,主要与胁迫响应相关。493 个盐胁迫响应基因GO 富集分析表明共有16 个GO 条目显著富集,生物过程包括15 个;分子功能包括1 个;而细胞组分无显著富集的GO 条目,富集程度前10 的基因均分布在生物过程中,主要与胁迫响应相关。在干旱和盐胁迫响应基因中,除了与干旱、盐胁迫相关的“对水的响应(response to water)”“对盐胁迫的响应(response to salt stress)”“对渗透胁迫的响应(response to osmotic stress)”等得到显著富集外,其他非生物逆境胁迫响应途径如:“对温度刺激的响应(response to temperature stimulus)”“对光强度的响应(response to light intensity)”“对热的响应(response to heat)”“对冷的响应(response to cold)”也在干旱或盐胁迫响应基因中显著富集,说明植物对不同的非生物逆境胁迫的响应是相互联系且交织在一起的,植物可能会利用同一种响应机制来抵御不同的非生物逆境胁迫。
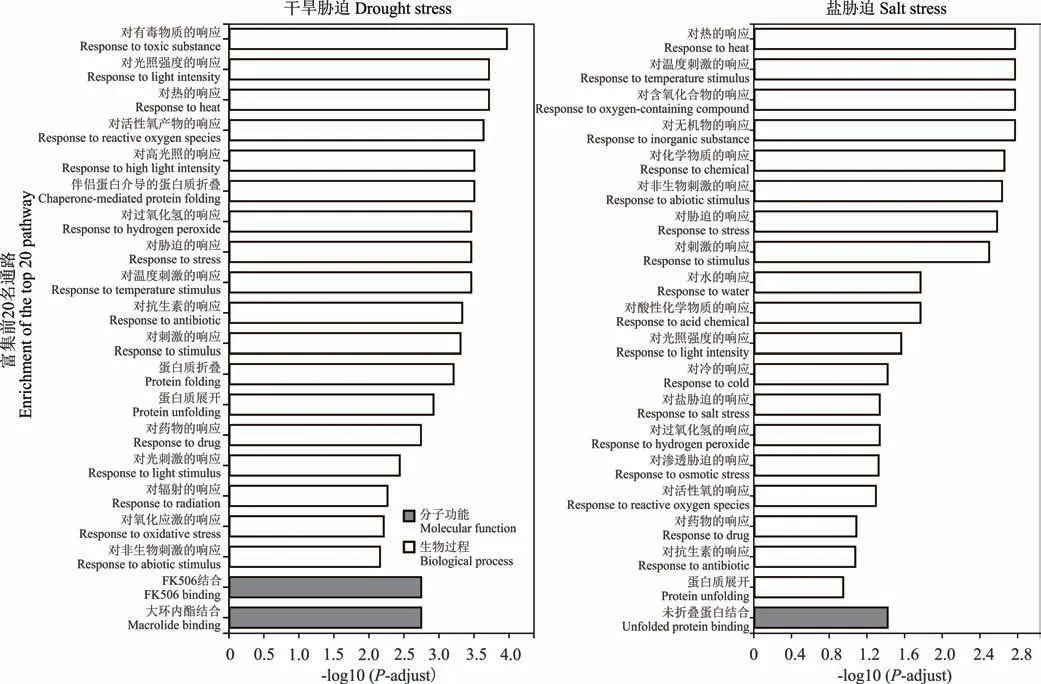
图6 干旱和盐胁迫响应差异基因GO 富集分析Fig.6 GO enrichment analysis of DEG in response to drought and salt stress
2.8 KEGG 富集分析
干旱胁迫响应基因进行KEGG 富集分析表明,有2 个代谢通路显著富集,分别为“内质网中的蛋白质加工(protein processing in endoplasmic reticulum)”和“剪接体(spliceosome)”,这2 个通路均属于“遗传信息加工”代谢通路(图7)。将盐胁迫响应基因进行KEGG 富集分析后只有1 个代谢通路显著富集(图7),为“植物激素信号转导(plant hormone signal transduction)”,这个通路属于“环境信息加工”代谢通路。表明甜高粱幼苗通过激活与干旱胁迫防御相关蛋白的表达和诱导参与碳水化合物代谢相关的基因表达来增强其渗透调节能力,维持细胞膨压来响应干旱胁迫;而通过植物激素信号转导来响应盐胁迫。
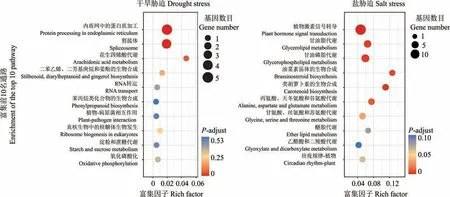
图7 干旱和盐胁迫响应差异基因KEGG 富集分析Fig.7 KEGG enrichment analysis of DEG in response to drought and salt stress
2.9 干旱和盐胁迫下的相关差异基因分析
根据RNA-seq 结果分析,甜高粱幼苗在干旱和盐胁迫下有23 个差异基因定位到光合作用代谢途径上,这些差异基因参与光系统I、光系统Ⅱ、细胞色素b6/f 复合体、光合电子传递链、ATP 酶、天线蛋白和碳同化(图8A)。注释导天线蛋白代谢通路的基因有Lhcb1、Lhcb2、Lhcb3、Lhcb4和Lhcb5;定位到光系统I 的基因有Psa D、Psa E、Psa O、Psa N、Psa G、Psa L、Psa F和Psa H;编码光系统Ⅱ的基因主要有Psb P和Psb Y;参与光合电子传递途径的差异表达基因主要有Pet E;编码细胞色素b6/f 复合体的为Pet C;编码ATP 酶的基因主要有delta和b;各有1个 基 因 编 码 核 酮 糖-1,5- 二 磷 酸(ribulose-1,5-diphosphate,RuBP)、磷 酸 烯 醇 式 丙 酮 酸 羧 化 酶(phosphoenolpyruvate carboxylase,PEPC)、丙酮酸磷酸二 激酶(pyruvate orthophosphate dikinase,PPDK)和NADP-苹果酸酶(NADP-malic enzyme,NADP-ME)。除了PEPC 外,其余注释到光合作用上的基因整体表现为盐胁迫下调幅度明显高于干旱胁迫(图2),干旱胁迫2 d 时大多数基因呈下调状态,而在7 d 时则呈上调状态,不过上调的幅度不如CK;PEPC 在干旱和盐胁迫2 d 时基因下调,盐胁迫基因下调倍数高于干旱胁迫,在处理7 d 时胁迫下PEPC 呈上调状态,盐胁迫下基因上调倍数最大。
海藻糖合成酶(trehalose synthase,TPS)能够催化UDP-葡萄糖转化为海藻糖-6-磷酸(trehalose-6-phosphate,T6P),在这个重要代谢通路中,干旱胁迫下甜高粱幼苗可能合成了大量的海藻糖(图8B),胁迫2 和7 d 时4 个编码TPS 的基因均全部上调表达;而盐胁迫2 d 时3 个上调表达,1 个下调表达,7 d 时4 个均下调表达;在另一个关键通路T6P 被TPP 或者TPS 转化为海藻糖的反应中,在干旱和盐胁迫2 d 时均下调表达,7 d 时均上调表达,其中干旱胁迫下的上调幅度高于盐胁迫。蔗糖也是常见的渗透调节物质之一,蔗糖合成酶(sucrose synthase,SUS)基因在干旱和盐胁迫2 d 时均上调表达,7 d 时盐胁迫上调表达,干旱胁迫下调表达,蔗糖-磷酸合成酶(sucrose phosphate synthetase,SPS)的2 个基因在干旱胁迫2 和7 d 的均上调表达,而盐胁迫只有一个上调表达;在淀粉降解的相关代谢通路中,编码α-葡聚糖磷酸化酶(α-glucan phosphorylase,glgP)和β-淀粉酶(βamylase,BAM)各有2 个基因,glgP 和BAM 基因在盐胁迫下出现明显上调现象,而干旱胁迫下大多为下调表达,表明盐胁迫下淀粉的降解可能被加强。
参与活性氧清除的相关抗氧化物酶在植物抗逆性中起到重要作用,有2 个编码SOD 基因和1 个编码POD 基因在胁迫下均上调表达(图8),其中编码SOD 基因的1 个基因注释到Cu-Zn 家族超氧化物歧化酶,1 个基因注释到Cu-Mn 家族超氧化物歧化酶,编码POD 基因的为POD-2C,编码CAT 基因的为CAT-2和CAT-3,编码APX的 基 因 为APX-1和APX-2,盐 胁 迫 下 编 码SOD 的2 个 基 因、POD 的1 个 基 因、CAT 的2 个 基 因 和APX 的2 个 基因上调幅度均高于干旱胁迫,相比于胁迫处理2 d,盐胁迫处理7 d 时基因上调幅度明显大于干旱胁迫,这一结果与抗氧化物酶活性的变化相符合。
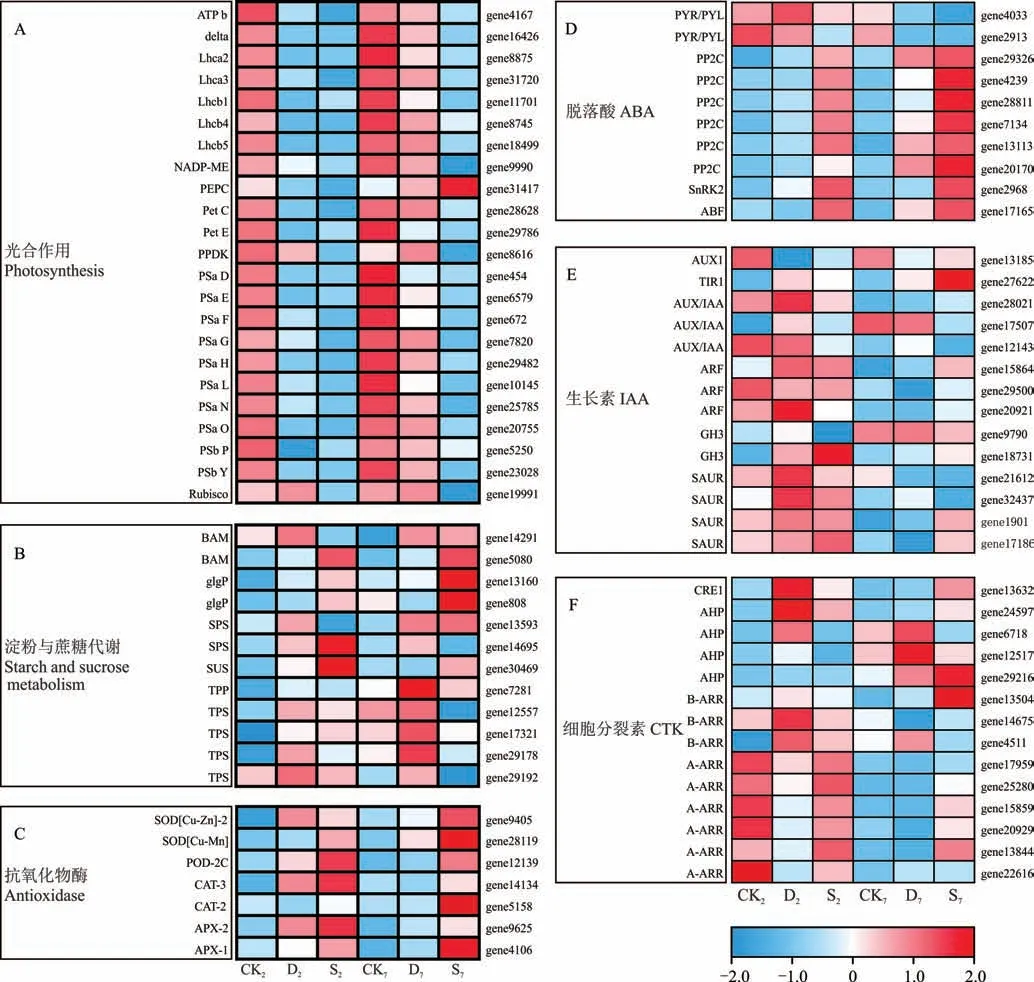
图8 干旱和盐胁迫下的相关差异基因表达水平值热图Fig.8 Heat map of elated DEGs expression levels under drought and salt stress
植物激素信号转导在植物对逆境胁迫的响应过程中起到至关重要的作用。根据RNA-seq 结果(图8D~F),在ABA 信号转导中,有2 个基因注释到受体pyrabactin resistant/PYR-like(PYR/PYL)中,有6 个基因注释到负调控因子2C 类蛋白磷酸酶(type 2C protein phosphates,PP2C)反应元件中,各有一个基因注释到SNF1 相关的蛋白激酶2(SNF1-related protein kinase 2,SnRK2)和结合因子(ABRE binding factors,ABF)中;在注释到IAA 信号转导的14 个基因中,其中2 个基因注释到gretchen Hagen3(GH3)中,有4 个基因注释到small auxin-up RNA(SAUR)中,1 个基因注释到auxin resistant 1(AUX1)上,1 个基因注释到transport inhibitor response 1(TIR1)上,3个基因注释到ARF 上,3 个基因注释到auxin resistant 1/like aux 1(AUX/IAA)上;在注释到CTK 信号转导的14个基因中,其中1 个基因注释到cytokinin response 1(CRE1)中,4 个 基 因 注 释 到arabidopsis histidinephosphotransfer proteins(AHP)中,3 个基因注释到Barabidopsis response regulators(B-ARR)中,6 个基因注释到A-arabidopsis response regulators(A-ARR)中;注释到植物激素信号通路的这些同源基因在不同处理中表达模式不同。
2.10 实时荧光定量PCR 验证
为了进一步验证RNA-seq 数据的准确性,随机挑选10 个基因进行实时荧光定量PCR 的验证,验证基因的表达水平以2-△△CT方法计算。结果表明:通过RNAseq 确定的大多数基因的表达模式与qRT-PCR 所确定的相似,大多数RNA-seq 结果与qRT-PCR 结果显著相关,相关系数为0.9193,P<0.0001(图9)。这些数据表明,RNA-seq 数据与本试验中qRT-PCR 分析所确定的表达模式具有很好的一致性。
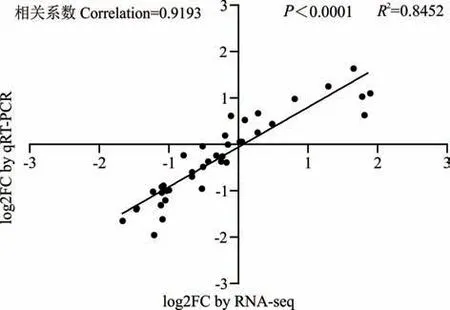
图9 实时荧光定量PCR 验证RNA-seq 数据Fig. 9 Real-time fluorescence quantitative PCR validation RNA-seq data
3 讨论
植物响应干旱和盐胁迫既有相同的机制也有不同的机制,基因作为植物应答环境胁迫的早期响应分子,对调控植物应对胁迫条件并逐渐适应起到关键作用,随着组学技术的迅速发展,RNA-seq 在高粱抗逆性研究中得到广泛应用[12-14,19-21]。本研究发现干旱和盐胁迫2 d 时甜高粱差异基因数目分别是7 d 时的9.0 和2.5 倍,盐胁迫2 和7 d 时差异基因数目是干旱胁迫的2.0 和7.2 倍,这表明甜高粱幼苗在胁迫2 d 时调动大量基因和生物学过程以响应胁迫,随着胁迫时间的增加,干旱胁迫下差异基因的数量大幅度减少,并显著高于盐胁迫,说明甜高粱幼苗响应干旱胁迫的生物学过程达到一个相对稳定的状态,而其对盐胁迫的响应还没达到稳定状态,说明甜高粱在转录水平上对盐胁迫的适应稳态落后于干旱胁迫。
基于GO 富集分析发现甜高粱在干旱和盐处理下差异基因显著富集于响应逆境胁迫调控;基于KEGG 富集分析发现甜高粱干旱胁迫响应基因显著富集在内质网加工和剪接体上,内质网是调节蛋白质合成和折叠加工的场所,植物在非生物胁迫条件下会诱导内质网胁迫,剪接体变化能够影响胁迫环境中植物mRNA 的稳定性。盐胁迫响应基因显著富集于植物激素信号转导途径,说明甜高粱响应盐胁迫的分子机制与激素信号转导通路有关。甜高粱幼苗在响应干旱胁迫过程中能够诱导参与碳水化合物代谢、次级代谢以及RNA 转运相关的基因表达;激活与干旱胁迫防御和解毒相关蛋白的表达,有效维持蛋白加工和降解的平衡,同时增强了跨膜转运离子,电子和蛋白以及细胞壁调节能力;有效地促进关键代谢物的合成代谢途径(淀粉与蔗糖代谢和苯丙烷类生物合成),提高渗透调节能力和细胞膜稳定性,从而更好地抵御干旱胁迫。而盐胁迫下甜高粱幼苗通过调节植物激素提升植物抗氧化能力和减少细胞膜脂过氧化程度,植物激素作为重要的次级信号分子,可以激活抗氧化物酶基因的表达,从而提高抗氧化物酶活性,增强活性氧的清除能力[22]。
光合作用是植物生长发育和产量形成的重要生理过程,光合作用大多数能量来源于原初反应中捕光天线复合体(1ight harvesting complex,LHC)所吸收的光能,LHC 包括大部分叶绿素a 和全部叶绿素b 及类胡萝卜素[23-24]。本研究中,有5 个基因注释到光合作用-天线蛋白上,并且在胁迫条件下均呈下调表达,在盐胁迫下这些基因的下调幅度高于干旱胁迫,这可能是由于为了维持盐胁迫下细胞的生理生化活动,LHC 多个基因下调表达,从而降低光合速率适应胁迫环境,并且伤害越高基因下调倍数越大。RuBP、PEPC、PPDK 和NADP-ME 是碳同化过程的关键酶,大量研究发现C4植物在非生物胁迫下PEPC 活性增加,说明PEPC 的高表达可能有助于减缓胁迫引起的光合速率下降[25]。在本研究中,干旱和盐胁迫下编码RuBP 的基因呈下调状态,但不同胁迫下基因的变化情况不同,总的来说随着胁迫时间的延长,干旱胁迫编码RuBP 的基因下调幅度缩小,而盐胁迫的下调幅度增大,编码PEPC 的基因在胁迫7 d 时呈上调变化,并且盐胁迫下上调倍数最大,这些都表明干旱和盐胁迫抑制了甜高粱幼苗的光合作用,并且盐胁迫的抑制程度要高于干旱胁迫,这与光合生理参数的变化是相符合的。
植物内源激素作为信号分子参与调节植物生长发育过程,其含量变化在植物响应非生物胁迫中发挥重要作用[26]。当受到外界环境胁迫时,植物会产生大量的ABA,触发ABA 诱导的下游生理过程[27]。在本研究中,干旱和盐胁迫下甜高粱幼苗叶片ABA 含量和编码ABA 信号通路基因的表达不尽相同,胁迫2 d 时,干旱胁迫下叶片ABA 含量变化不显著,盐胁迫下ABA 含量显著高于干旱胁迫和CK,CK 和干旱胁迫下编码ABA 受体PYR/PYL、PP2C、ABF 和SnRK2 基因表达模式基本相同,而盐胁迫下的编码基因表达模式与CK 和干旱胁迫相反;胁迫7 d 时,干旱和盐胁迫下叶片ABA 含量均显著升高,其中盐胁迫下ABA 含量显著高于CK 和干旱胁迫,干旱胁迫 下 编 码ABA 受 体PYR/PYL、SnRK2 和1 个PP2C 基 因 下 调 表 达,4 个 编 码PP2C 和1 个 编 码ABF 的 基 因 上 调表达,盐胁迫下编码ABA 受体PYR/PYL 基因下调表达,编码PP2C、SnRK2 和ABF 基因均上调表达,CK 编码ABA 信号通路的基因表达模式与盐胁迫刚好相反;这可能是由于盐胁迫早期,甜高粱通过上调ABA 合成基因NCED来促进ABA 的合成,从而减少气孔导度和降低蒸腾速率来提高甜高粱幼苗的耐盐能力。随着胁迫时间的延长,甜高粱幼苗体内的ABA 积累过量,为了减少ABA 过量对其带来的不利影响,甜高粱幼苗会通过激活ABA的负反馈调节机制来减少ABA 含量,当ABA 积累过量,会抑制ABA 受体蛋白PYR/PYL 基因表达,减少ABA与ABA 受体蛋白PYR/PYL 结合,PYR/PYL 不能与PP2C 互作,但PP2C 能与去磷酸化的SnRK2 结合,使SnRK2 处于失活状态,无法磷酸化激活下游途径,抑制下游ABA 应答基因调控网络,从而减少ABA 的合成;因此推测甜高粱幼苗可能依赖植物激素ABA 相关调控来应答盐胁迫,与盐胁迫相比,干旱胁迫下基因的变化情况表现出不利于ABA 信号的转导。
可溶性糖是植物应对干旱胁迫的主要有机渗透调节物质之一,具有维持渗透平衡和增强植物吸水的能力[28]。其中的海藻糖具有保护生物细胞、生物活性物质以及在胁迫中可以稳定细胞膜结构和蛋白质的功能[29]。研究发现在干旱胁迫下木薯(Manihot esculenta)[28]、牛心朴子(Cynanchum komarovii)[30]、玉米[31]中的海藻糖起到主要渗透调节作用,Li 等[29]将OsTPS1导入到水稻(Oryza sativa)中,发现转基因水稻的海藻糖含量显著升高,从而提高转基因水稻的抗逆性;Han 等[32]研究发现木薯叶片海藻糖含量与叶片持水能力呈正相关;项阳等[31]将酵母TPS1基因转入玉米,干旱胁迫下转基因玉米的根系生长情况和根系活力较野生型极显著增加;以上结果均表明海藻糖合成相关基因的表达以及海藻糖的积累能够提高植物的抗逆性。本研究中,在TPS 能够催化UDP-葡萄糖转化为T6P 这个重要代谢通路中,干旱胁迫上调的基因数目多于盐胁迫,在下一个关键通路T6P 被TPP 或者TPS 转化为海藻糖,基因上调表达的幅度在干旱胁迫下最高,同时生理数据也表明,干旱胁迫下甜高粱幼苗叶片的可溶性糖含量均显著高于CK 和盐胁迫,这表明糖代谢及其平衡在响应干旱胁迫中发挥重要作用,海藻糖等可溶性糖含量的大量增加增强了干旱胁迫下甜高粱幼苗的渗透调节能力。
逆境胁迫会导致植物细胞内活性氧的过量积累,过量的活性氧能启动质膜过氧化连锁反应,从而对细胞膜系统造成伤害,为了避免活性氧产物的过多积累,植物体内会产生SOD、POD、CAT 和APX 等抗氧化物酶清除多余活性氧产物,减轻对植物的伤害[33-34]。在本研究中,干旱和盐胁迫下甜高粱幼苗叶片抗氧化物酶活性均升高,尤其是在盐胁迫7 d 时叶片抗氧化物酶活性显著高于CK,预示此时盐胁迫已经导致甜高粱幼苗体内生理失调并积累大量活性氧产物,从而产生次级氧化胁迫,为了维持正常生理代谢活动,盐胁迫下甜高粱幼苗通过更高的抗氧化物系统活性来清除多余活性氧产物,而在干旱胁迫下甜高粱幼苗叶片的抗氧化物酶活性均低于盐胁迫,说明干旱胁迫对甜高粱幼苗造成的氧化胁迫低于盐胁迫。进一步从转录水平来看,编码抗氧化物酶的基因变化情况基本与酶活性变化表现一致,同时盐胁迫下编码抗氧化物酶的基因表达、抗氧化物酶活性变化与ABA 含量表现一致,表明胁迫下植物的ABA 与抗氧化物酶活性关系密切,这与Guo 等[35]关于ABA 可诱导相关抗氧化物酶基因的表达,提高抗氧化物酶活性的研究结论相吻合。盐胁迫下甜高粱幼苗通过植物激素ABA 胁迫信号转导来激活抗氧化物酶基因表达,提高抗氧化物酶活性,这些抗氧化物酶活性的变化和植物激素信号转导的调控共同构成甜高粱幼苗抵御盐胁迫的机制和策略。
4 结论
中度干旱和盐胁迫下,甜高粱幼苗的生物过程具有共同的调控途径,包括:下调光合气体交换参数、积累有机渗透调节物质、增强抗氧化物酶活性以及调节ABA 等植物激素帮助甜高粱适应逆境胁迫;不同的机制包括:其在转录水平上对盐胁迫的适应稳态落后于干旱胁迫,中度胁迫下甜高粱幼苗对盐胁迫的耐受性要低于干旱胁迫,可溶性糖在甜高粱幼苗抵御干旱胁迫中发挥重要作用,植物激素信号转导和抗氧化物酶活性变化的共同调控是甜高粱幼苗对抗盐胁迫的关键。
