烟草白粉病抗性基因型的多重PCR 检测体系及其在回交育种中的应用
2022-03-25林世锋王仁刚王自力任学良龙明锦史跃伟
林世锋,王仁刚*,潘 飞,王自力,任学良,龙明锦,史跃伟
1. 贵州省烟草科学研究院 烟草行业烟草分子遗传重点实验室,贵阳市观山湖区龙滩坝路29 号 550081
2. 上海农科种子种苗有限公司,上海市闵行区北翟路2901 号 201106
烟草白粉病是烟草生产中的主要病害之一,该病害发生普遍,给烤烟生产造成了严重的经济损失[1]。目前,生产上对烟草白粉病的防治以化学防治为主,不仅需要相应的人力、物力投入,还会带来烟叶农残超标、环境污染等问题[2]。阐明烟草白粉病抗性机制,开展抗病育种,从遗传本质上提高烟草对白粉病的抗性是防治烟草白粉病最经济、最有效且对人畜安全的方法。
Mildew resistance locus O(MLO)蛋白是植物特有的一类蛋白家族,其中的部分成员是白粉病菌成功侵染寄主植物的必要因子[3]。一个或多个MLO基因功能的缺失突变可导致植物对白粉病菌广谱且持久的抗性[4-7]。已知抗白粉病烟草品种Kutsaga E1和Tsukuba 1 的白粉病抗性来源于烟草品种Kokubu、Fujimura 等[8],通过对烟草品种 Kokubu 的白粉病抗性分子机制研究发现,NtMLO1 和NtMLO2 基因均为烟草白粉病隐性抗病基因(感白粉病基因),来源于Kokubu 的白粉病抗性是由NtMLO1 和NtMLO2 基因的隐性突变所致。
为开发相应的分子标记以辅助烟草白粉病抗病育种,张孝廉等[9-10]根据烟草白粉病抗感品种间NtMLO1 和NtMLO2 基因序列差异设计引物,构建了4 个单基因PCR 体系分别用于扩增野生型和突变型NtMLO1 和NtMLO2 基因。基于该研究,设计和组合引物并优化PCR 反应体系和反应条件,旨在建立一种用于检测NtMLO1 和NtMLO2 基因型的多重PCR方法,为烟草白粉病抗病育种回交后代基因型筛选提供可靠的技术手段。
1 材料与方法
1.1 试验材料
抗白粉病烤烟品种Kutsaga E1和感白粉病烤烟品种K326、红花大金元和云烟87均由贵州省烟草科学研究院新品种选育三组鉴定和提供。分别以K326、红花大金元和云烟87 为母本,以Kutsaga E1作为父本进行杂交获得各自的F1代,其中K326 和Kutsaga E1 的F1代再通过自交或回交(以K326 为父本)产生F2代及回交世代,用于抗谱鉴定和标记分析。
1.2 方法
1.2.1 白粉病菌人工接种
接种鉴定病原菌为烟草白粉病致病菌二孢白粉菌(Erysiphe cichoracearum DC),由贵州省烟草科学研究院新品种选育三组分离和保存。苗期采用抖落法[11-12]接种白粉病菌。
1.2.2 烟草基因组DNA的提取
剪取约100 mg 烟叶置于2 mL 离心管中,于55 ℃干燥箱中干燥24 h。使用SPEX Geno/Grinder 2010 高通量动植物组织研磨机(美国SPEX SamplePrep 公司)将干燥后烟叶振荡研磨成细粉状后,一次性加入520.9 μL 新鲜配制的裂解缓冲液(350 μL PBS、0.9 μL RNase A、150 μL Buffer C-L、20 μL Proteinase K)裂解细胞。使用AxyPrep 基因组DNA小量制备试剂盒(美国Axygen公司)提取烟草品种基因组DNA。使用NanoDrop 1000超微量分光光度计(美国Thermo 公司)测定样品DNA 浓度,将样品DNA的浓度稀释至80 ng/μL备用。
1.2.3 引物设计
分析烟草白粉病隐性抗病基因NtMLO1(M1)和NtMLO2(M2)的野生型和突变型基因序列(图1)[8],相比感病品种,抗病品种NtMLO1 基因内含子7 的3′端2个碱基AG突变为TA,且抗病品种NtMLO2基因内含子6 的5′端2 个碱基AG 发生缺失。通过中国烟草基因组数据库BLAST 工具进行相似性搜索与序列比对(Blastn),综合考虑M1和M2基因突变位点及其上下游序列特征,设计多对备选引物。经实验比对,筛选4 对特异性引物,组成2 个多重PCR 反应体系,分别用于扩增M1 和M2 野生型和突变型等位基因(表1)。
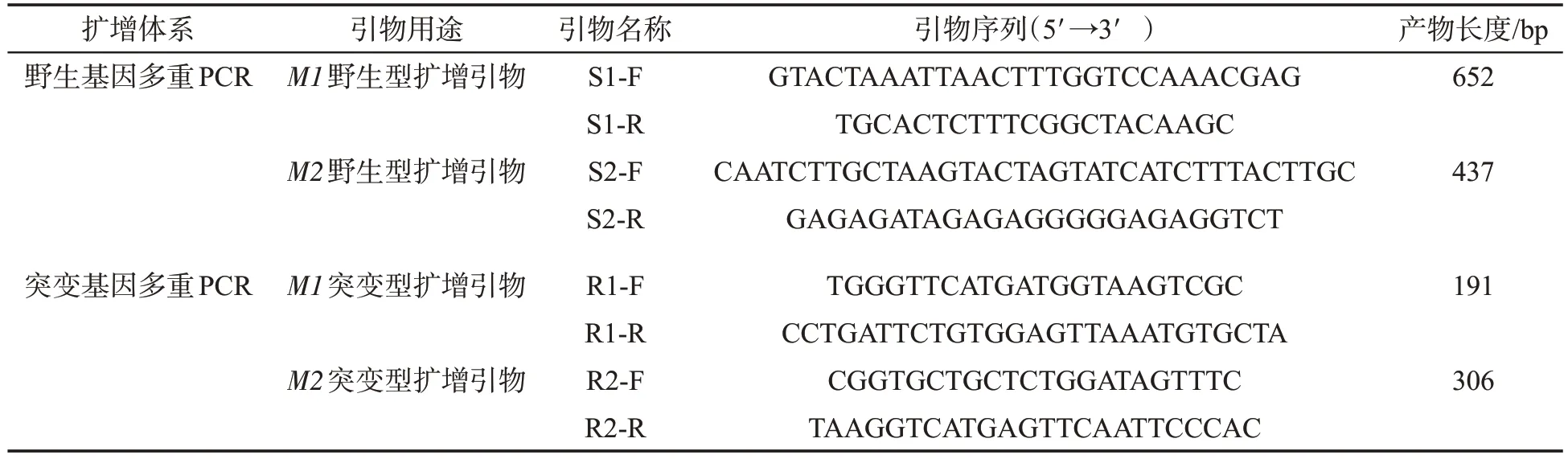
表1 多重PCR引物序列及扩增片段长度Tab.1 Primer sequences and lengths of amplified fragments for multiplex PCR
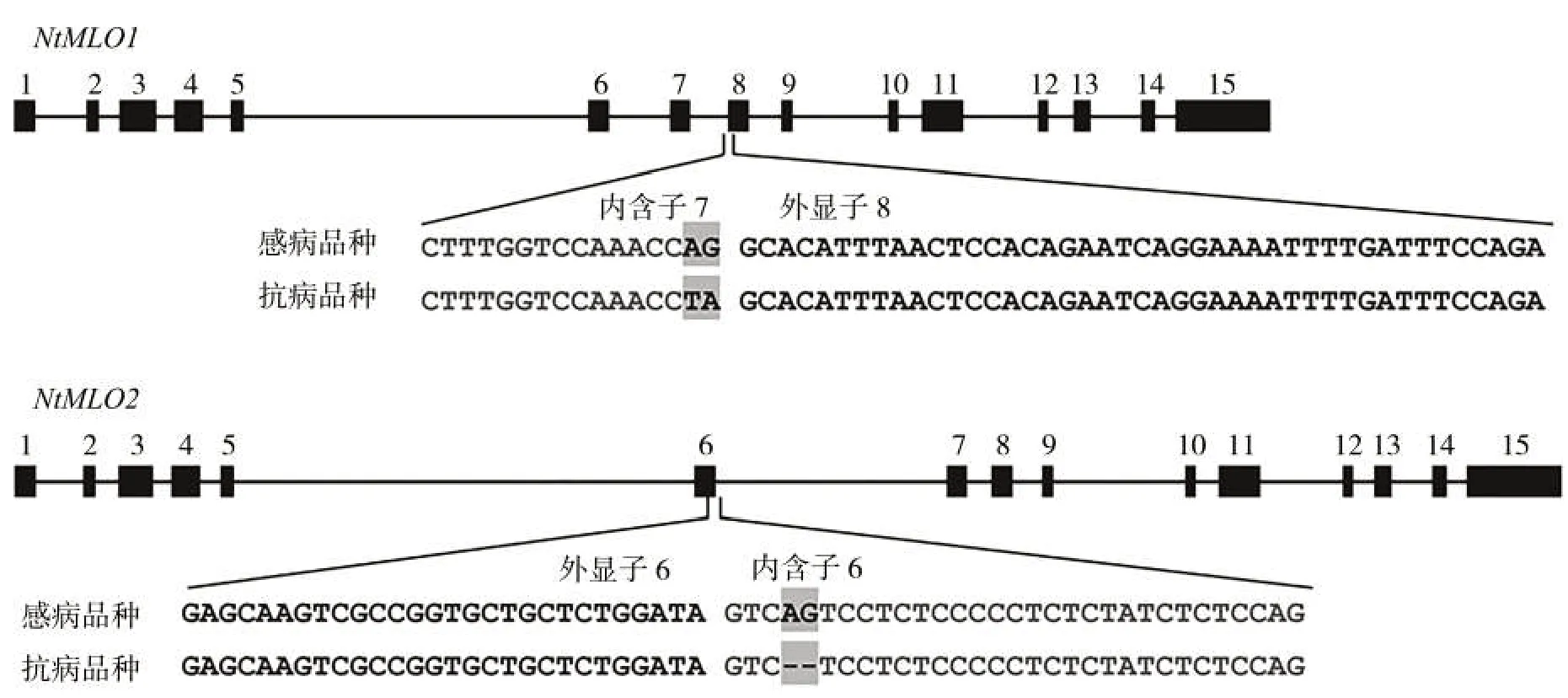
图1 烟草白粉病隐性抗病基因NtMLO1和NtMLO2的野生型和突变型基因序列比对Fig.1 Alignment of wild-type and mutant sequences of recessive resistance genes NtMLO1 and NtMLO2
1.2.4 PCR扩增及产物检测
单组引物 PCR 反应体系 20.0 μL:Premix TaqTM10.0 μL,正反向引物(10 μmol·L-1)各0.4 μL,gDNA模板(80 ng·μL-1)1.0 μL,ddH2O补足至20.0 μL。
双重引物 PCR 反应体系 20.0 μL:Premix TaqTM10.0 μL;M1正反向引物(10 μmol·L-1)各0.4 μL,M2正反向引物(10 μmol·L-1)各0.4 μL;gDNA 模板(80 ng·μL-1)1.0 μL;ddH2O补足至20.0 μL。
Premix TaqTM(TaKaRa TaqTMVersion 2.0 plus dye)购自宝生物工程(大连)有限公司。
PCR 反应程序:94 ℃预变性 3 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s(M1野生型扩增引物对1-M1-F/1-M1-R的延伸时间除外,为40 s),30个循环;72 ℃终延伸10 min。
凝胶电泳检测:PCR 产物用加有GelRed 核酸染料的2%(质量分数)琼脂糖在100 V电压条件下电泳50 min,检测结果在凝胶成像系统上显示。
2 结果与分析
2.1 PCR分子标记体系特异性和稳定性检验
如图2所示,使用S1或S2引物对进行单重PCR扩增时,在含有M1 和M2 野生型等位基因的感病材料和抗感杂交组合(F1)材料中分别扩增出652 或437 bp的单一特异性条带;进行双重PCR扩增时,可以在上述材料中同时扩增出652 和437 bp的特异性条带。使用R1 或R2 引物对进行单重PCR 扩增时,在含有M1和M2突变型等位基因的抗病材料和抗感杂交组合(F1)材料中分别扩增出191 或306 bp的单一特异性条带;进行双重PCR扩增时,可以在上述材料中同时扩增出191和306 bp的特异性条带。结果表明,特异引物对S1、S2、R1 和R2 具有很好的特异性和稳定性,S1和S2的双重PCR扩增结果是各自单重 PCR 扩增结果的叠加,R1 和 R2 的双重 PCR 扩增结果是各自单重PCR 扩增结果的叠加,且能根据2个双重PCR 扩增结果区分供试材料的3 种基因型,达到预期的基因分型效果。
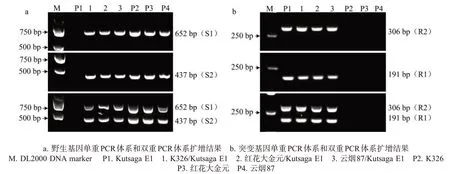
图2 单重PCR体系和双重PCR体系的扩增结果Fig.2 Amplification results of monoplex or duplex PCR system
2.2 F2代群体白粉病抗性鉴定
接种10 d 后调查Kutsaga E1 和K326 构建的F2群体(共500株)白粉病抗性,抗病单株为28株,感病单株为 472 株,符合 1 ∶15 的分离比率,证明 Kutsaga E1 的白粉病抗性受2 对独立遗传的等位基因(A、a和B、b)控制,抗病基因为隐性抗病基因。
2.3 利用分子标记鉴定F2代群体单株基因型
使用2个双重PCR扩增体系对F2代群体内不同单株的DNA 进行PCR 扩增,扩增结果见图3。F2群体中共有9 种基因型,分别为AABB、AABb、AAbb、AaBB、AaBb、Aabb、aaBB、aaBb、aabb,其中仅 aabb基因型(与亲本1 一致)抗病,在突变基因双重PCR体系中扩增出2条特异性条带,在野生基因双重PCR体系中无条带,2个白粉病隐性抗病基因同时发生纯合突变,该后代植株具有白粉病抗性。其他基因型均感病,在野生基因多重PCR 体系中可扩增出1 条或2条特异性条带。

图3 基于野生基因双重PCR体系和突变基因双重PCR体系的F2群体及其亲本的检测结果Fig.3 Detection results of parents and their F2 population via wild-type and mutant allele-specific multiplex PCR systems
2.4 分子标记在烟草白粉病抗性回交改良中的应用
使用野生基因双重PCR 体系和突变基因双重PCR 体系对K326 和Kutsaga E1 的回交后代分离群体进行PCR 扩增,结果见图4。不同于F2代分离群体,该群体有4 种基因型:AABB 基因型在突变基因多重PCR体系中扩增时无条带;AaBB基因型在突变基因多重PCR体系中只扩增出一条191 bp的特异性条带;AABb 基因型在突变基因多重PCR 体系中扩增出一条306 bp的特异性条带;AaBb基因型可在突变基因多重PCR体系中同时扩增出191 bp和306 bp的 2 条特异性条带,分别见图 4 中单株 4、6、9、17 和21。筛选出携带2个隐性抗白粉病基因(AaBb)的单株,选择其中表型尽可能接近轮回亲本的单株继续与轮回亲本杂交或进行自交获得隐性纯合子(aabb)。自交子代纯合子筛选的方法同2.3节,使用2 个多重PCR 体系对BCnF2代群体内不同单株的DNA进行PCR扩增,选择基因型为aabb的子代单株。
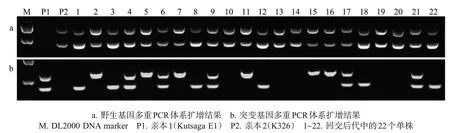
图4 2个多重PCR体系在亲本及回交后代部分单株中的检测结果Fig.4 Detection results of parents and some of their backcross progenies via two duplex PCR systems
在常规回交育种过程中(图5a,以Kutsaga E1和K326为例),当目标性状受隐性基因控制时,不能依据表型在回交后代(BCnF1)中选择出具有目标性状的植株,每次回交之前均需自交一次,然后从分离群体(BCnF2)中选择具有隐性目标性状的植株进行下一轮的回交。这样一代回交,一代自交,交替进行,防止目标性状丢失。不同于常规回交育种,分子标记辅助选择育种(图5b,以Kutsaga E1和K326为例)可利用分子标记直接对BCnF1单株进行基因型鉴定,选择携带2个隐性抗白粉病基因的单株,不需自交一代,且无需进行自交后代单株白粉病菌的接种鉴定工作。除可显著缩短育种时间外,利用分子标记鉴定抗性还具有以下优点:①无需根据表型进行人工判断,检测准确率达100%;②减少人为接种病害对其他实验材料的污染;③不需考虑人工接种病害时对温度条件的需求;④提取的后代单株的DNA还可用于其他性状的分子标记辅助选择。

图5 常规回交育种(a)与分子标记辅助选择育种(b)定向改良烟草白粉病抗性过程比较(以Kutsaga E1和K326为例)Fig.5 Processes of conventional backcross breeding (a) and molecular marker-assisted selection breeding (b) for resistance to powdery mildew in tobacco ( an example with Kutsaga E1 as the donor and K326 as the acceptor)
3 讨论
通过比较M1和M2的基因组序列,发现M1基因在突变位点处的碱基序列与M2 基因相应位置的碱基序列一致性较高。其中,M1 野生型基因与M2 野生型或突变型基因的一致性更高(图6a)。因此,在M1 基因突变位点设计的野生型基因特异性引物可能与M2 相应位置的碱基序列发生结合,反之亦然。如不充分考虑该情况,设计的引物可能会在同时扩增M1和M2野生型等位基因的多重PCR体系中发生交错组合(图6b、图6c、图6d),从而影响扩增效果,这一推论也在之前的预实验中得到证实。根据上述序列比较结果,在M1突变位点处设计野生型基因的正向特异引物(图6e),在M2突变位点处设计野生型基因的反向特异引物(图6e),并在上述引物3′端倒数第3位引入1个错配碱基,以提高PCR延伸反应的特异性。

图6 NtMLO1和NtMLO2基因突变位点区域的DNA序列比较及引物设计策略分析Fig.6 Multiple alignments and primer design strategies of DNA sequences of mutation site regions in NtMLO1 and NtMLO2 genes
本研究中最初试图通过优化反应条件,获得一个同时检测M1和M2野生型和突变型的四重PCR体系,扩增结果如图7所示。由于引物间的干扰,造成四重PCR 体系扩增效率较低,需使用价格较高的热启动Taq 酶(Premix TaqTMHot Start Version)进行40个PCR循环,且该体系重复性较差,故无法应用于分子标记辅助育种。因此,分开构建2 个双重PCR 体系,包括扩增M1 和M2 野生型等位基因的双重PCR体系和扩增M1和M2突变型等位基因的双重PCR体系,同时通过对PCR反应体系和反应条件的优化,确保了扩增结果的重复性和可靠性(图2、图3、图4)。

图7 同时检测NtMLO1和NtMLO2野生型和突变型等位基因的四重PCR扩增结果Fig.7 Amplification results of wild-type and mutant alleles of NtMLO1 and NtMLO2 genes via four pairs of primers in one PCR system
4 结论
根据烟草白粉病感病基因M1和M2野生型和突变型等位基因序列差异设计引物,建立了2 个双重PCR 体系,包括扩增M1 和M2 野生型等位基因的双重PCR体系和扩增M1和M2突变型等位基因的双重PCR 体系,与单重PCR 体系相比,缩短了鉴定时间、提高了检出效率,为烟草白粉病抗病育种回交后代基因型筛选提供了一种客观且可靠的技术手段。
