暹罗炭疽菌中脂滴包被蛋白Cap20与乙酸激酶CsAck的互作研究
2022-03-25王娜王记圆李潇张宇刘文波林春花缪卫国
王娜 王记圆 李潇 张宇 刘文波 林春花 缪卫国

摘 要:暹羅炭疽菌()是一种重要的病原真菌,是我国橡胶树炭疽病( leaf disease, CLD)的田间优势病原种,也是热带、亚热带地区许多其他农林作物炭疽病的主要病原种。脂滴是细胞的中性脂,存在于绝大多数真核细胞中,是细胞内甘油三酯的主要贮存形式。脂滴在细胞内可以参与脂质代谢、膜转运、蛋白降解和信号传导等。包被蛋白(perilipin)是脂滴表面最丰富的脂质相关蛋白,主要存在于动植物体内,对细胞内脂滴代谢起着重要的调控作用。Cap20是暹罗炭疽菌中包被蛋白的同源蛋白,前期证实Cap20是一个致病相关蛋白,它参与了炭疽菌附着胞膨压形成、脂滴数量和致病性。了解其互作蛋白和互作的生物学意义可能为深入了解脂滴包被蛋白参与的致病分子机制具有重要意义。课题组前期通过酵母双杂交技术在暹罗炭疽菌cDNA文库中筛选到一个与Cap20互作的候选蛋白乙酸激酶,本研究克隆了该乙酸激酶的编码基因,并进行了蛋白结构和同源蛋白聚类分析。结果表明,乙酸激酶编码基因的DNA大小为1312 bp,包括一个内含子,cDNA为1248 bp,编码415个氨基酸,含有一个乙酸激酶结构域,命名为CsAck。然后构建含6×his标签的原核表达载体PET32a-CsAck,利用其和含GST标签的pGEX6p-1-Cap20(先前构建)进行蛋白表达和纯化,获得含有6×His标签的融合蛋白CsAck和含有GST标签的Cap20。通过Pull down验证了Cap20和CsAck蛋白之间的体外互作。最后,构建含有潮霉素转移酶基因的表达载体PXY203-CsAck-S和含有氯嘧磺隆抗性基因的表达载体pCB1532-GFP-Cap20,将它们共同转化暹罗炭疽菌野生型菌株获得转化子。Co-IP(Co-immunoprecipitation)的结果证实Cap20和CsAck在暹罗炭疽菌中可以相互作用。该结果证实了致病性相关蛋白Cap20和乙酸激酶CsAck在体外和体内均可发生蛋白互作,可为进一步研究Cap20在暹罗炭疽菌中的致病功能和调控机制奠定基础。
关键词:暹罗炭疽菌;Cap20;CsAck;蛋白互作验证;Pull down;CO-IP中图分类号:S31 文献标识码:A
Lipid Droplet Coating Protein Cap20 and Acetate Kinase CsAck Interaction Verification in
WANG Na, WANG Jiyuan, LI Xiao, ZHANG Yu, LIU Wenbo, LIN Chunhua, MIAO Weiguo
College of Plant Protection, Hainan University / Key Laboratory of Green Prevention and Control of Tropical Plant Diseases and Pests, Ministry of Education, Haikou, Hainan 570228, China
is an important pathogenic fungus, which is the dominant pathogenic species of leaf disease (CLD) in the field of rubber trees in China. And it is also the main pathogen of anthracnose of many other agricultural and forestry crops in tropical and subtropical regions. Lipid droplets, the neutral lipids of cells, are present in most eukaryotic cells and are the storage form of intracellular triglycerides. Lipid droplets can be involved in lipid metabolism, membrane transport, protein degradation and signaling in the cell. Perilipin is the most abundant lipid-associated protein on the surfaces of lipid droplets, mainly existed in animals and plants, and plays an important role in regulate lipid metabolism. Cap20 is a homologue of perilipin in genus. It was previously confirmed that Cap20 is a pathogenic associated protein that involved in the formation of turgor pressure of appressorium, the number of lipid droplets and the pathogenicity of genus. Understanding the interaction proteins of Cap20 and the biological significance of the interactions may be important for gaining insight into how Cap20 is involved in the molecular mechanisms of pathogenesis. In the previous stage, a candidate protein, acetate kinase, which interacts with Cap20, was screened from the cDNA library of by yeast two-hybrid technology. In this study, the full length of acetate kinase coding gene was cloned, and the protein structure and phylogenetic analysis were analyzed firstly. The results showed that the acetate kinase coding gene had a DNA size of 1312 bp including an intron, a cDNA of 1248 bp encoding 415 amino acids and containing an acetate kinase structural domain, which was named as CsAck. Then, the prokaryotic expression vector PET32a-CsAck with 6×His tag was constructed, and the fusion protein CsAck with a 6×His tag and Cap20 with a GST tag was obtained by using it and the GST-tag-containing pGEX6p-1-Cap20 (previously constructed) for protein expression and purification. The interaction between the Cap20 and CsAck proteins was verified by Pull down expriments. Finally, the expression vectors PXY203-CsAck-S containing the hygromycin transferase gene and the pCB1532-GFP-Cap20 with the sulfonylurea resistant gene were constructed and co-transformed into wild-type strain to obtain transformants. The results of Co-IP (Co-Immunoprecipitation) confirmed that Cap20 and CsAck could interact with each other in . The results confirm that the pathogenesis-related protein Cap20 interacts with the acetate kinase CsAck both and , which could lay the foundation for further studies on the pathogenic function and regulatory mechanism of Cap20 in .
; Cap20; CsAck; protein interaction verification; Pull down; CO-IP
10.3969/j.issn.1000-2561.2022.03.017
在橡胶生长过程中炭疽病是危害叶片较为严重的病害之一,从橡胶树的小苗、幼树直至成龄的橡胶树均可受到炭疽病的危害,通过侵染橡胶树叶柄、嫩叶、嫩梢、胶果等部位,造成幼叶剥落、嫩梢回枯、结果后枯萎等症状。炭疽病严重时会导致橡胶树的重复落叶、嫩梢返枯,甚至推迟橡胶的开割时间,影响天然橡胶的生产。引起橡胶树炭疽病的病原炭疽菌有许多,主要是胶胞炭疽复合群(species complex)和尖孢炭疽复合群( species complex),其中主要的优势病原种是胶胞炭疽复合群中的暹罗炭疽菌()。该病原菌也是热带、亚热带地区各种农林作物炭疽病的主要病原种类,可侵染橡胶树、可可、咖啡、芒果、木瓜、柑橘等许多热带作物。目前暹罗炭疽菌的相关致病分子机制研究较少。
大多数病原真菌在侵染寄主植物的过程中会形成一种侵染结构——附着胞,附着胞的形成对于病原真菌穿透寄主表皮促进真菌侵染具有重要作用。脂滴(lipid droplet)是细胞内甘油三酯的主要贮存形式,它能随细胞骨架移动并与其他细胞器相互作用,在脂质代谢、存储、膜转运、蛋白降解和信号传递等方面发挥重要作用。病原真菌附着胞成熟过程中,脂质体可进入附着胞被甘油三酯脂肪酶降解,促进膨压的形成。脂滴包被蛋白紧密地结合在脂滴的表面,是脂滴的主要结构蛋白。在哺乳动物中,脂滴包被蛋白(perilipin)是脂滴表面的一种可磷酸化蛋白,受蛋白激酶A的调节,在脂滴表面形成一层生理“屏障”,具有调控脂解和促进脂滴融合的双重调控作用,对脂质代谢调节具有重要意义。在病原真菌中,已证实了脂滴包被蛋白与附着胞膨压和致病性关系密切。如昆虫致病真菌绿僵菌()的MPL1(perilipin同源蛋白)是附着胞膨压形成的重要因子,MPL1基因缺失会引起绿僵菌分生孢子和菌丝中的脂滴数量减少,附着胞膨压降低,从而通过影响附着胞的穿透能力来影响病原菌的致病能力。本实验室前期证实了Cap20是炭疽菌的脂滴包被蛋白,它与炭疽菌附着胞膨压形成相关,Cap20的缺失导致附着胞膨压降低从而影响了炭疽菌的致病性。但病原真菌中脂滴包被蛋白的调控分子机制仍不清楚。
实验室前期利用酵母双杂技术从酵母文库中筛选到16个与Cap20互作的候选蛋白,并证实了蛋白激酶催化亚基(protein kinase A catalytic subunit)PKAC1与Cap20间的互作关系和基因表达正调控关系。在所筛选的候选互作蛋白中,还含有乙酸激酶(acetate kinase),乙酸激酶是磷酸转移酶超家族中的一个成员,存在于许多生物体内,在生物体的碳源代谢和能量代谢中发挥了重要的作用,其主要是在乙酰磷酸和二磷酸腺苷(ADP)生成乙酸和腺嘌呤核苷三磷酸(ATP)的可逆反应中起着催化作用。乙酸激酶是否参与脂滴包被蛋白状态或功能调控仍未知。本研究基于前期研究结果,利用Co-IP技术与Pull down技术进一步验证Cap20与CsAck在炭疽菌菌体内和菌体外的互作关系,为下一步开展炭疽菌脂滴包被蛋白Cap20的功能及调控机制奠定基础。
材料与方法
材料
1.1.1 供试菌株及质粒 暹罗炭疽菌()野生型菌株WT-HN08、载体PET32a(含6×His标签)、载体PXY203(S-tag标签)由本实验室保存。载体PMD-18T(TaKaRa),Cap20表达载体pGEX6p-1-Cap20和pCB1532- GFP-Cap20为实验室前期构建。
1.1.2 试剂 限制性内切酶、T连接酶(TaKaRa),普通DNA产物纯化试剂盒(北京,天根),质粒小量提取试剂盒(美国,Omega),GST、His、GFP、S-tag单克隆一抗以及荧光二抗(Abcam),IPTG(Thermo scientific),考馬斯亮蓝染色液(Biosharp),His Sepharose beads、GFP-Trap Sepharose bead和PMSF(苯甲基磺酰氟)(上海,碧云天),引物合成和测序由华大基因公司完成。
方法
1.2.1 炭疽菌乙酸激酶CsAck编码基因的克隆和分析 设计引物W-Ack-F(5-ATGAAGATTATC CTGGCCATC-3)和W-Ack-R(5-TCAAGACCA AAGCTCACTCTTC-3),参照廖小淼等的方法进行CsAck编码基因的克隆与结构域分析(simple modular architecture research tool, SMART; http://smart.embl-heidelberg.de/smart/set_ mode.cgi)。下载同源蛋白利用MEGA软件进行蛋白序列的聚类分析。
1.2.2 Pull down验证Cap20和CsAck体外互作 (1)His-CsAck融合蛋白的表达和纯化。设计引物His-Ack-F(5-CGCGGATCCGCGATGAAG ATTATCCTGGCCATC-3)和His-Ack-R(5-CC GGAATTCCGGTCAAGACCAAAGCTCACTCTTC-3),以cDNA为模板扩增CsAck序列,将该序列利用HⅠ和RⅠ双酶切,参照廖小淼等的方法构建原核表达载体PET32a-CsAck。
参照廖小淼等的方法表达融合蛋白,设置不同的IPTG浓度(0、0.4、0.6、0.8、1.0 mmol/L)诱导表达,提取总蛋白开展SDS-PAGE和Western blot检测。剩余的上清液蛋白利用His Sepharose beads進行纯化。
(2)Pull down体外验证Cap20与CsAck互作。利用带有GST标签的融合表达载体pGEX6p- 1-Cap20获得含有GST-Cap20的蛋白上清液,将其与融合蛋白His-CsAck(已亲和固化在His Sepharose beads上)共孵育5~8 h,孵育结束后对His Sepharose beads进行清洗,进行Western blot检测。
1.2.3 Co-IP验证Cap20和CsAck体内互作 (1)载体构建、共转化和筛选。设计带有酶切位点Ⅰ的引物Co-Ack-F(5-ACTCACTATAG GGCGAATTGGGTACTCAAATTGGTTATGAAGATTATCCTGGCCATC-3)和Co-Ack-R(5-TT CGAATTTAGCAGCAGCGGTTTCTTTTCAAGACCAAAGCTCACTCTTC-3),扩增CsAck基因的cDNA序列,用Ⅰ酶切载体PXY203,将CsAck扩增片段和PXY203载体共转酵母菌XK-125,经过SD-Trp平板筛选验证后获得的阳性克隆转到大肠杆菌DH5α中进行扩繁,PCR、测序验证正确后,获得带有S-tag标签的重组表达载体PXY203-CsAck-S。
利用PEG介导的原生质体转化法,将质粒pCB1532-GFP-Cap20和PXY203-CsAck-S共转暹罗炭疽菌野生型菌株WT-HN08的原生质体,设置阴性对照(质粒pCB1532-GFP和PXY203-CsAck-S共转WT-HN08原生质体),先用DCM(含100 μg/mL氯嘧磺隆)初筛,再用PDS(含200 μg/mL潮霉素)复筛获得转化子,经PCR验证正确后,获得成功转入2个表达载体的炭疽菌转化子。
(2)Co-IP体内验证Cap20和CsAck互作。提取炭疽菌转化子的总蛋白,取20 μL GFP-Trap Sepharose beads于1.5 mL 离心管中,用1×PBS缓冲液平衡3次,加入800 μL炭疽菌转化子总蛋白与GFP-Trap Sepharose在4℃条件下孵育4~ 6 h,用1×PBS缓冲液对GFP-Trap Sepharose清洗3次,弃上清。加入蛋白电泳上样Buffer沸水浴7~10 min,随后用于Western blot检测。
结果与分析
暹罗炭疽菌乙酸激酶编码基因的克隆和分析
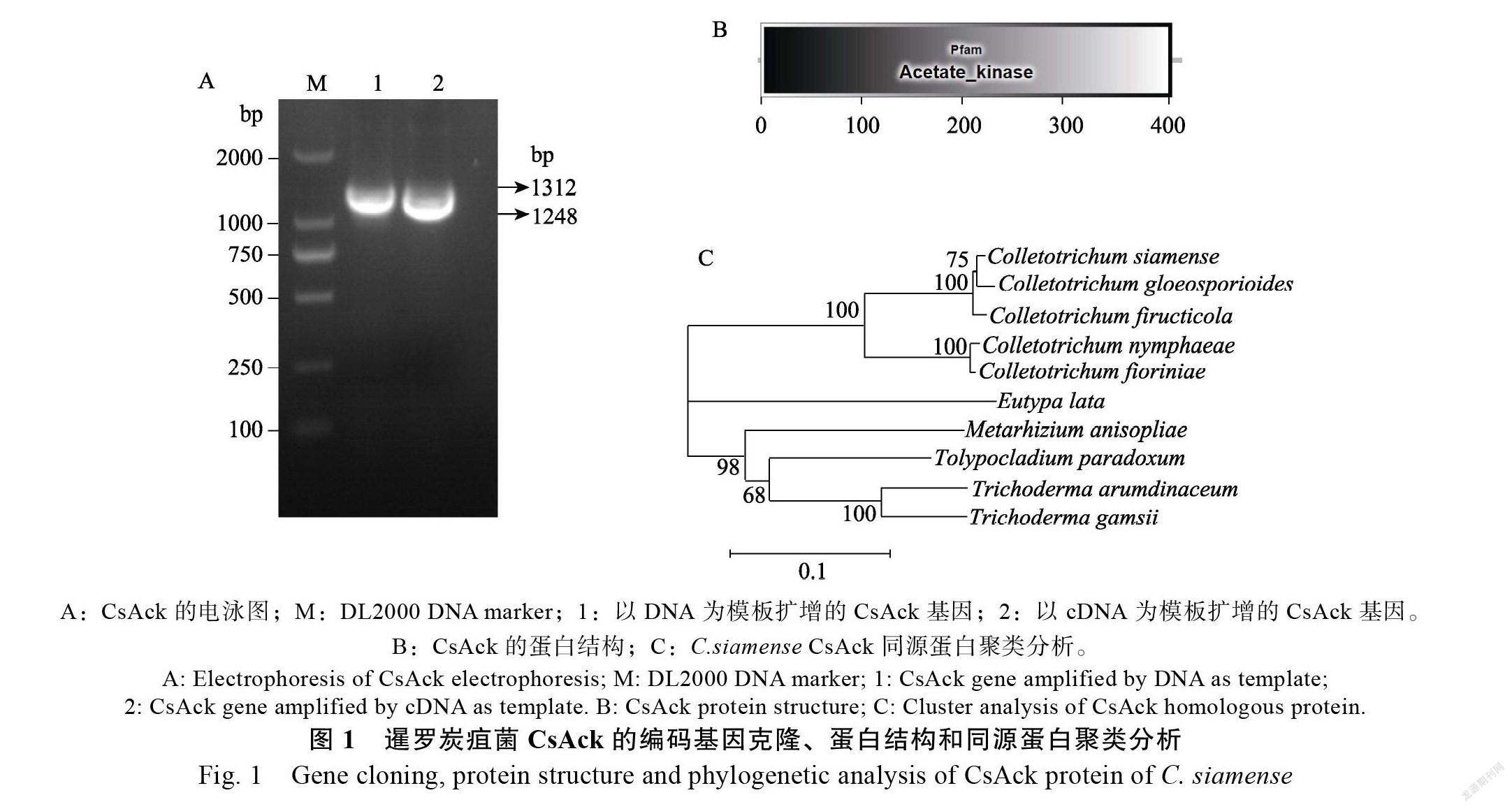
扩增获得的乙酸激酶CsAck编码基因DNA长为1312 bp,cDNA长为1248 bp(图1A),序列包含一个内含子,编码415个氨基酸(登录号
为MZ733402)。其蛋白序列含有一个乙酸激酶结构域(图1B),通过蛋白序列的聚类分析(MEGA),该蛋白与炭疽菌的乙酸激酶蛋白成功聚为一类(图1C)。根据NAKASHIMADA等对克雷伯氏菌的研究中发现乙酸激酶基因的功能,沿用前人命名规则,将暹罗炭疽菌乙酸激酶命名为CsAck。
验证和体外互作
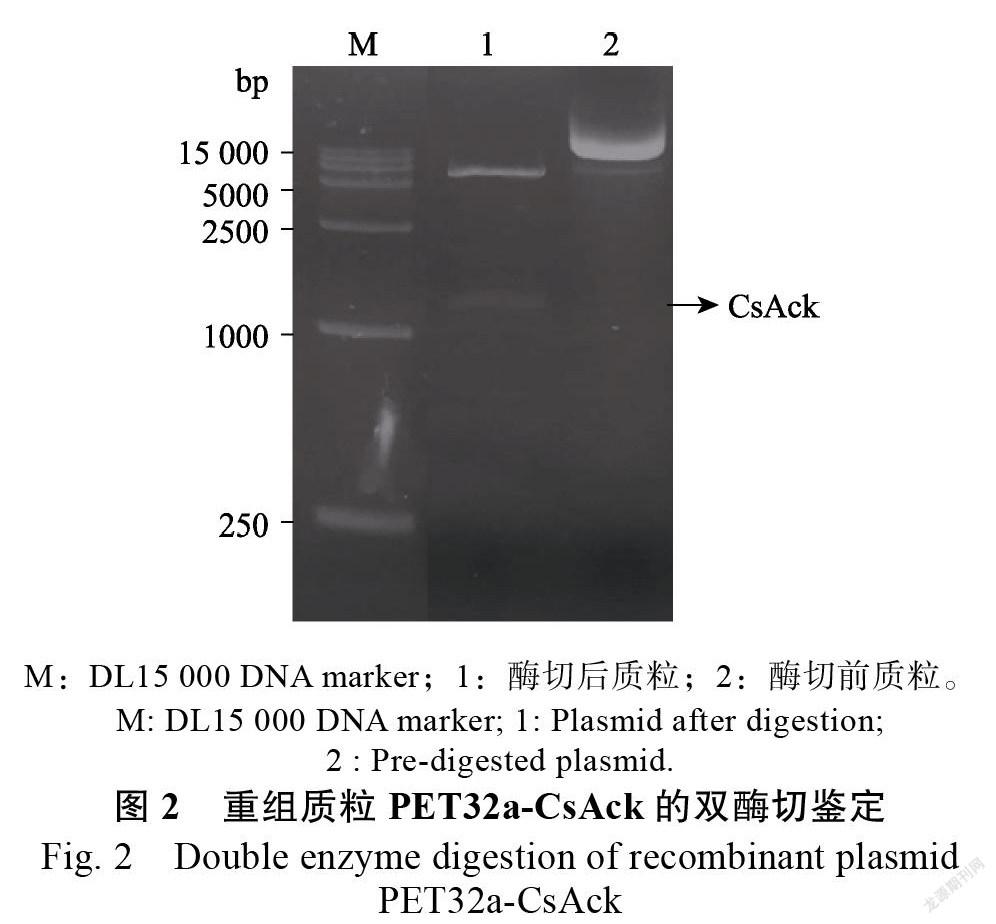
2.2.1 His-CsAck和GST-Cap20融合表达载体的构建 利用引物对His-Ack-F/R扩增得到CsAck基因的cDNA片段经TDNA连接酶连接至载体PET32a上,得到重组载体PET32a-CsAck,通过测序和双酶切(HⅠ、RⅠ)证实目的片段插入正确(图2)。
2.2.2 His-CsAck融合蛋白的表达和纯化 PET32a-CsAck融合蛋白表达载体分别经过不同浓度IPTG诱导表达后,经过SDS-PAGE和考马斯亮蓝染色后,在预期蛋白大小为65 kDa(CsAck分子量约为45 kDa,6×His标签蛋白分子量约为20 kDa)处可见一条蛋白条带(图3A)。总蛋白液经过His单抗孵育后,Western blot结果显示该条带为目的融合蛋白His-CsAck(图3B)。诱导表达的上清液蛋白用His Sepharose beads纯化,用于下一步的试验。
2.2.3 Pull down体外验证Cap20与CsAck互作 为了验证His-CsAck与GST-Cap20间的蛋白互作,
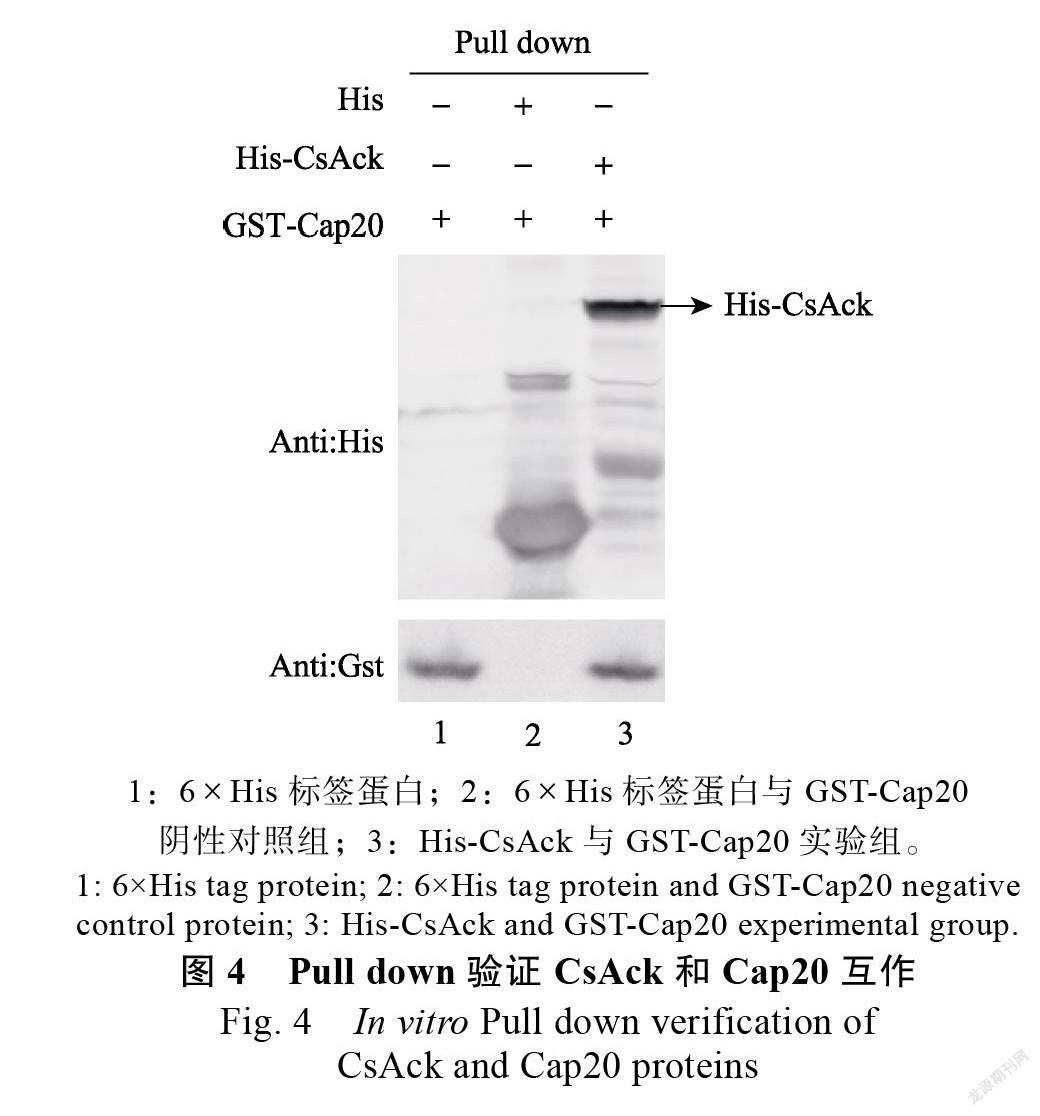
提取含有GST-Cap20融合蛋白的菌体上清液蛋白,将其分别与结合了His-CsAck和6×His的His Sepharose beads共孵育,Western blot結果(图4)表明阴性对照6×His不能与GST-Cap20结合(泳道2),而His-CsAck能够与GST-Cap20在体外特异性结合(泳道3),说明CsAck与Cap20存在体外的相互作用。
验证和体内互作
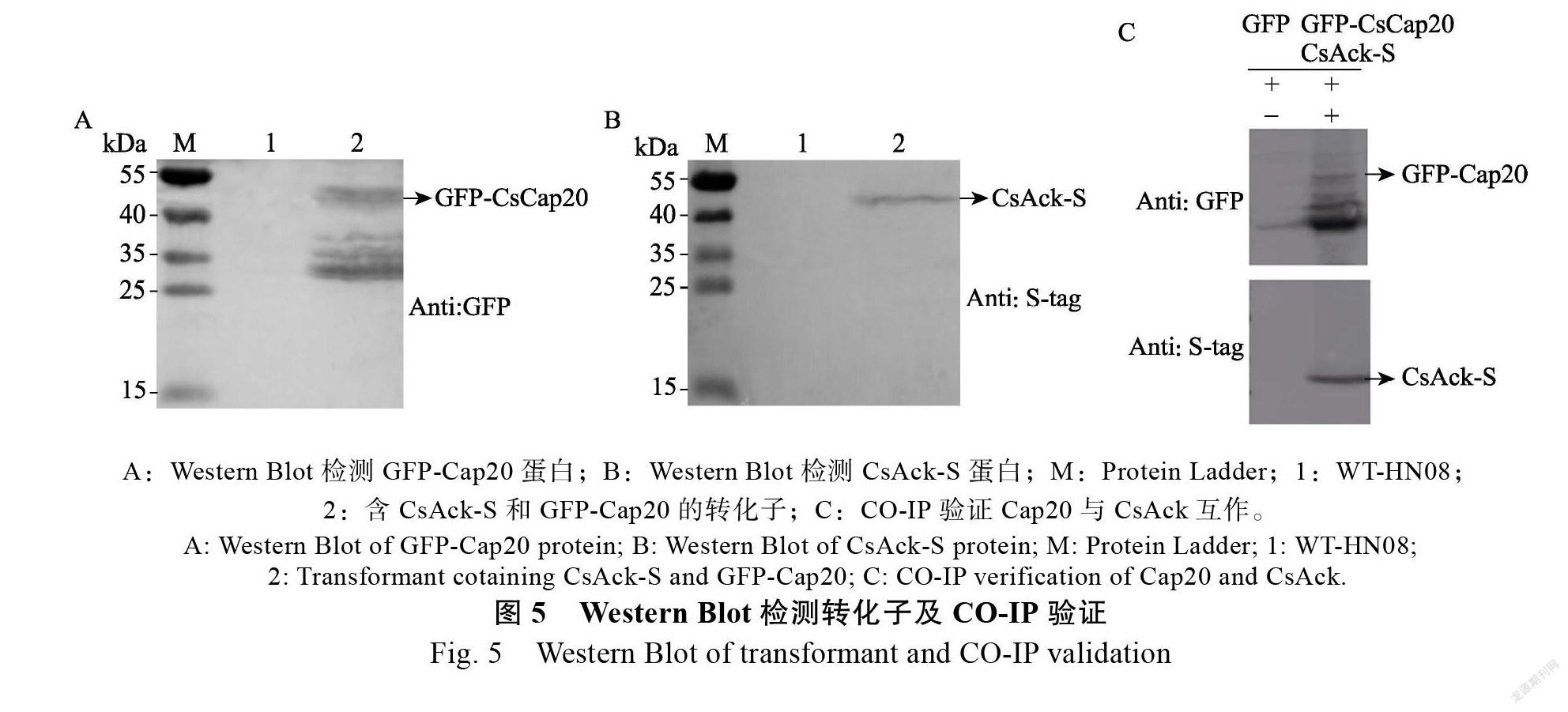
2.3.1 载体构建、共转化和筛选 上述方法构建的PXY203-CsAck-S验证正确后,将其与质粒pCB1532-GFP-Cap20共转暹罗炭疽菌WT-HN08的原生质体后,经过抗性药剂筛选和PCR验证后,最终获得含有2个重组质粒的炭疽菌转化子。提取转化子的炭疽菌总蛋白分别进行GFP-Cap20和CsAck-S蛋白的Western blot检测,2种蛋白在相应位置均有条带,表明融合蛋白GFP-Cap20(图5A)和CsAck-S(图5B)在炭疽菌内均成功表达。
2.3.2 Co-IP体内验证Cap20和CsAck互作 提取含有融合蛋白GFP-Cap20和CsAck-S的炭疽菌转化子总蛋白,利用GFP-Trap Sepharose beads沉淀Cap20及与其互作的蛋白,Western blot结果(图5C)显示阴性对照GFP不能与CsAck-S结合,而GFP-Cap20能够与CsAck-S特异性结合,表明Cap20与CsAck在暹罗炭疽菌菌体内存在互作关系。
讨论
暹罗炭疽菌是橡胶树及许多热带和亚热带作物炭疽病的主要病原种,探究暹罗炭疽菌的致病分子机制具有重要意义。附着胞是炭疽菌侵染寄主植物的关键结构,附着胞能否正常形成以及附着胞是否能形成具有一定穿透力的膨压,对炭疽菌的致病力有重要的影响。在附着胞成熟过程中,脂滴可进入附着胞被甘油三酯脂肪酶降解,促进膨压的形成。脂滴包被蛋白是病原真菌脂滴表面的结构蛋白,绿僵菌中的MLP1和炭疽菌的Cap20均可参与附着胞膨压的形成,影响附着胞的穿透能力,从而影响病原菌的致病性。但脂滴包被蛋白是如何影响附着胞膨压,如何参与致病的分子机制仍未知。
在哺乳动物中脂滴包被蛋白(perilipin)在脂滴表面可以形成一层生理“屏障”,其磷酸化状态会受到蛋白激酶A的调节,从而影响脂滴脂解和脂滴融合,这个过程对脂质代谢的调节具有重要意义。本实验室前期利用酵母双杂技术,从炭疽菌cDNA酵母文库中筛选获得脂滴包被蛋白Cap20的候选互作蛋白,也证实了炭疽菌脂滴包被蛋白Cap20与蛋白激酶A催化亚基PKAC1互作,且表达具有协同性,推测炭疽菌中脂滴包被蛋白Cap20和哺乳动物中的脂滴包被蛋白类似,均受到蛋白激酶A的双向调控脂解过程。但脂滴包被蛋白是否与其他蛋白酶互作,是否受到其他酶的调控并不知。
乙酸激酶是磷酸转移酶超家族中的成员,已知其在生物体内参与ATP和乙酸的形成,参与生物体的碳源代谢和能量代谢等。乙酸激酶与蛋白水解活性有关,对细菌的生长具有重要作用。乙酸激酶的生理功能在细菌中的研究较多,但未见在真菌中的相关报道。本研究在前期所获得的Cap20候选互作蛋白中有乙酸激酶,本文进一步克隆了炭疽菌中乙酸激酶编码基因CsAck,且通过Pull down技术和Co-IP技术进一步验证了脂滴包被蛋白Cap20和CsAck间的互作。乙酸激酶参与能量代谢同时也能控制乙酸的合成,而乙酸能改善真菌的环境。脂滴包被蛋白与乙酸激酶的互作,可能是其本身在炭疽菌致病过程中需要大量的能量以及特殊的生理生化环境,而这些条件的满足能有利于炭疽菌的致病。该研究结果可推测脂滴包被蛋白Cap20可能不仅仅受到蛋白激酶A的调控,还受到乙酸激酶CsAck的调控,亦或乙酸激酶在行使功能时需要脂滴包被蛋白的参与。本研究为进一步分析Cap20和CsAck互作的生物学意义,探究Cap20和CsAck的生物学功能,以及为研究暹罗炭疽菌等病原真菌的致病分子机制奠定基础。
参考文献
- 蔡志英, 黄贵修. 巴西橡胶树炭疽病研究进展[J]. 西南林业大学学报, 2011, 31(1): 89-93.CAI Z Y, HUANG G X. Research advances in anthracnose of [J]. Journal of Southwest Forestry University, 2011, 31(1): 89-93. (in Chinese)
- 林春花, 董 瑛, 刘文波, 缪卫国, 郑服丛. 多基因序列比较分析海南橡胶树炭疽病菌遗传种群[J]. 热带作物学报, 2016, 37(5): 943-951.LIN C H, DONG Y, LIU W B, MIAO W G, ZHENG F C. Genetic diversity analysis of spp. population isolated from rubber tree in Hainan based on multiple-gene phylogeny[J]. Chinese Journal of Tropical Crops, 2016, 37(5): 943-951. (in Chinese)
- 林春花, 孙董董, 韩 丹, 黄贵修. 中国橡胶树苗圃2种炭疽病菌分子鉴定及分布分析[J]. 热带作物学报, 2014, 35(9): 1802-1808.LIN C H, SUN D D, HANG D, HUANG G X. Identification of species on the leaf disease from rubber nurseries in China[J]. Chinese Journal of Tropical Crops, 2014, 35(9): 1802-1808. (in Chinese)
- 林春花, 杨 欢, 赵晓宇, 潘潇涵, 刘文波, 缪卫国, 郑服丛. 海南橡胶树炭疽菌和的鉴定及系统发育分析[J]. 热带作物学报, 2018, 39(1): 129-136.LIN C H, YANG H, ZHAO X Y, PAN X H, LIU W B, MIAO W G, ZHENG F C. Identification and phylogenetic analysis of anthracnose pathogen and isolated from rubber tree in Hainan[J]. Chinese Journal of Tropical Crops, 2018, 39(1): 129-136. (in Chinese)
- LIU X B, LI B X, CAI J M, ZHENG X L, FENG Y L, HUANG G X. species causing anthracnose of rubber trees in China[J]. Scientific reports, 2018, 8(1): 1-14.
- SHARMA G, PINNAKA A K, SHENOY B D. Resolving the species complex using ApMat marker[J]. Fungal Diversity, 2015, 71(1): 247-264.
- WIKEE S, CAI L, PAIRIN N, MCKENZIE E, SU Y Y, CHUKEATIROTE E, THI H N, BAHKALI A H, MOSLEM M A, ABDELSALAM K, HYDE K D. species from Jasmine ()[J]. Fungal Diversity, 2011, 46(1): 171-182.
- 王卫芳, 冷怀琼. 柑桔炭疽病菌潜伏侵染的研究Ⅲ. 叶部病原菌的组织病理学[J]. 四川农业大学学报, 1991(2): 206-210.WANG W F, LENG H Q. Studies on the latent infestation of Citrus anthracnose: III. Histopathology of foliar pathogens[J]. Journal of Sichuan Agricultural University, 1991(2): 206-210. (in Chinese)
- SANGAPPILLAI V, NADARAJAH K. Fatty acid synthase beta dehydratase in the lipid biosynthesis pathway is required for conidiogenesis, pigmentation and appressorium formation in S6[J]. International Journal of Molecular Sciences, 2020, 21(19): 7224.
- WANG C, LEGER R J S. The perilipin homolog MPL1 regulates lipid metabolism, appressorial turgor pressure, and virulence[J]. Journal of Biological Chemistry, 2007, 282(29): 21110-21115.
- WANG J Y, ZHAO X Y, LIAO X M, HE Q G, LI X, LIU W B, YANG Z P, ZHANG Y, LIN C H, MIAO W G. Screening for proteins interacting with the perilipin-like protein CAP20 by a yeast two-hybrid system and identification of a protein kinase a catalytic subunit as an interacting protein in [J]. European Journal of Plant Pathology, 2020, 156(3): 971-977.
- 廖小淼, 何其光, 刘 耀, 徐良向, 周晓韵, 刘文波, 张 宇, 林春花, 缪卫国. 橡胶树炭疽菌基因的克隆和原核表达分析[J]. 热带作物学报, 2019, 40(5): 932-938.LIAO X M, HE Q G, LIU Y, XU L X, ZHOU X Y, LIU W B, ZHANG Y, LIN C H, MIAO W G. Cloning and prokaryotic expression of gene from [J]. Chinese Journal of Tropical Crops, 2019, 40(5): 932-938. (in Chinese)
- NAKASHIMADA Y, MARWOTO B, KASHIWAMURA T, KAKIZONO T, NISHIO N. Enhanced 2,3-butanediol production by addition of acetic acid in [J]. Journal of Bioscience and Bioengineering, 2000, 90(6): 661-664.
- LIN C H, LIU X B, SHI T, LI C P, HUANG G X. The perilipin homologue CAP20 regulates functional appressorial formation and fungal virulence[J]. Journal of Phytopathology, 2018, 166(3): 216-225.
- ZHONG Z, HU R, ZHAO J, LIU W, KWOK LY, SUN Z, ZHANG H, CHEN Y. Acetate kinase and peptidases are associated with the proteolytic activity of isolated from fermented food[J]. Food Microbiology, 2021, 94: 103651.
