玫瑰茄花色苷纯化过程中有机酸的回收及其性质研究
2022-03-24赵彦巧李彬郭美辰王炳君吕金乌刘赵丰刘莹韦元桃
赵彦巧,李彬,郭美辰,王炳君,吕金乌,刘赵丰,刘莹,韦元桃
(天津商业大学生物技术与食品科学学院天津市食品生物技术重点实验室,天津 300134)
玫瑰茄(Hibiscus sabdariffa),又称为洛神花[1]。玫瑰茄花萼中有机酸含量高达16.67%~33.33%,其中草酸和琥珀酸含量最高[2]。已有文献表明,玫瑰茄有机酸具有抗癌[3]、抗氧化[4]、抗炎症[5]以及抑制 α-淀粉酶活性[6]等作用,因此玫瑰茄有机酸的应用前景十分宽阔。
玫瑰茄晒干后可制作为花茶产品[7]。近年来,国内研究主要集中在玫瑰茄花萼的成分分析及产品初加工方面[8-9],但对于有机酸及其他活性物质等成分的重点研究较少。目前,玫瑰茄花色苷的提取、纯化技术已经成熟,树脂吸附法因具有污染少、提取效率高、可以反复利用以及生产成本低等优点[10],常被广泛应用于有机酸提取和制备工艺的研究中[11-12]。因此本研究采用阴离子-阳离子交换柱联合法回收有机酸流出液,测定树脂吸附效能,并通过研究有机酸的性质,为玫瑰茄有机酸的研究及功能性产品的开发提供参考。
1 材料与方法
1.1 材料与试剂
玫瑰茄:产自云南省武定市;AB-8型大孔树脂:安徽省三星树脂有限公司;D301弱碱性阴离子交换树脂:天津市津达正通环保科技有限公司;001×7强酸性氢型阳离子交换树脂:河北省斯福莱德水处理公司;DPPH(分析纯):东京化成工业株式会社;水溶性维生素E(Trolox,分析纯):北京源叶生物科技有限公司;ABTS(分析纯):上海易恩化学技术有限公司。
1.2 仪器与设备
pH计(ST3100):奥豪斯仪器有限公司;数显型旋转蒸发仪(RV10):德国IKA公司;实验型喷雾干燥机(YC-015):上海雅程仪器设备有限公司;扫描电镜(S-4800):日本 Hitachi公司。
1.3 方法
1.3.1 玫瑰茄花萼前处理
玫瑰茄低温烘干并粉碎,筛选出尺寸为250 μm~425 μm的颗粒物,4℃冷藏备用。
1.3.2 树脂的预处理及再生
AB-8型大孔树脂按照郭庆启等[13]的处理方法进行预处理。
D301弱碱性阴离子交换树脂[14-15]和001×7强酸性氢型阳离子交换树脂按照展亚莉等[16]的处理方法进行预处理。
D301弱碱性阴离子交换树脂再生:取适量使用过的D301树脂,以4倍体积2 mol/L NaOH溶液浸泡,动态吸附4 h后,用蒸馏水洗至中性。
001×7强酸性氢型阳离子交换树脂再生:取适量使用过的001×7树脂,以4倍体积3%HCl溶液浸泡,动态吸附4 h后,用蒸馏水洗至中性。
1.3.3 玫瑰茄花色苷提取纯化
按照孟翔宇[8]的操作方法得到玫瑰茄花色苷粗提液,5 000 r/min、4℃离心10 min后,取上清液进行减压蒸馏、真空干燥,得到玫瑰茄花色苷粗提粉。以3mg/mL花色苷溶液(pH2.46)为上样液,按上样液∶树脂=25∶1(体积比)上柱,回收流出液,并测其pH值。
称取20 g预处理后的D301树脂装柱,以AB-8型大孔树脂纯化玫瑰茄花色苷过程中回收的溶液为上样液,动态吸附流速2.0 mL/min,测定流出液pH值,直至pH值有明显下降时停止上柱;蒸馏水洗至流出液呈中性,用0.5 mol/L NaOH溶液上柱洗脱,收集洗脱液。称取20 g预处理后的001×7型树脂,以过D301柱后的洗脱液为上样液,动态吸附流速2.0 mL/min,测定树脂的吸附效能,收集流出液直至流出液pH值≥7,即得到有机酸溶液。
再生后树脂的吸附效能测定同上述方法。
1.3.4 回收玫瑰茄有机酸
玫瑰茄有机酸溶液经旋转蒸发真空浓缩后,进行喷雾干燥,条件为流速55 mL/h、进气温度190℃、出气温度75℃,即得到玫瑰茄有机酸粉末状样品。
1.3.5 玫瑰茄有机酸粉末状样品的形态观察
用扫描电镜(scanning electron microscope,SEM)观察玫瑰茄有机酸粉末状样品的表面形态,扫描电压为3.0 kV。
1.3.6 DPPH自由基清除能力的测定
取不同质量浓度(0.12、0.14、0.16、0.18、0.20、0.22、0.24、0.26mg/mL)的有机酸溶液 0.5mL、1.0mL0.1mmol/L DPPH-乙醇溶液和1.5 mL无水乙醇,避光静置30 min,在517 nm处测定吸光度,按下式计算清除率。对照组为Trolox,每份处理做3个平行[17]。
DPPH 自由基清除率/%=[1-(A1-A2)/A0]×100
式中:A1为样品溶液的吸光度;A2为用等量无水乙醇代替DPPH溶液样品的吸光度;A0为用等量无水乙醇代替有机酸溶液样品的吸光度。
1.3.7 ABTS+自由基清除能力的测定
配制ABTS+母液:将245 μL 100 mmol/L过硫酸钾溶液置于10 mL容量瓶中,加入9.5 mL 7.0 mmol/L ABTS+溶液,用水补齐至刻度,混合均匀,用锡纸包裹容量瓶避光静置16 h。向pH7.4的磷酸缓冲盐溶液(phosphate buffered saline,PBS) 中滴加 ABTS+母液,测得A(734nm)=0.7±0.02,即得ABTS+工作液。取不同质量浓度(0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mg/mL)的有机酸溶液300 μL加入3.0 mL ABTS+工作液,避光反应6 min,于734 nm处测定吸光度,按下式计算清除率。对照组为Trolox,每份处理做3个平行[18-19]。
ABTS+自由基清除率/%=[1-(A1-A2)/A0]×100
式中:A1为样品溶液的吸光度;A2为用等量无水乙醇代替ABTS+溶液样品的吸光度;A0为用等量无水乙醇代替有机酸溶液样品的吸光度。
1.3.8 羟基自由基清除能力的测定
分别配制4.5 mmol/L水杨酸、4.0 mmol/L FeSO4和8.8 mmol/L H2O2,备用。取0.5 mL不同质量浓度(0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 mg/mL) 玫瑰茄有机酸溶液与1 mL 4.0 mmol/L FeSO4以及1 mL 4.5 mmol/L水杨酸混合均匀,最后加入1.0 mL H2O2启动反应,避光静置30 min,于510 nm下测定吸光度,按下式计算清除率。对照组为Trolox,每份处理做3个平行[20]。
羟基自由基清除率/%=[1-(A1-A2)/A3]×100
式中:A1为0.5 mL样品+1.0 mL FeSO4+1.0 mL水杨酸-乙醇+1.0 mL H2O2在510 nm的吸光度;A2为0.5 mL样品+1.0 mL FeSO4+1.0 mL水杨酸-乙醇+1.0 mL H2O在510 nm的吸光度;A3为0.5 mL蒸馏水+1.0 mL FeSO4+1.0 mL水杨酸-乙醇+1.0 mL H2O2在510 nm的吸光度。
1.4 数据处理
数据和绘图使用IBM SPSS Statistics 25和Origin pro8处理。数据表示为平均值±标准差。使用单因素检验和Duncan分析评估每组平均值之间的差异(P<0.05)。
2 结果与分析
2.1 D301弱碱性阴离子交换树脂吸附效能及再生后的吸附效能
D301树脂柱流出液pH值随上样液体积变化见图1。

图1 D301树脂流出液pH值随上样液体积变化Fig.1 The pH of D301 resin effluent varies with the volume of sample solution
由图1可知,随着上样液体积增加,流出液的pH值先在7~8浮动;当上样液体积总和达到700 mL~800 mL时,流出液pH值开始下降,随后下降趋势加快;当上样液体积达到1 300 mL~1 400 mL时,流出液pH值降至2.3左右。原因是随着上样液体积增加,D301树脂吸附能力逐渐达到饱和,当上样量超过大孔树脂与有机酸分子之间的范德华力时,树脂床层发生泄露,流出液pH值下降[21]。因此上样液体积应控制在800 mL以内。
再生后的D301树脂柱流出液pH值随上样液体积变化见图2。

图2 再生后的D301树脂流出液pH值随上样液体积变化Fig.2 The pH of D301 resin effluent after regeneration varies with the volume of sample solution
由图2可知,随着上样液体积增加,流出液的pH值先在7~8浮动;当上样液体积总和达到350 mL时,流出液pH值开始下降,随后下降趋势明显,说明已经达到泄露点;当上样液体积达到600 mL时,流出液pH值降至2.4左右。可以看出再生后的D301树脂吸附能力仅为初始D301树脂的50%,再生后的D301树脂上样液体积应控制在350 mL以内。
2.2 001×7强酸性氢型阳离子交换树脂吸附效能
001×7树脂柱流出液pH值随上样液体积变化见图3。
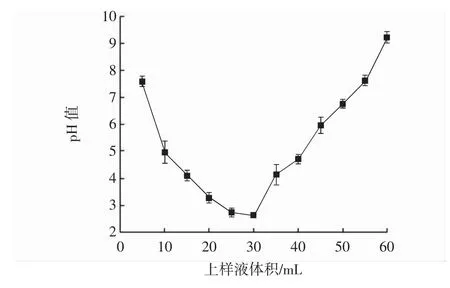
图3 001×7树脂柱流出液pH值随上样液体积变化Fig.3 The pH of 001×7 resin effluent varies with the volume of sample solution
由图3可知,在0~30 mL范围内,随着上样液体积增加,流出液的pH值呈下降趋势降;当上样液体积总和超过30 mL时,流出液pH值开始上升,且当上样液体积总和达到55 mL时,流出液pH值升至7.6。这是因为上样液的主要成分为有机酸钠盐,用001×7型树脂去掉钠离子得到有机酸[22],当上样液体积达到30 mL时,001×7树脂吸附能力达到饱和,导致流出液pH值上升。因此上样液体积应控制在30 mL以内。
再生后的001×7树脂柱流出液pH值随上样液体积变化见图4。

图4 再生后的001×7树脂柱流出液pH值随上样液体积变化Fig.4 The pH of 001×7 resin effluent after regeneration varies with the volume of sample solution
由图4可知,随着上样液体积增加,流出液的pH值呈先下降后上升的趋势;当上样液体积总和达到20 mL时,pH值下降至2.5;继续增加上样液体积,流出液pH值开始上升,且当上样液体积总和达到25 mL时,流出液pH值升至7以上。因此上样液体积应控制在20 mL以内,可以看出再生后的001×7树脂吸附能力与001×7树脂相差不大,可以回收利用。
2.3 玫瑰茄有机酸粉末状样品的SEM结果
玫瑰茄有机酸粉末状样品的形态见图5。
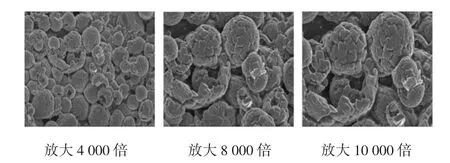
图5 玫瑰茄有机酸粉末状样品的SEM图Fig.5 SEM image of roselle organic acid powder product
由图5可知,有机酸粉末大多呈球形,这是由于料液在喷雾干燥的过程中经过雾化器时会形成微小液滴,在瞬时高温的作用下脱水而保留了液滴球形的形状。有机酸粉末表面粗糙,有少部分呈不规则形状。推测可能是在较高的入口温度条件下,水分快速蒸发,有机酸种类繁多导致形成形状各异的晶体;也可能是喷雾干燥进出口温度差距太大,导致在粉末形成过程中热负荷过高,导致球体破裂[23]。
2.4 玫瑰茄有机酸对DPPH自由基的清除能力
玫瑰茄有机酸对DPPH自由基的清除能力见图6。

图6 玫瑰茄有机酸对DPPH自由基的清除能力Fig.6 DPPH radical scavenging activity of roselle organic acid
由图6可知,在0.10 mg/mL~0.26 mg/mL范围内,对照组清除率均在95%以上,而玫瑰茄有机酸在质量浓度为0.22 mg/mL时,清除率接近对照组,在0.26 mg/mL时清除率达到最大(96.24%)。表明玫瑰茄有机酸中具有能与DPPH自由基所含单电子配对的电子,且有机酸浓度越高,DPPH自由基清除效果越好。
2.5 玫瑰茄有机酸对ABTS+自由基的清除能力
ABTS+自由基同样含有单电子,但不同的有机酸对单电子的清除效果不同,且这种清除效果与有机酸浓度有密切的关系[24]。玫瑰茄有机酸对ABTS+自由基的清除能力见图7。

图7 玫瑰茄有机酸对ABTS+自由基的清除能力Fig.7 ABTS+radical scavenging activity of roselle organic acid
由图7可知,随着有机酸浓度的增加,玫瑰茄有机酸对ABTS+自由基的清除率持续升高,表明玫瑰茄有机酸中具有与ABTS+自由基配对的电子。在质量浓度0.20 mg/mL~1.00 mg/mL范围内,玫瑰茄有机酸和对照组清除率最高可达99.23%和98.77%。
2.6 玫瑰茄有机酸对羟基自由基的清除能力
玫瑰茄有机酸对羟基自由基的清除能力见图8。

图8 玫瑰茄有机酸对羟基自由基的清除能力Fig.8 Hydroxyl radical scavenging activity of roselle organic acid
由图8可知,玫瑰茄有机酸与对照组对羟基自由基的清除率均随着浓度的增加而增加。且在0.40 mg/mL~0.80 mg/mL内,玫瑰茄有机酸对羟基自由基的清除率比对照组强,表明玫瑰茄有机酸对羟基自由基有很强的清除能力。此结果与热阳古·阿布拉等[25]的研究结果类似,研究发现同等浓度下喀什石榴有机酸对羟基自由基清除能力强于抗坏血酸。玫瑰茄有机酸和对照组对羟基自由基清除率最高可达95.77%和92.96%。
3 结论
本研究采用阴离子-阳离子交换柱联合法回收玫瑰茄花色苷纯化过程中的有机酸,测定了树脂吸附效能,并对玫瑰茄有机酸的性质进行了研究。结果表明,D301弱碱性阴离子交换树脂将有机酸交换成为有机酸钠盐的效能较强,001×7强酸性氢型阳离子交换树脂将有机酸钠盐交换成有机酸的效能较低,需进一步试验选取效能更高的树脂将其替换。经扫描电镜观察有机酸粉末发现,样品大多数呈球形,但仍有少部分呈不规则形状。通过玫瑰茄有机酸的体外抗氧化活性试验可知,玫瑰茄有机酸对ABTS+自由基、DPPH自由基、羟基自由基3种自由基都具有良好的清除能力,其抗氧化能力与有机酸浓度呈正相关,最高清除率分别达到99.23%、96.24%、95.77%。
综上所述,可利用阴离子-阳离子交换柱联合法回收玫瑰茄花色苷纯化过程中的有机酸,且回收的有机酸具有较强的体外抗氧化能力,可以为玫瑰茄有机酸功能性产品的开发提供理论依据,促进玫瑰茄有机酸在食品与药品行业的开发与利用。
