燕窝饮料及游离唾液酸对小鼠免疫功能调节作用研究
2022-03-24陈斯玮刘明华邹顺梅杨小会张丹
陈斯玮,刘明华,邹顺梅,杨小会,张丹
(西南医科大学药学院,四川 泸州 646000)
燕窝又名燕根、燕菜、燕蔬菜,为雨燕科(Apodidae)金丝燕属(Collocalia)的几种鸟类动物及多种同属燕类用唾液与绒羽等混合凝结所筑成的巢窝[1-2]。燕窝主产于东南亚,最早由郑和下西洋时带回我国[3]。燕窝按其来源分为屋燕和洞燕,按其质地分为白燕、红燕等,具有丰富的药用价值。现代研究表明[4-6],燕窝可增强免疫功能,有延缓衰老、延年益寿的功效。燕窝酸又名唾液酸,为燕窝主要有效成分,学名N-乙酰神经氨酸,是由燕窝的特征成分唾液酸糖蛋白在一定的酸性条件下水解出的游离唾液酸[7],具有多种生物调节功能,如抗老年痴呆、抗病毒、抗炎症和抑制白细胞的黏附等[8]。蒋林等[9]认为燕窝具有抗病毒、促细胞分裂、改善骨骼强度与真皮厚度、免疫促进等功效,张玫等[10]发现燕窝提取液既能提高小鼠的细胞免疫功能又能提高体液免疫功能。唾液酸是衡量燕窝品质高低的重要指标,也是燕窝中最主要的生物活性成分,将其添加到食品中具有一定的免疫促进功能,但目前尚未见相关研究。
人体多种细胞都可通过胞饮、细胞内吞等方式吸收外源性的游离唾液酸,故直接补充游离唾液酸已成为外源性补充唾液酸的主要方法[11],常见于糖果、婴幼儿奶粉等。国家卫生和计划生育委员会2017年已批准了N-乙酰神经氨酸(唾液酸)作为新食品原料[12]。
为探究食品中游离唾液酸的添加对免疫功能的调节作用,本研究选用燕窝饮料(含有燕窝及游离唾液酸的风味饮品)及游离唾液酸(纯度≥98%),通过免疫相关指标的测定[脾(胸腺)指数、腹腔巨噬细胞吞噬百分率、吞噬指数、半数溶血值HC50、左右耳肿胀度、增殖指数(proliferation index,PI)][13-15],观察其对免疫低下小鼠免疫功能的调节作用,旨在为燕窝饮料及游离唾液酸在营养健康食品领域的开发应用提供科学的试验依据及理论支撑。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与动物
燕窝饮料(批号:20190812,燕窝 10 mg/罐,游离唾液酸11 mg/罐):广州华人爱燕窝有限公司;游离唾液酸(纯度≥98%):西安维特生物科技有限公司;昆明种小白鼠[(18 g~22 g,雌雄各半,合格证号:SCXK(川)2013-017)]:西南医科大学实验动物中心。
1.1.2 试剂
环磷酰胺:江苏恒瑞医药股份有限公司;转移因子胶囊(3 mg):成都利尔药业有限公司;鸡红细胞(chicken red blood cell,CRBC):碧云天生物有限公司;CA蛋白浓度测定试剂盒、Cell Counting Kit-8(CCK-8)试剂盒:碧云天生物技术研究所;RPMI1640培养基:Gibco公司;胎牛血清:杭州四季青公司;Giemsa染液:上海生工生物工程有限公司;刀豆蛋白(ConA)、二甲基亚砜(dimethyl sulfoxide,DMSO):美国Sigma公司。
1.2 试验仪器
BT323S电子天平:德国Sartoriugo公司;GS-15R高速冷冻离心机、MSD97K49微量离心机:美国Beckman公司;SPECTRA MAX190酶标仪:美国MD公司;CO2恒温培养箱:上海一恒医疗器械有限公司;37XFPC光学显微镜:上海光学仪器六厂;WB100-4F恒温水浴箱:江苏奈乐仪器设备制造有限公司。
1.3 方法
1.3.1 免疫低下小鼠脏器指数测定
将84只小鼠随机分为7组,每组12只,分别为阴性对照组、模型对照组、阳性对照及燕窝饮料A剂量组、燕窝饮料B剂量组、游离唾液酸C剂量组、游离唾液酸D剂量组。除阴性对照组外其余6组分别于给药前3 d腹腔注射75 mg/kg新配制的环磷酰胺,连续3 d,制备免疫功能低下小鼠模型[16-17]。然后每天灌胃给药2次,阴性对照组和模型对照组用等体积的0.9%生理盐水,阳性对照组灌胃给予转移因子,以多肽计为3.00 mg/(kg·d),燕窝饮料A剂量组、燕窝饮料B剂量组给予燕窝饮料,游离唾液酸C剂量组、游离唾液酸D剂量组给予游离唾液酸,每天灌胃2次,每次0.2 mL/10 g bw,连续28 d[18-20]。其中,饮料组和游离唾液酸组用量如下。
1)燕窝饮料A剂量组:1.83 mg/(kg·d),相当于成人1罐/d的饮用量;2)燕窝饮料B剂量组:3.67 mg/(kg·d),相当于成人2罐/d的饮用量;3)游离唾液酸C剂量组:12.50 mg/(kg·d),相当于成人75 mg/d的唾液酸;4)游离唾液酸D剂量组:25.00 mg/(kg·d),相当于成人150 mg/d的唾液酸。
末次灌胃后1 h,处死小鼠,剖取脾脏和胸腺,用滤纸吸干脏器表面血污,称重,按下列公式计算脾(胸腺)指数。

1.3.2 小鼠腹腔巨噬细胞吞噬鸡红细胞实验
小鼠分组和给药同1.3.1,于末次给药当日每只小鼠腹腔注射2%淀粉1 mL,24 h后每只小鼠腹腔注射0.5 mL新鲜配制的5%鸡红细胞。处死小鼠,剪开腹部,经腹膜注射生理盐水(normal saline,NS)2 mL,轻揉腹部1 min后,吸出腹腔洗液涂片于载玻片上。将玻片置于37℃,5%CO2培养箱温育30 min,用NS漂洗、晾干,用体积比1∶1的丙酮-甲醇溶液固定2 min。晾干后,涂片Giemsa染色30 min,蒸馏水漂洗,磷酸盐缓冲液分色,晾干。油镜下计数巨噬细胞(macrophages,MØ),每片200个按下式计算巨噬细胞吞噬百分率和吞噬指数。

1.3.3 三硝基氯苯(picryl chloride,PC)诱导小鼠迟发性变态反应
小鼠分组给药同1.3.1,连续灌胃28 d。第22天用刀片给小鼠腹部去毛,范围约9 cm2。用微量进样器取1%PC无水乙醇溶液100 μL,均匀涂抹在剃毛区致敏,并用吹风机吹干。致敏第7天,将1%PC橄榄油溶液30 μL均匀涂抹于每鼠右耳(两面)进行攻击。抗原攻击24 h后,将小鼠脱臼处死,沿耳廓基线剪下左右耳壳,用打孔器于同一部位分别取下直径8 mm的耳片,并称重,按下式计算肿胀度。

1.3.4 血清溶血素形成实验
小鼠分组给药同1.3.1,灌胃28 d后,每只小鼠腹腔注射0.5 mL 5%鸡红细胞致敏。免疫7 d,摘眼球取血并分离血清。取稀释100倍血清1mL加5%鸡红细胞、0.5 mL 10%补体混匀,置37℃恒温水浴箱温浴30 min,取出放在冰水冷却,离心,取上清液,测其吸光度A540,以半数溶血值HC50表示溶血素水平。
HC50=样品A540/半数溶血A540×样品稀释倍数
1.3.5 ConA诱导淋巴细胞转化反应
84只小鼠,分组给药同1.3.1,灌胃28 d,于末次给药24 h后颈椎脱臼处死小鼠,泡入70%酒精,5 min,无菌取脾,放入含抗生素生理盐水的培养皿内。浸泡20 min后将脾脏剪切成2 mm2~3 mm2的小块,用毛玻片研磨碎,然后用200目不锈钢细胞筛过滤,离心后用含10%小牛血清的RPMI1640培养基将细胞调成浓度为3×106mg/mL的细胞悬液。分两孔加入96孔培养板,每孔 90 μL,一孔加入 10 μL 0.1 mg/mL ConA(终浓度为 10 μg/mL)作为实验组,另一孔加入 10 μL培养液作为对照组。培养48 h后每孔加入CCK-8继续培养1 h,酶标仪450 nm波长下检测各孔吸光度A450值,按下列公式计算增殖指数(PI)。

2 结果与分析
2.1 燕窝饮料及游离唾液酸对免疫器官质量的影响
燕窝饮料及游离唾液酸对免疫低下小鼠免疫器官质量的影响见表1。

表1 燕窝饮料及游离唾液酸对免疫低下小鼠免疫器官质量的影响Table 1 Effect of bird's nest beverage and free sialic acid on the weight of immune organs in immunocompromised mice
由表1可知,与阴性对照组比较,模型对照组小鼠胸腺指数、脾指数极显著下降(P<0.01),说明免疫功能低下小鼠模型建立成功。与模型对照组比较,阳性对照及燕窝饮料B剂量组、游离唾液酸C剂量组、游离唾液酸D剂量组能显著提高免疫低下小鼠的胸腺指数和脾指数(P<0.05,P<0.01)。
2.2 燕窝饮料及游离唾液酸对小鼠腹腔巨噬细胞吞噬功能的影响
巨噬细胞吞噬鸡红细胞的情况见图1,燕窝饮料及游离唾液酸对免疫低下小鼠腹腔巨噬细胞吞噬功能的影响见表2。

图1 腹腔巨噬细胞吞噬鸡红细胞的情况Fig.1 Intraperitoneal macrophages phagocytosis of chicken erythrocytes
由图1及表2可知,与阴性对照组比较,模型对照小鼠巨噬细胞吞噬指数及吞噬百分率明显降低(P<0.01)。与模型对照组比较,阳性对照及燕窝饮料B剂量组、游离唾液酸C剂量组、游离唾液酸D剂量组均能升高免疫低下小鼠的腹腔巨噬细胞吞噬指数及吞噬百分率,有显著性差异(P<0.05,P<0.01)。

表2 燕窝饮料及游离唾液酸对免疫低下小鼠腹腔巨噬细胞吞噬功能的影响Table 2 Effect of bird's nest beverage and free sialic acid on phagocytic function of peritoneal macrophages in immunocompromised mice
2.3 燕窝饮料及游离唾液酸对小鼠迟发性变态反应的影响
燕窝饮料及游离唾液酸对免疫低下小鼠迟发性变态反应的影响见表3。
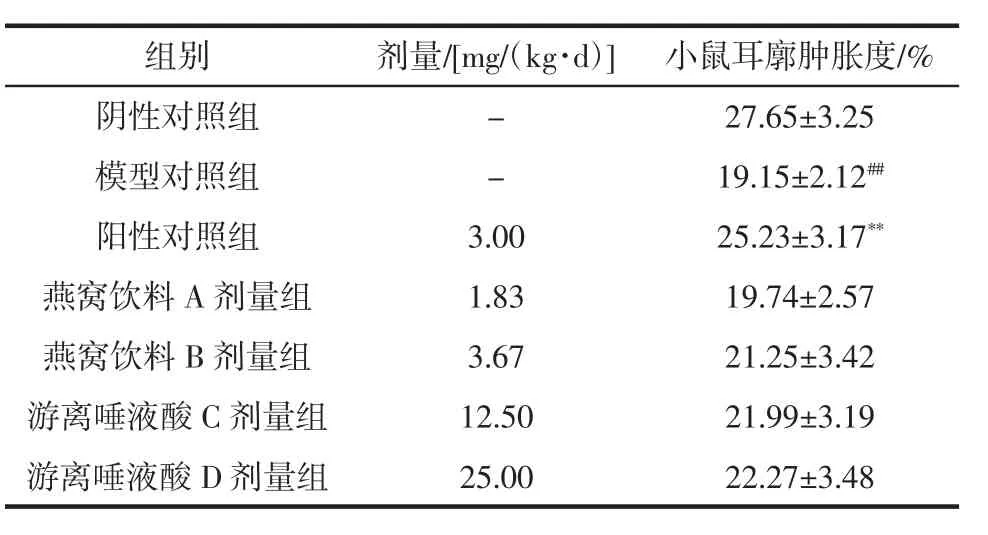
表3 燕窝饮料及游离唾液酸对免疫低下小鼠迟发性变态反应的影响Table 3 Effect of bird's nest beverage and free sialic acid on delayed allergic reaction in immunocompromised mice
由表3可知,与阴性对照组比较,模型对照小鼠耳廓肿胀度极显著降低(P<0.01)。与模型对照组比较,各剂量组免疫低下小鼠的耳廓肿胀度无明显改变,差异无显著性(P>0.05)。
2.4 燕窝饮料及游离唾液酸对小鼠血清溶血素形成的影响
燕窝饮料及游离唾液酸对免疫低下小鼠血清溶血素形成的影响见表4。

表4 燕窝饮料及游离唾液酸对免疫低下小鼠血清溶血素形成的影响Table 4 Effect of bird's nest beverage and free sialic acid on serum hemolysin formation in immunocompromised mice
由表4可知,与阴性对照组比较,模型对照小鼠血清溶血素值下降极显著(P<0.01)。与模型对照组比较,阳性对照及燕窝饮料B剂量组、游离唾液酸C剂量组、游离唾液酸D剂量组免疫低下小鼠的小鼠血清溶血素值升高,差异有显著性(P<0.05,P<0.01),且剂量越大,血清溶血素值越高。
2.5 燕窝饮料及游离唾液酸对ConA诱导的淋巴细胞转化反应的影响
燕窝饮料及游离唾液酸对ConA诱导的小鼠淋巴细胞转化的影响见图2。

图2 燕窝饮料及游离唾液酸对ConA诱导的小鼠淋巴细胞转化的影响Fig.2 Effect of bird's nest beverage and free sialic acid on ConA induced lymphocyte transformation in mice
由图2可知,与阴性对照组比较,模型对照小鼠淋巴细胞转化反应明显下降,差异有极显著性(P<0.01)。与模型对照组比较,阳性对照组与游离唾液酸D剂量组可促进淋巴细胞转化反应,差异有显著性(P<0.05或 P<0.01)。
3 讨论与结论
环磷酰胺常被国内外研究者用于建立小鼠免疫抑制模型,以观察免疫促进药物对免疫功能的影响。免疫器官的脏器系数和单核巨噬细胞的吞噬能力是衡量机体非特异性免疫功能的重要指标,巨噬细胞吞噬百分率和吞噬指数的大小可以反映内皮网状系统吞噬功能的强弱,当细菌、异物等抗原性物质进入机体后,可迅速被单核巨噬系统吞噬和清除。血清溶血素水平可以反应机体内抗体量,反映B淋巴细胞体液免疫功能,在试验中SRBC致敏的动物血清中存在循环抗体lgM和lgG,抗体与SRBC,在体外补体的参与下产生溶血反应,用分光光度计测定溶血程度来反应抗体水平。在免疫系统中,T淋巴细胞经ConA等激活后,转化为淋巴母细胞,可介导细胞免疫应答,并辅助机体针对T细胞依赖性抗原产生体液免疫应答,因此,脾淋巴细胞增殖反应可以作为机体细胞免疫功能的指标之一。
本试验结果显示,燕窝饮料及游离唾液酸均可提高巨噬细胞的吞噬百分率和吞噬指数,可促进小鼠脾淋巴细胞的增殖,并呈现剂量关系。燕窝饮料A剂量组对各项免疫指标均无明显影响;燕窝饮料B剂量组能提高小鼠的胸腺指数和脾指数(P<0.05),提高小鼠的腹腔巨噬细胞吞噬指数及吞噬百分率(P<0.05),升高小鼠血清溶血素含量(P<0.05),对促进小鼠淋巴细胞转化及对小鼠耳廓肿胀度均无影响,具有一定的增强小鼠免疫功能作用;游离唾液酸C剂量组能提高小鼠的胸腺指数和脾指数(P<0.01),提高小鼠的腹腔巨噬细胞吞噬指数及吞噬百分率(P<0.05),升高小鼠血清溶血素含量(P<0.01),对促进小鼠淋巴细胞转化及对小鼠耳廓肿胀度均无影响,具有较明显的增强小鼠免疫功能作用;游离唾液酸D剂量组除能提高小鼠的胸腺指数和脾指数(P<0.01),提高小鼠的腹腔巨噬细胞吞噬指数及吞噬百分率(P<0.05),升高小鼠血清溶血素含量(P<0.01)外,还能促进小鼠淋巴细胞转化反应(P<0.05),仍对小鼠的耳廓肿胀度无影响,具有更明显的增强小鼠免疫功能作用。
综上所述,在食品或饮料中添加游离唾液酸对小鼠的免疫功能有显著调节作用,且随着剂量的增加,作用越明显。
