硫辛酸合成酶低表达对小鼠抗氧化能力的影响
2022-03-24严森森吕梦迪杨学思陶映君徐光翠赵英政
严森森吕梦迪杨学思陶映君徐光翠赵英政
(新乡医学院公共卫生学院,河南 新乡 453003)
机体内抗氧化系统能清除由于内源或外源刺激生成的自由基,维持自由基在机体内的平衡。然而,当自由基过量产生或机体对其清除能力下降时,过量的自由基会损伤生物大分子,损害细胞、组织及器官,导致氧化损伤。研究表明肿瘤、糖尿病及心血管等疾病发病均与氧化损伤有关[1-3]。
硫辛酸为一种生成于线粒体的强抗氧化剂,可以清除自由基,减缓机体衰老,并能还原再生维生素C,维生素E和谷胱甘肽等其他抗氧化剂[4]。临床上α-硫辛酸已用于减轻糖尿病患者外周神经病变[5]。硫辛酸合成酶(lipoic acid synthase,LIAS)是合成硫辛酸的关键酶[6]。本研究鉴定了应用Cre-Loxp技术修饰LIAS基因的3'-UTR区域,使硫辛酸合成酶基因体内低表达的小鼠模型,并检测了小鼠抗氧化能力。应用该小鼠模型将有利于探讨氧化应激相关疾病的发病机制及进行抗氧化治疗效果评估。
1 材料与方法
1.1 材料
1.1.1 实验动物
10只6周龄的SPF级雄性以C57BLKS/J小鼠为遗传背景的LIAS基因3'-UTR区域修饰的Liasloxp/loxp小鼠,体重19~21 g,由北卡罗来纳大学教授赠送。10只6周龄SPF级雌性E2a-Cre小鼠购自赛业生物科技有限公司【SCXK(苏)2018-0003】。Liasloxp/loxp小鼠与E2a-Cre小鼠交配后将使LIAS基因的3'-UTR表达不稳定,从而使LIAS表达降低。从Liasloxp/loxp小鼠与E2a-Cre小鼠的子代小鼠中鉴定出LiasL/+小鼠并进一步繁殖、基因型鉴定。随机各选择10只8周龄SPF级雄性LiasL/L和Lias+/+小鼠,体重为(22±2)g,用于抗氧化相关指标检测。小鼠均饲养于新乡医学院公共卫生学院具有独立通风系统(IVC)的动物房【SYXK(豫)2016-0006】。室内温度控制在20~25℃,相对湿度60%~70%,明暗周期12 h/12 h。饲养期间小鼠自由进食饮水(上海斯莱康提供SPF级小鼠饲料)。动物实验所有操作均遵守新乡医学院动物研究伦理规范(审批号:XYLL-2017087)。
1.1.2 主要试剂与仪器
DNA提取试剂盒及PCR引物由上海生工提供,GoTaq® Master Mixes购自Promega(M7123);RIPA细胞/组织裂解液(北京索莱宝科技有限公司),BCA蛋白浓度测定试剂盒(上海碧云天生物科技公司),一抗兔多抗LIAS抗体(Proteintech,美国),一抗兔单抗细胞色素C氧化酶(cytochromecoxidase,COX)亚基Ⅳ(COX IV)(Cell Signaling,美国)、二抗山羊抗兔IgG(H+L)-HRP(Proteintech,美国);丙二醛(MDA)试剂盒(上海碧云天生物科技公司),超氧化物歧化酶(SOD)试剂盒(上海碧云天生物科技公司),过氧化氢酶(CAT)试剂盒(北京索莱宝科技有限公司);凝胶电泳仪(Bio-Rad,美国),化学发光成像系统(ProteinSimple,美国),多功能酶标仪(Thermo,美国)。
1.2 方法
1.2.1 PCR扩增技术鉴定小鼠基因型
剪3~5 mm小鼠尾巴放入PCR管中,4℃保存,用试剂盒提取基因组DNA,作为PCR模板。采用上游引物5′-CTAAAGTGTAGCCAAGCCCT-3′,下游引物:5′-CTTCTCTGACTGCAGATCCT-3′,鉴定修饰的 LIAS 基因;采用上游引物 5′-CTAAAGTGTAGCCAAGCCCT-3′,下 游 引 物:5′-GTCACGGAGTCCATATGTGT-3′,鉴定野生型WT基因。PCR反应体系:2×EasyTaq SuperMix 6.25μL,超纯水3.05μL,浓度为10.0μmol/L的下游引物与下游引物各0.3μL,DNA模板0.5μL。PCR反应条件为:预变性94℃,5 min;变性94℃,30 s;退火60℃,30 s;延伸72℃,30 s;共进行34个循环;终延伸72℃,10 min。取PCR反应终产物8.0μL,在1.5%琼脂糖凝胶电泳,电压110 V,时间25 min。采用凝胶成像分析系统观察分析条带。野生型产生500 bp目标片段,而LIAS修饰基因产生300 bp目标片段。
1.2.2 动物处理和样品采集
对选择的LiasL/L和Lias+/+小鼠称重后,以4%异氟烷麻醉,股动脉采血后处死动物;分离小鼠肺、肾、肝并称重。将左肺下叶,左侧肾及约5.0 mg肝组织置于4%多聚甲醛中固定,剩余肺、肝组织以及右肾用于检测LIAS蛋白表达及抗氧化能力相关指标。将采集的外周血室温静置2 h后,2000 rpm离心5 min分离血清,用于检测总抗氧化能力。所有样品均保存于-80℃。
1.2.3 Western Blot检测LIAS蛋白表达
采用蛋白印迹法检测小鼠肺、肾、肝组织LIAS蛋白表达水平。3种组织各称取20 mg,剪碎,加入200μL RIPA裂解液和2.0μL的PMSF,充分混匀,然后用组织破碎仪70 Hz匀浆3~5 min。将匀浆液4℃、11 304 rpm离心10~15 min,取上清液采用BCA法定量总蛋白。用浓度为12%的分离胶进行电泳,PVDF膜进行转膜,5%脱脂牛奶封闭2 h,封闭后加一抗兔多抗LIAS抗体(1∶2000)、COXIV(1∶2000)室温下孵育2 h。用TBST缓冲液洗涤3次,每次10 min,加入二抗山羊抗兔IgG(H+L)-HRP(1∶4000),37℃孵育1 h,TBST缓冲液洗涤3次,每次10 min。使用AI600凝胶成像系统显像,用Image J软件进行分析,测定目的蛋白与相应内参的灰度比值。以COXIV为内参蛋白,比较LIAS蛋白的相对表达水平。
1.2.4 免疫组化检测LIAS蛋白表达
肺、肾、肝组织固定24 h后,石蜡包埋,切片脱蜡至水,3%双氧水封闭,用柠檬酸缓冲液进行微波修复,冷却。3%BSA室温封闭30 min,加LIAS抗体(1∶200),4℃过夜。之后用PBS洗涤3次,每次5 min。加入二抗山羊抗兔IgG(H+L)-HRP(1∶200),室温孵育50 min。PBS洗涤3次,每次5 min。加DAB显色,在显微镜下观察终止显色。用苏木素轻微复染,脱水、透明、封片,在光镜下观察。苏木素染细胞核为蓝色,DAB显出的阳性表达为棕黄色。
1.2.5 抗氧化能力检测
用总抗氧化能力(total antioxidant capacity,TAC)检测试剂盒(美国Cell Biolabs公司)检测小鼠血清总抗氧化能力,采用Cu2+还原法用酶标仪测定在490 nm波长下吸光度,结果以尿酸当量(uric acid equivalents,UAE)表示血清TAC含量;肺、肝和肾组织测定总蛋白后,采用比色法试剂盒检测超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)活性以及丙二醛(malonaldehyde,MDA)含量,分别在560、240及532 nm波长处用酶标仪测量吸光度。所有检测的操作均按照试剂盒说明书进行。
1.3 统计学分析
所有数据采用SPSS 19.0及GraphPad Prism 8进行处理。正态分布数值变量资料以平均值±标准差(±s)表示。两组间比较方差齐时采用t检验,方差不齐时采用t′检验,检验水准α=0.05。
2 结果
2.1 基因型鉴定
如图1所示。野生型(Lias+/+)小鼠仅500 bp显示出条带,而杂合子(Lias+/-)小鼠分别在500 bp和300 bp显示出两个条带。纯合子(LiasL/L)小鼠仅在300 bp处产生目的条带。阴性对照无条带显示。

图1 3种小鼠基因型鉴定电泳图Figure 1 Electrophoretic map for genotyping in three genotype mice
2.2 Lias+/+和LiasL/L小鼠体重及其脏器重比较
与Lias+/+组小鼠比较,LiasL/L组小鼠体重、肺重及肾重无显著性差别(P>0.05),而肝重量显著性升高(P<0.05)(见图2)。

图2 Lias+/+和LiasL/L小鼠体重及其脏器重比较Figure 2 Comparison of the body weight and organ weight between Lias+/+and LiasL/L mice
2.3 Lias+/+和LiasL/L小鼠肺、肾及肝中LIAS蛋白的表达
2.3.1 免疫组化结果
如图3A所示。与野生型Lias+/+小鼠比较,LiasL/L小鼠肺泡间隔出现淋巴细胞的浸润;LiasL/L小鼠出现肾间质炎症细胞浸润,肾小球肥大、系膜细胞和系膜基质增多等病理学改变;LiasL/L小鼠肝细胞内多呈大泡样混合型脂滴,伴散在炎性细胞浸润。如图3B、3C、3D所示。与Lias+/+小鼠比较,LiasL/L小鼠肺及肾中LIAS蛋白表达量降低,差异有显著性(P<0.05);两组小鼠肝中LIAS蛋白表达量无显著性差异(P>0.05)。
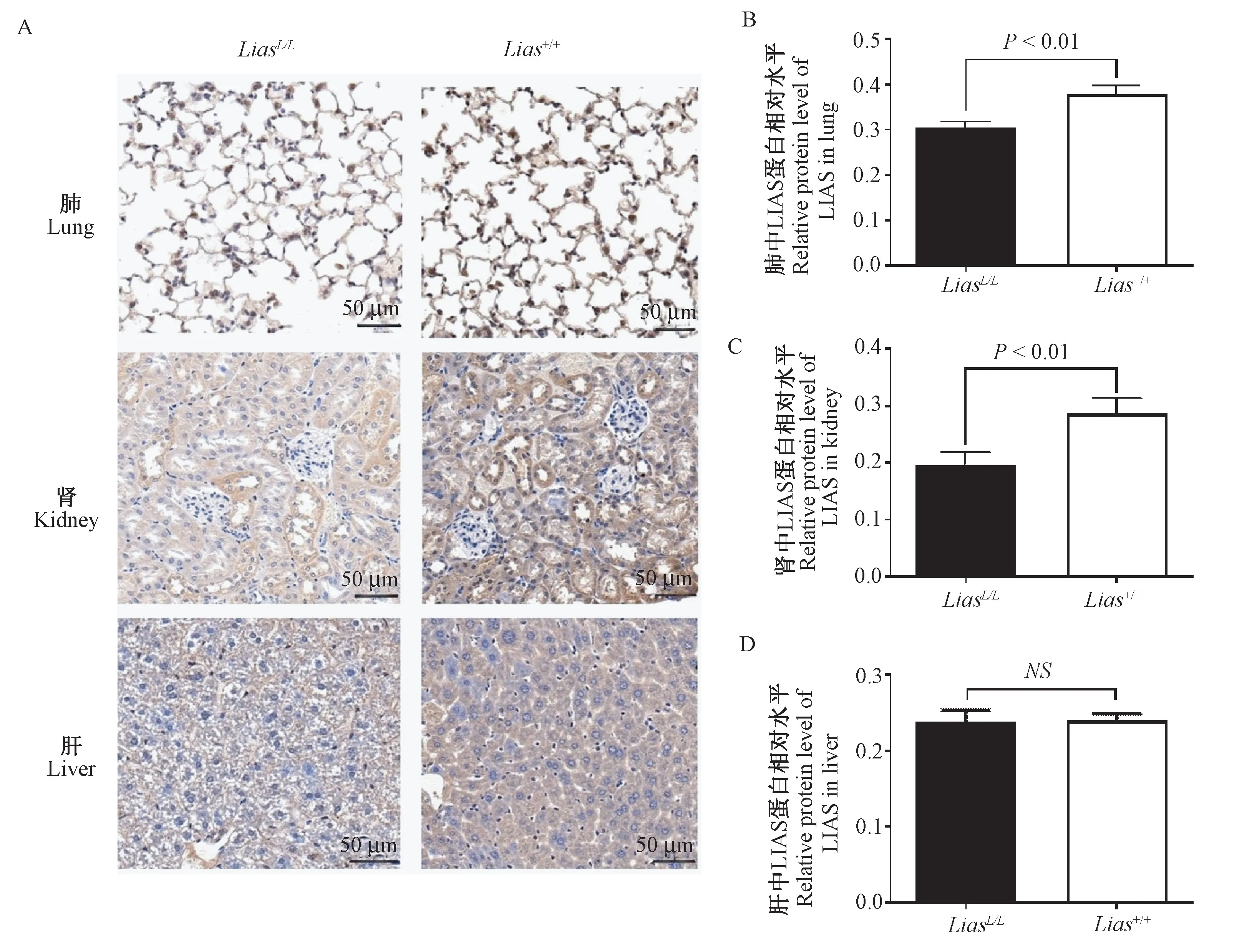
图3 Lias+/+和LiasL/L小鼠肺、肾及肝中LIAS蛋白表达的免疫组化结果Figure 3 LIASprotein expression of lungs,kidneys and livers in Lias+/+and LiasL/L mice by immunohistochemical staining
2.3.2 Western Blot检测结果
结果如图4所示:与Lias+/+组小鼠比较,LiasL/L组小鼠肺、肾及肝组织中LIAS蛋白表达均显著降低(P<0.05)。
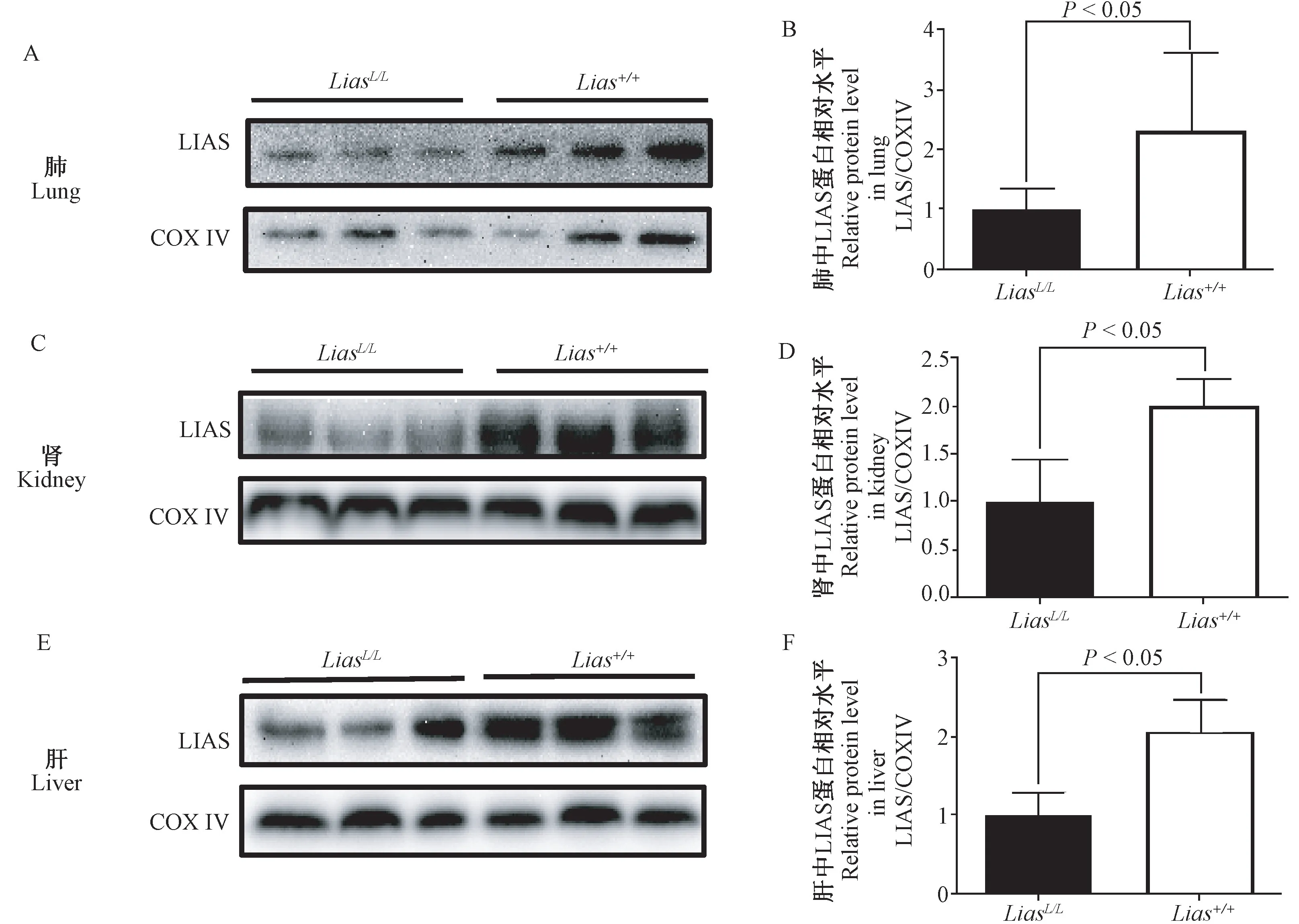
图4 Lias+/+和LiasL/L小鼠肺、肾及肝中LIAS蛋白表达的Western Blot检测结果Figure 4 Expression of LIASin lungs,kidneys and livers of Lias+/+and LiasL/L mice by Western Blot
2.4 LIAS低表达对小鼠抗氧化能力的影响
与Lias+/+组小鼠比较,LiasL/L组小鼠血清中TAC含量显著性降低(P<0.05);与Lias+/+小鼠比较,LiasL/L小鼠肺、肾及肝组织中CAT、SOD水平均降低,MDA含量增高,差异均具有显著性(P<0.05)(见图5)。

图5 LIAS低表达对小鼠抗氧化能力的影响Figure 5 Effects of lower expression of LIASon antioxidant capacity in LiasL/L mice
3 讨论
培育和建立疾病动物模型是深入研究疾病发生发展机制的重要手段,有助于认识疾病发生发展规律。本研究通过Cre-Loxp技术建立了内源性硫辛酸合成酶基因低表达的氧化损伤LiasL/L小鼠模型,该特性能够在子代中稳定遗传。目前在抗氧化相关研究中主要是通过化学物刺激或手术干预的方式来构建氧化损伤模型[7-8]。与这些造模方式不同,本研究建立的小鼠模型造成的氧化损伤是内源性的,可以持续存在,能够保持动物模型的相对稳定;此外,该小鼠模型属于遗传损伤模型,通过繁殖易于获得。
本研究通过Western Blot及免疫组化方法测定肺、肾及肝中LIAS蛋白的表达水平。结果发现除小鼠肝免疫组化灰度值分析结果外,LiasL/L小鼠较野生型小鼠肺、肾及肝组织中LIAS蛋白表达均降低。这些结果表明在Cre工具小鼠提供的CRE酶的作用下剪切了Lias基因启动子区域Loxp位点,导致Lias基因在全身各器官的低表达。实验动物体重、脏器重是动物实验中重要的观察指标,有助于衡量动物生长发育是否发育健康的重要依据[9]。本研究结果显示,与Lias+/+小鼠比较,LiasL/L小鼠体重、肺重及肾重无显著差异,而LiasL/L小鼠肝重显著增加,表明LIAS低表达可能导致了小鼠肝损伤。对免疫组化结果分析还发现,与Lias+/+小鼠比较,LiasL/L小鼠肺泡间隔有明显淋巴细胞浸润,显示出炎症表现;Lias+/+小鼠肾组织结构完整,无明显病理学改变;LiasL/L小鼠出现肾间质炎症细胞浸润,肾小球肥大、系膜细胞和系膜基质增多等病理学改变。这些结果表明在LiasL/L小鼠中LIAS基因低表达可对小鼠脏器造成了不同程度的损伤。
在线粒体内生成的硫辛酸具有强抗氧化作用。已有研究证明补充外源硫辛酸可增加细胞内抗氧化剂SOD、GSH、维生素C水平[10-12]。本研究进一步探讨了LIAS低表达小鼠抗氧化能力的改变。通过Cu2+还原法检测机体血清中总抗氧化能力,结果发现与Lias+/+小鼠相比,LiasL/L小鼠外周血TAC水平显著性降低(P<0.05),表明内源性LIAS低表达降低了动物的整体抗氧化能力。LiasL/L小鼠肺、肾、肝中SOD、CAT酶活性降低,MDA水平升高。这些结果表明LiasL/L小鼠各脏器抗氧化能力降低,并产生了氧化损伤。本研究还发现LiasL/L小鼠肝细胞中存在脂肪堆积,肝重增加可能与脂肪肝有关。有研究表明氧化应激及其导致脂质过氧化被认为脂肪肝发生的有害因素[13-15]。因此,推测Lias基因低表达导致的抗氧化能力降低,清除内源自由基能力下降,过量自由基对肝细胞产生氧化损伤。LiasL/L小鼠模型也可应用于非酒精性肝损伤的相关研究。
综上所述,本研究建立的LiasL/L小鼠具有较低的抗氧化水平,导致机体肺、肾及肝的氧化损伤。LiasL/L小鼠为一种新型的氧化损伤小鼠模型,可进一步应用于常见慢性疾病如糖尿病、动脉粥样硬化等疾病中氧化应激机制对疾病发生发展影响的研究以及应用于抗氧化剂抗氧化干预效果评价的研究。应用该新模型也有助于筛查新的抗氧化干预靶点,从而改善氧化应激相关疾病的治疗干预策略。
