慈苓化浊颗粒对痛风患者肠道微生物的影响
2022-03-24贾二涛姜毓楷何思慧张剑勇
贾二涛,姜毓楷,何思慧,张剑勇
(1.深圳市中医院,广东深圳 518033;2.广州中医药大学第四临床医学院,广东深圳 518033;3.南京中医药大学附属深圳市中医院,广东深圳 518033)
痛风是由于嘌呤代谢紊乱和(或)尿酸排泄减少,单钠尿酸盐(monosodium urate,MSU)沉积所致的晶体相关性关节病,是临床常见的风湿病。痛风在我国的总体患病率约为1.1%[1],近年来随着我国人民生活水平的提高以及饮食结构和生活习惯的改变,痛风患病率呈明显上升趋势,且发病年龄呈年轻化趋势。高尿酸血症是导致痛风发作的直接原因,其产生的机制包括尿酸(uric acid,UA)排泄障碍或生成增多,UA升高的另一个途径是通过摄入和外源性吸收富含嘌呤的食物。肉类摄入会使痛风风险增加21%,海鲜摄入会使痛风风险增加7%[2]。肠道为嘌呤吸收的主要器官,通过肠道排泄的UA比例为30%~40%[3]。因此,定植在人体肠道的微生物对UA的作用引起了人们的关注[4]。前期临床试验证明了慈苓化浊颗粒能够降低痛风患者血中的UA水平[5]。然而,慈苓化浊颗粒降尿酸的相关机制尚不明确。因此,本研究开展了基于肠道菌群探讨慈苓化浊颗粒降尿酸的作用机制。现将研究结果报道如下。
1 对象与方法
1.1 研究对象选取2020年11月至2021年4月在深圳市中医院风湿科门诊或病房接受治疗并明确诊断为痛风的患者,共30例。本研究获得深圳市中医院伦理委员会的审核批准(批件号:K2020-020),并且所有患者均签署了知情同意书。
1.2 病例选择标准
1.2.1 纳入标准①符合2015年美国风湿病学会/欧洲抗风湿联盟的痛风分类标准[6],并且痛风病程≤3年;②年龄18~70岁,男女不限;③入组前2个月未使用抗生素、微生态活菌制剂等;④能接受并完成相关治疗、观察和检查,自愿参加本研究并签署知情同意书的患者。
1.2.2 排除标准符合下述任意条件者,应予以排除:①由肾脏病、血液病,或服用某些药物、肿瘤放化疗、遗传因素等原因引起的继发性痛风患者;②有严重和不稳定的心脑血管疾病(如不稳定性心绞痛、冠状血管再生、大脑血管再生、短暂性脑缺血发作、充血性心力衰竭等)、肝功能异常[谷丙转氨酶(ALT)或谷草转氨酶(AST)≥2倍正常值上限]、肾功能不全、造血系统疾病的患者;③患有精神性疾病,无自知力,无法确切表达或不能按时服药的患者;④过敏体质及对本研究用药过敏的患者;⑤存在严重肛周疾病、直肠狭窄等肠道病变的患者;⑥妊娠期、哺乳期及准备妊娠、不愿避孕的患者;⑦前3个月接受过其他临床试验的患者。
1.3 治疗方案治疗期间要求患者低嘌呤饮食,禁止食用动物内脏(尤其是脑、肝、肾)、饮酒、高果糖谷物糖浆的饮料(如汽水、果汁)、益生菌及相关的食物或药物(如酸奶、金双歧等)。在此基础上,给予慈苓化浊颗粒口服治疗。用法:慈苓化浊颗粒(为深圳市中医院中药协定方制成的复方中药颗粒剂,由江阴天江药业股份有限公司生产,产品批号为1306302;方药组成:土茯苓45 g,川萆薢30 g,秦艽15 g,山慈菇10 g,赤芍10 g,川牛膝10 g,山茱萸6 g),每日1剂,加200 mL开水并搅拌均匀,分2次温服。连续服用2周。
1.4 观察指标
1.4.1 一般资料情况包括患者的性别、年龄、病程等信息。
1.4.2 实验室生化指标治疗前后分别检测患者的血肌酐(Cr)、尿酸(UA)、空腹血糖(FPG)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)水平。各项实验室指标的检测由深圳市中医院检验科统一完成。
1.4.3 粪便标本的采集和检测
1.4.3.1 标本采集 向受试者提前发放粪便采样管并介绍取样方法及注意事项,采用自然排便法,使用采样管在粪便表面均匀涂抹,最小采样量为米粒大小粪便(约1 g)。如粪便为水样便,则在残渣较多处取固体样本,尽量避免尿液、马桶壁等对粪便样本的污染。粪便标本冻存于-80℃低温冰箱中待测。
1.4.3.2 肠道菌群的检测 使用十六烷基三甲基溴化铵法(CTAB)提取样本微生物的基因组DNA,提取的所有DNA均通过琼脂糖凝胶电泳法进行分离,并使用Qubit进行基因文库定量,使用MPS(massively parallel sequencing)Illumina技术对基因组进行测序,通过插入大小为350 bp的配对末端文库来构建基因文库,后使用Illumina NovaSeq6000测序系统和PE150策略对350 bp文库进行测序。
1.4.3.3 肠道菌群的分析 (1)Alpha多样性分析:指特定群落或样品组内的物种多样性,本研究采用Observed Species(Obs)以及Shannon指数来估算群落中的物种多样性,指数越大,说明生物多样性越高。(2)Beta多样性分析:指群落之间的物种多样性,用以衡量群落之间的差别,本研究采用PcoA分析(principal co-ordinates analysis)进一步展示样品组间的物种多样性差异,相似度越高,距离越短,则2组之间的菌群越相似。(3)组间群落差异分析:本研究采用线性判别分析法(LDA effects size,LEfSe)分析组间菌群差异,从而找出组间在丰度上有显著差异的菌种。
1.5 统计方法采用IBM SPSS Statistic 26.0软件进行数据的统计分析。计量资料用均数±标准差(±s)表示。自身治疗前后比较,若服从正态分布,采用配对t检验;若不服从正态分布,采用Wilcoxon配对秩和检验。肠道菌群治疗前后群落差异分析采用线性判别分析,该分析首先使用非参数Kruskal-Wallis秩和检验检测不同分组间丰度差异显著的物种,然后使用Wilcoxon秩和检验验证上一步的差异物种在不同组间的子分组中的差异一致性,最后采用线性回归分析来估算每个组分(物种)丰度对差异效果影响的大小,LDA score默认预设值为2.0。以P<0.05表示差异有统计学意义。
2 结果
2.1 一般资料本研究排除2例失访患者后,最终纳入28例痛风患者。其中,男性27例,女1例;年龄最小20岁,最大68岁,平均年龄(30.71±9.44)岁。
2.2 治疗前后各项实验室生化指标比较表1结果显示:治疗后,患者的UA和TG水平均显著低于治疗前(P<0.01),而治疗前后的Cr、FPG、TC、HDL-C、LDL-C水平比较,差异均无统计学意义(P>0.05)。
表1 28例痛风患者治疗前后各项实验室生化指标比较Table 1 Comparison of laboratory biochemical indexes of 28 patients with gout before and after treatment (±s,分)

表1 28例痛风患者治疗前后各项实验室生化指标比较Table 1 Comparison of laboratory biochemical indexes of 28 patients with gout before and after treatment (±s,分)
①P<0.01,与治疗前比较
观察指标UA/(μmol·L-1)Cr/(μmol·L-1)FPG/(mmol·L-1)TG/(mmol·L-1)TC/(mmol·L-1)HDL-C/(mmol·L-1)LDL-C/(mmol·L-1)P值0.000 0.277 0.645 0.001 0.942 0.457 0.420治疗前569.91±79.73 90.27±11.75 5.41±0.67 2.61±1.15 4.58±0.83 1.05±0.18 3.30±1.05治疗后482.68±70.72①87.95±9.121 5.33±0.40 1.91±0.74①4.59±0.76 1.07±0.15 3.16±0.72 t值5.869 1.117 0.467 3.898-0.073-0.759 0.823
2.3 肠道微生物比较
2.3.1 治疗前后肠道微生物Alpha多样性比较经慈苓化浊颗粒治疗后,患者的Obs和Shannon指数与治疗前比较,差异均无统计学意义(P>0.05),表明治疗后肠道菌群的生物多样性与治疗前无显著性差异,结果见图1。

图1 慈苓化浊颗粒治疗痛风患者治疗前(A)与治疗后(B)的Alpha多样性分析Figure 1 Alpha biodiversity analysis for gout patients before treatment(A)and after treatment(B)
2.3.2 治疗前后肠道微生物Beta多样性比较经PcoA分析,痛风患者治疗后的菌群结构与治疗前比较,差异无统计学意义(P>0.05)。结果见图2。
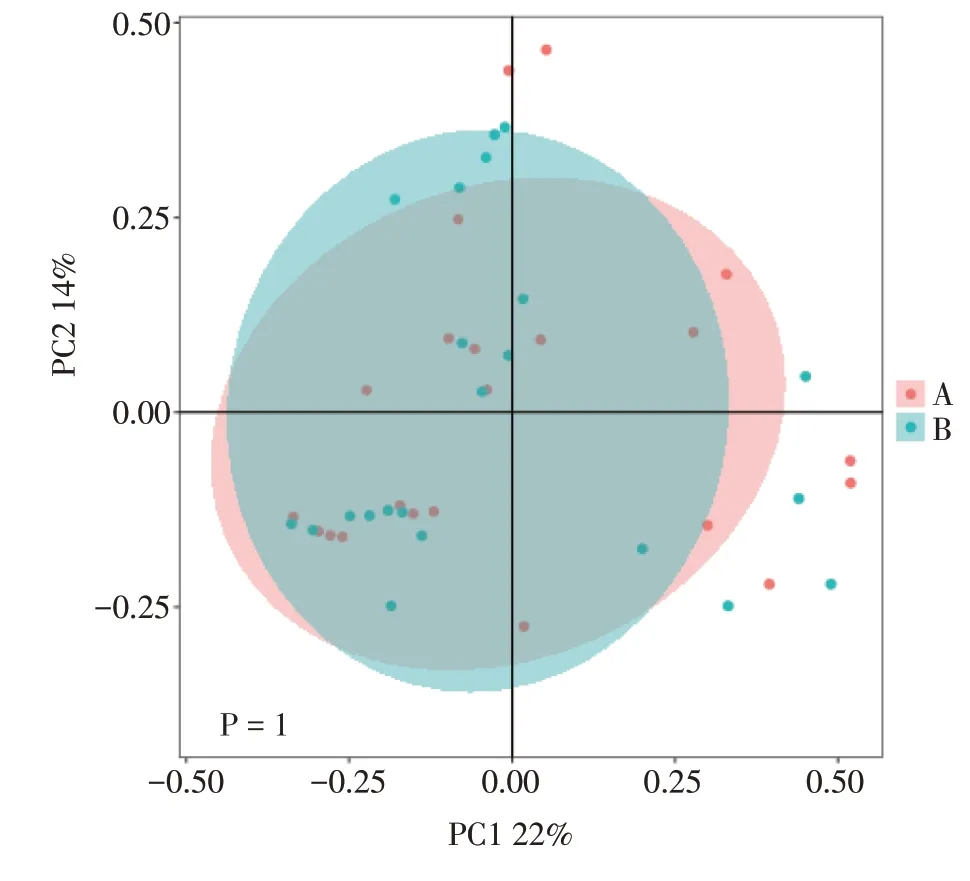
图2 慈苓化浊颗粒治疗痛风患者治疗前(A)与治疗后(B)的PcoA分析Figure 2 PcoA analysis for gout patients before treatment(A)and after treatment(B)
2.3.3 治疗前后肠道微生物LEfSe差异分析经LEfSe分析,治疗前痛风患者的放线菌纲、双歧杆菌科、双歧杆菌属、韦荣球菌科、魏斯氏菌属等菌属以及治疗后的瘤胃球菌属在2组物种丰度差异中起到重要的作用(图3)。进一步统计2组有显著差异菌群的LDA分值,瘤胃球菌属富集于治疗后的样本中,放线菌纲、双歧杆菌属、韦荣球菌科、魏斯氏菌属等菌属富集于治疗前的样本中(图4)。

图3 慈苓化浊颗粒治疗痛风患者治疗前(A)与治疗后(B)的LEfSe分析Figure 3 LEfSe analysis for gout patients before treatment(A)and after treatment(B)

图4 慈苓化浊颗粒治疗痛风患者治疗前(A)与治疗后(B)的LEfSe分析Figure 4 LEfSe analysis for gout patients before treatment(A)and after treatment(B)
3 讨论
高尿酸血症或痛风患者存在肠道菌群失调现象,这个结论是肯定的。最近的一项研究表明,高尿酸血症的发病机制与肠道微生物相关[7],但肠道菌群的具体发病机制尚不清楚。一些研究报告了痛风患者肠道微生物组的改变[8],如表达尿囊素酶基因的肠道细菌显著减少[9],表明改变的肠道微生物群可能与痛风有关,可能有助于区分痛风患者与健康人群,并作为疾病治疗的新目标[10]。研究[11]发现,发酵乳杆菌JL-3通过降解尿酸以降低小鼠血清尿酸水平,与对照组比较,血尿酸降低31.3%。既往研究[12]发现,某些含有尿酸溶解能力的益生菌可用于帮助预防动物中氧嗪酸诱导的高尿酸血症。同样,Wang H等[13]已发现有潜在的益生菌可通过减少肠道肌苷来改善果糖引起的高尿酸血症。
朱丹溪在《格致余论》中认为,本病乃“瘀浊凝涩”所致,由于过食膏粱厚味,浊邪凝滞,阻滞经络,日久化热;或因脾失健运,升清降浊无权,水谷不化,生成浊毒,滞留血中,而致湿、痰、热、瘀等病理产物阻碍气机,流注关节,气血凝滞,运行不畅,闭阻不通,“不通则痛”而引发本病。因此,朱良春提出痛风为“浊瘀痹”。慈苓化浊颗粒由土茯苓、川萆薢、秦艽、山慈菇、赤芍、川牛膝、山茱萸等中药组成,具有祛浊化瘀功效。本研究发现,经慈苓化浊颗粒治疗后与治疗前相比,痛风患者在菌群结构上无显著性差异,但是瘤胃球菌属富集于治疗后的样本中,放线菌纲、双歧杆菌属、韦荣球菌科、魏斯氏菌属等菌属富集于治疗前的样本中。因此,慈苓化浊颗粒可能通过改变肠道微生物物种丰度以降低血尿酸,但具体的作用机制仍有待进一步深入研究。
综上所述,慈苓化浊颗粒可有效治疗痛风,而通过改变肠道微生物物种丰度以降低血尿酸可能是其作用机制之一。
