酶消解-单颗粒电感耦合等离子体质谱法测定农产品中纳米铂颗粒
2022-03-23刘天豪谭鑫源彭宇晴杜实之周耀渝
刘 欣 刘天豪 罗 琳 谭鑫源 彭宇晴 王 强 杜实之 周耀渝* 杨 远*
(1.湖南农业大学 资源环境学院,长沙 410128; 2.中南大学 化学化工学院,水环境与农产品安全湖南省重点实验室,长沙 410083)
纳米技术作为21世纪经济发展的主要驱动力之一,开拓了广阔的市场空间,巨大的市场需求驱动着各种新型纳米材料研发、投入、生产及使用。据报道,当前已有超过1 800多种纳米材料应用在人们日常生活和生产中,其中应用最多的是金属纳米颗粒(Metallic nanoparticle,MNPs),所占比例约为37%[1]。在众多种类的MNPs中,PtNPs是一种商业化应用较为广泛的纳米材料。目前已广泛应用于汽车尾气催化剂、硝酸生产、肿瘤医药和生化传感器等领域,各种新兴的纳米材料在环境中的积累可能会给人类生活健康带来影响[2]。研究已证实PtNPs释放进入到环境中。汽车尾气催化剂的铂排放量主要以颗粒形式排放,颗粒大小从25 nm到300 nm不等[3]。研究人员在城市公路尘土、路边土壤、植被及沉积物等环境介质中均已检测到高含量Pt元素。以PtNPs为主的MNPs正通过污泥回用、污水灌溉、化肥和农药施用、大气沉降、工厂排放、固体废弃物填埋等途径进入到农用灌溉水中农田土壤中。水土环境中PtNPs被农作物吸收、累积,并通过食物链放大传递给人类,对人体健康造成潜在威胁。
阐释PtNPs等MNPs在农作物体内的吸收、转运和生物累积规律和特征,对于客观评价农产品金属纳米毒性效应至关重要[4]。因此,开发可靠的农产品中高灵敏度MNPs快速分析技术是非常有必要的。由于PtNPs具有超细尺寸的特性,其在植物体内中定量分析及颗粒分布不能应用传统无机元素分析方法(如ICP-MS、ICP-OES或AAS等)[5-6]。与常规污染物相比,PtNPs的表征应是多参数的表征,不仅需表征PtNPs的成分和浓度,还应考虑对PtNPs的特性进行表征(如粒度分布、颗粒组成和纳米颗粒浓度等)。传统表征纳米颗粒的技术如动态光散射(DLS)、纳米追踪技术(NTA)和电子显微镜(EM)由于其灵敏度较低(检出限一般为mg/L级别),难以应用于实际环境样品中MNPs的表征。目前流场分离(FFF)、毛细管电泳(CE)、流动色谱(HDC)和反相色谱(RP-HPLC)等分离手段通常与ICP-MS联用,均可用于MNPs的表征[7]。另一方面,单颗粒-电感耦合等离子体质谱法(Single particle ICP-MS,SP-ICP-MS)是近年来发展起来的一种表征环境样品中低浓度金属基纳米颗粒的高灵敏度分析方法[8-11]。该方法能够同时提供MNPs 粒径分布、纳米颗粒浓度和纳米颗粒质量浓度等信息,该方法的检出限可达到亚ng/L级别,为农产品中MNPs的准确测定提供了可行性。
将水体中MNPs定量分析技术应用在植物介质仍具有挑战性。植物组织中MNPs分析的难点在于需保证植物组织中提取出 MNPs的自有性质(如粒径、形貌等)不发生变化,而且需要高灵敏度的技术对MNPs进行表征。酶消解技术能够在适宜的稳定及温和的pH值下将复杂基体中MNPs进行分离。研究人员通过优化不同植物介质中 MNPs 的提取条件,采用 Macerozyme R-10 酶已成功提取植物样品中MNPs(如AgNPs、AuNPs 和TiO2NPs等)[12-15]。
因此,本研究通过优化酶消解参数,采用酶消解技术将农产品中PtNPs释放出来,结合SP-ICP-MS技术,建立了农产品中PtNPs定量分析方法,为研究农产品中PtNPs的纳米风险评估提供可靠的分析方法。
1 实验部分
1.1 材料与试剂
实验试剂:尺寸为30 nm和50 nm的PtNPs悬浮液(以浓度为2 mol/L的柠檬酸溶液为介质,由美国NanoComposix公司提供),通过TEM及DLS表征证明了PtNPs悬浮液的多分散性,PtNPs通过TEM方法检测到的尺寸分别为:(30.6±3.1) nm和(46±5) nm,PtNPs的质量浓度均为0.05 mg/mL,其纳米颗粒数量浓度分别为1.8×1011个/mL(30 nm PtNPs)和4.7×1010个/mL(50 nm PtNPs);Pt(Ⅳ)标准溶液(浓度为1 000 mg/L),Pt(Ⅳ)标准溶液配制浓度分别为0、0.1、0.2、0.5、2 μg/L(1%HNO3介质,使用时现配现用);60 nm AuNPs(0.05 mg/mL,2 mmol/L柠檬酸介质,美国NanoComposix公司)用于测定单颗粒模式下该方法传输效率;为了获得高灵敏度和低双电荷数(<2%),1 μg/L ICP-MS调谐液(Be、Ce、Fe、In、Li、Mg、Pb、U,PE公司,1% HNO3介质)用于调谐仪器的最佳状态。
1.2 仪器
NexION 300 X ICP-MS(PerkinElmer公司,美国),同心雾化器(PerkinElmer,美国),液氩(纯度>99.99%),高纯水(Ultrapure water,UP水,成都优普,电阻率>18.2 MΩ·cm);NexION 300 X ICP-MS仪器操作见表1。
数据采集及处理软件:SyngistixTMNano Application Software Module (PerkinElmer公司,美国)。

表1 SP-ICP-MS仪器参数
1.3 样品制备及测定
1)农产品中PtNPs的提取
准确称量0.025 0 g农产品于15 mL离心管中,移取 8 mL柠檬酸缓冲液(5 mmol/L,pH=4.5),摇匀,冰水浴中超声5 min,加入0.01 g Macerozyme R-10酶,然后再加入2 mL的超纯水,在37 ℃下恒温振荡24 h。水浴好的样品取出静置,用移液枪取20 μL上清液注入15 mL离心管中并加入超纯水定容至15 mL,摇匀,将样品稀释至一定倍数后,上ICP-MS测定(SP-ICP-MS模式)。
2)样品制备及测定
为避免两个或多个纳米颗粒进入等离子体,纳米颗粒信号个数小于总信号个数的10%。为减少样品受进样系统影响,测量的每个样品之间采用1%HNO3溶液冲洗,以保证进样系统中无样品残留。在测样过程中,每测完10个样品,以100 ng/L 50 nm PtNPs标准品溶液来监控仪器信号是否有明显漂移。
2 结果与讨论
2.1 SP-ICP-MS表征PtNPs标准溶液
依据SP-ICP-MS测定MNPs颗粒原理[9],采用SP-ICP-MS技术测定了30 nm和50 nm PtNPs稀溶液中Pt颗粒平均粒径及颗粒浓度,实验结果见表2。SP-ICP-MS测定PtNPs(30 nm和50 nm)平均粒径结果与TEM 值(生产厂商提供)接近,颗粒浓度回收率较高,这说明SP-ICP-MS法能够定量测定稀溶液中PtNPs,这为农产品中PtNPs定量分析提供可靠的分析手段。
2.2 Macerozyme R-10酶对纳米铂颗粒的影响
Macerozyme R-10是一种多组分酶[含纤维素酶(0.1单位/mg)、半纤维素酶(0.25单位/mg)和果胶酶(0.5单位/mg)],是植物组织中重要组成部分。目前以Macerozyme R-10为主的酶消解技术能够在保证MNPs的自有性质(如粒径、形貌等)在萃取过程中不发生变化的前提下将复杂组织基体中MNPs进行释放[13]。

表2 SP-ICP-MS法测定纳米铂标准溶液粒度分布
因此,在本研究中,为考察R-10酶对PtNPs是否存在聚集/溶解现象,选取纳米颗粒浓度8.51×104particle/mL 50 nm PtNPs为分析对象,考察R-10酶添加前后PtNPs溶液的粒径分布及纳米颗粒数浓度的变化。实验结果表明(见图1),由50 nm PtNPs的粒径分布图可知,酶处理前后PtNPs无明显团聚/溶解。R-10酶处理的PtNPs的颗粒浓度为7.60×104particle/mL,与未经酶处理的PtNPs的颗粒数浓度(8.51×104particle/mL)相近,其回收率为89.30%。这说明当R-10酶与PtNPs相互作用时不会引起PtNPs的团聚或溶解,R-10酶用于植物组织中提取PtNPs是可行的。

图1 50 nm PtNPs溶液(a)及酶处理后50 nm PtNPs溶液(b)的粒径分布图Figure 1 The particle size distribution for PtNPs stock suspension (a) and enzyme-treated PtNPs solution (b).
2.3 R-10酶对农产品中PtNPs提取条件的优化
据报道,酶消解技术能够在温和的pH值下将复杂基体中MNPs进行分离,通过优化不同植物介质中MNPs的提取条件,研究人员采用酶消解法(Macerozyme R-10)已成功提取了植物样品中AgNPs、AuNPs和TiO2NPs等,并运用SP-ICP-MS技术对一些植物中MNPs进行定量分析。
因此,本实验以生菜作为一种典型的农产品,考察了影响酶提取农产品中PtNPs的主要因素,包括酶用量、提取液浓度、水浴时间等,以获得较高浓度的铂纳米颗粒,同时保证在提取过程中不引起PtNPs颗粒形貌和粒径发生变化。
2.3.1 R-10酶用量
在酶消解实验中,酶用量是影响提取农产品中MNPs回收率的重要因素。据报道,10 mg R-10酶可有效地将25 mg农产品中AgNPs、AuNPs和TiO2NPs提取出来。因此,分别称取5、10、20 mg R-10酶加入到农产品中,加入10 μL 50 nm PtNPs(浓度为50 ng/L)至农产品,再进行酶提取实验步骤。通过考察提取后PtNPs平均粒径、频数、颗粒数浓度和回收率等结果,考察不同量R-10酶对农产品中PtNPs提取的影响。表3为不同量R-10酶提取农产品中PtNPs结果。虽然20 mg R-10酶可获得最好的PtNPs回收率90.8%±3.2%,但添加10 mg R-10酶的PtNPs颗粒也可获得良好的PtNPs回收率89.4%±2.3%,接近90%。因此,本实验以R-10酶添加量10 mg作为样品前处理的条件。

表3 不同量R-10提取农产品中PtNPs影响
2.3.2 缓冲液浓度
温和的pH值是保证R-10酶在植物中MNPs提取的前提条件。因此,本实验分别采用了柠檬酸、醋酸铵和MES缓冲液考察R-10酶对植物中PtNPs影响。研究表明(数据未显示)柠檬酸盐体系除了能有效地保证PtNPs从植物中释放,还能够保证其形貌和自有属性基本不发生变化。因此,将柠檬酸体系作为后续的实验体系。考察柠檬酸(0.5~5 mmol/L)对农产品中PtNPs提取的影响,如图2所示,随着柠檬酸浓度的增加,农产品中PtNPs提取效率逐渐提高,当柠檬酸缓冲溶液浓度为5 mmol/L时,PtNPs的提取效率最好,可达92.5%±0.8%。因此,柠檬酸浓度参数选择为5 mmol/L。

图2 不同柠檬酸浓度对农产品 PtNPs的提取影响(n=3)Figure 2 Effect of citrate buffer concentration for the extraction of PtNPs from agricultural products (n=3).
2.3.3 水浴平衡时间
在样品纳米颗粒的提取过程中,酶处理温度和平衡时间可能会影响目标物质中纳米颗粒的提取效率。通过参考制造商提供的信息,R-10酶最佳的提取温度为37 ℃。因此,实验直接选择37 ℃为植物中PtNPs的最佳提取温度。另一方面,通过改变水浴时间(5~36 h),讨论水浴时间对PtNPs的提取影响。由图3可知,当水浴时间为5~10 h时,PtNPs提取率较低,约为20%。随着时间增加,PtNPs提取效率逐渐增加,当水浴时间为36 h时,PtNPs提取效率为92.5%±0.8%。因此,选择36 h为PtNPs提取的最佳水浴平衡时间。
2.3.4 提取参数对农产品中PtNPs提取的粒径影响
农产品中PtNPs的定量分析除需考虑MNPs能否有效地从农产品中释放出,还需考虑MNPs在提取过程中尺寸粒径是否发生变化。分别考察柠檬酸缓冲液浓度(0.5~5 mmol/L)与水浴时间(4~36 h)对农产品中PtNPs平均粒径的影响。由图4可知,低浓度柠檬酸浓度更容易引起PtNPs团聚,当柠檬酸浓度为5 mmol/L、水浴时间为36 h时,PtNPs平均粒径与标准的PtNPs(Control PtNPs)样品更接近。图5为优化条件后农产品PtNPs粒径分布图。由图5可以看出,经过R-10酶释放出PtNPs粒径分布并未发生明显的团聚/分解现象。结合之前的PtNPs提取效率研究结果,最终选定R-10酶浓度为10 mg、柠檬酸浓度5 mmol/L、提取时间36 h为最优的农产品中PtNPs参数。

图3 水浴平衡时间对农产品PtNPs的提取影响(n=3)Figure 3 Effect of equilibrium time for the extraction of PtNPs from agricultural products (n=3).
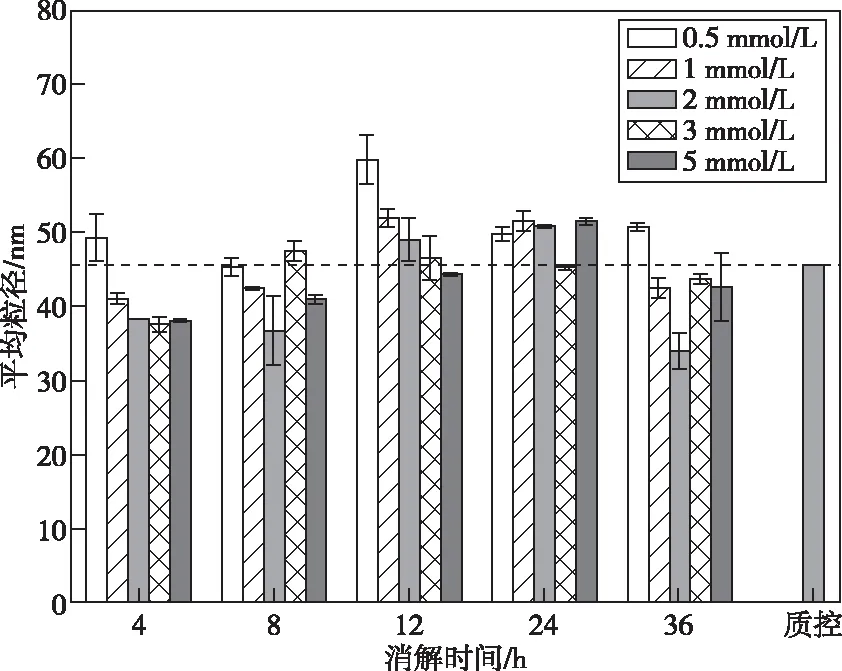
图4 不同水浴时间与柠檬酸浓度处理后的 铂纳米平均粒径(n=3)Figure 4 Average particle size of platinum nanoparticles treated with different concentration of citric acid and water bath time (n=3).

图5 PtNPs粒径分布图 (a)参数优化后农产品中提取PtNPs (b)50 nm PtNPs标准溶液Figure 5 Size distribution of PtNPs (a) PtNPs extracted from agricultural products with optimized parameters (b) 50 nm PtNPs standard solution.
2.4 铂纳米颗粒粒度和浓度检出限
粒度分布检出限(LODsize)和颗粒浓度检出限(LODd)是SP-ICP-MS模式下考察农产品中PtNPs两个重要参数。农产品中PtNPs粒度分布检出限(LODsize)可认为是Pt纳米颗粒信号与背景信号及Pt离子态信号区分可通过Pt平均背景信号值与5倍标准偏差之和的迭代运算获得。采用本方法,农产品中PtNPs的LODsize为20 nm。而农产品中PtNPs的LODNP则与三个纳米粒子计数的能力相关,可表示为:
因此,SP-ICP-MS法测定农产品中PtNPs颗粒浓度检出限为5×105particle/L。一般情况下为获取准确的PtNPs颗粒浓度,测定时建议将样品测定浓度高于检出限的5~10倍。
2.5 酶消解-SP-ICP-MS测定农产品中PtNPs
将得到最优条件的酶消解实验用于生菜、水稻和白菜三种农产品中PtNPs的提取并进行SP-ICP-MS分析,表4中记录了各项测定指标结果。50 nm PtNPs标准溶液的颗粒直径为(46±5) nm,而实测样品PtNPs颗粒尺寸为(43±7) nm。水稻、生菜和白菜加标后PtNPs颗粒数浓度回收率分别为(87±6)%、(81±3)%和(91±4)%,相对标准偏差分别为3.3%、4.0%和7.0%。水稻、生菜和白菜加标后PtNPs颗粒平均粒径分别为(41±3)、(44±5)和(47±2) nm,相对标准偏差分别为4.5%、7.4%和10.5%。以上结果表明经过条件优化后的酶消解实验对农产品中PtNPs的提取可获得较高的颗粒数浓度回收率以及尺寸稳定的纳米颗粒。

表4 实际样品中PtNPs测定及样品回收率
3 结论
开发可靠的高灵敏度定量分析农产品中金属纳米颗粒测定方法用于食品纳米环境风险评估是至关重要的。本研究采用酶消解技术将农产品中PtNPs释放出,结合SP-ICP-MS表征技术,准确测定农产品中PtNPs粒度分布和纳米颗粒浓度。农产品中PtNPs粒度检出限25 nm,颗粒浓度检出限为5×105particles/L。采用酶消解-SP-ICP-MS技术研究了实际农产品中PtNPs,PtNPs颗粒浓度回收率在(81±3)%~(91±4)%,加标后平均粒径(41±3) ~(47±2) nm,与50 nm PtNPs标准溶液粒径接近。这说明建立的酶消解-SP-ICP-MS法能够有效地定量分析农产品中PtNPs,可为后续农产品中PtNPs风险评估提供可靠的分析技术。
