二甲双胍通过调节血管外周脂肪细胞的累积抑制腹主动脉瘤的形成*
2022-03-23张瑾瑾叶春芳孟宪杰张丽华赵永波
田 丽,张瑾瑾,杨 柳,刘 肖,叶春芳,孟宪杰,李 会,张丽华,赵永波,马 冬△
(1.河北省唐山市人民医院内分泌科 063001;2.华北理工大学公共卫生学院,河北唐山 063210;3.河北医科大学附属第四医院心外科,石家庄 050000)
腹主动脉瘤(AAA)导致的主动脉破裂是老年人群中死亡的常见病因[1],其主要病理学特征是血管系统炎症和主动脉结构的病理性重塑,与年龄、性别、遗传、吸烟、肥胖、血脂异常和高血压等因素具有明显的正相关关系[2]。目前临床上尚无有效控制AAA进展或将其逆转的药物。血管外周脂肪组织具有较强应答高脂饮食带来的脂肪异位沉积,促进血管外周脂肪细胞(PAs)堆积、炎症产生和动脉粥样硬化的发生[3],提示PAs的累积在AAA发生中具有重要作用。DODERER等[4]研究发现,AAA外膜存在大量的脂肪细胞蓄积,并且证实了这些PAs促使AAA形成是一个新颖的病理生理机制。
二甲双胍(Met)作为治疗2型糖尿病的一线药物,研究证实其不仅具有降糖作用,还包括减少系统炎症和氧化应激,以及抑制细胞外基质重塑等功能[5]。有研究对合并糖尿病的AAA患者的用药进行逻辑回归分析发现,只有Met的使用与AAA的扩张呈负相关,提示Met可能对AAA的发生、发展有抑制作用,但其具体机制尚不明确[6-7]。另外,本课题组前期研究发现,缺氧诱导脂滴相关蛋白(HILPDA)分别在糖尿病和AAA患者血管组织中表达明显升高,且有研究报道显示,该蛋白作为过氧化物酶体增殖物激活受体γ(PPAR-γ)的靶点参与脂肪积累、脂滴形成、巨噬细胞浸润和动脉粥样硬化进展[8-9]。因此,本课题组拟从Met对AAA形成影响的角度探讨其具体分子机制,油红染色观察PAs的累积,采用免疫荧光染色、Western blot和实时定量PCR(qPCR)等实验方法检测脂滴形成、HILPDA和炎症相关基因的表达,探讨其作用机制,为有效抗炎治疗AAA提供分子靶点。
1 材料与方法
1.1 材料
Osmotic Pump缓释泵购自明阳科华生物科技有限公司;血管紧张素Ⅱ(AngⅡ)购于北京Solarbio公司;BCA蛋白浓度测定试剂盒、总蛋白提取试剂盒、高脂饲料(含0.15%胆固醇、21%脂肪)购自江苏美迪森公司;4%多聚甲醛溶液购自北京雷根生物有限公司;10%山羊血清购自上海碧云天公司;anti-HILPDA抗体购自上海LSBio公司;FITC标记的荧光二抗购自美国Therno Fisher Scientitic公司;抗荧光淬灭封片液购自美国Sigma公司。
1.2 方法
1.2.1AAA模型建立与分组干预
10只8~10周龄ApoE-/-雄性小鼠购自北京维通利华技术有限公司,饲养于华北理工大学实验动物中心无特定病原体(SPF)级动物房,体重(27.0±1.2)g。小鼠皮下植入加AngⅡ的缓释泵以1 000 ng·kg-1·min-1的释放速度持续28 d并高脂饲养构建小鼠AAA模型,均分为两组:AAA组和Met组,Met组通过饮水摄入Met(250 mg/kg),每天1次。4周后水合氯醛麻醉取材,测量腹主动脉扩张尺寸,并采用油红O染色观察血管外周脂肪组织累积情况。一部分动脉置于4%多聚甲醛中固定不少于24 h,组织脱水透明,石蜡包埋,制作病理切片并进行烤片;另一部分置于液氮中,用于基因的表达分析。
1.2.2油红O脂肪染色法
按照北京Solarbio公司油红染色试剂盒说明书操作。将新取下的完整小鼠主动脉组织,采用0.5%的油红O溶液孵育7~8 min,弃液体,PBS洗5遍,显微镜下观察拍照。
1.2.3免疫荧光染色
石蜡包埋组织,4 μm切片,脱蜡至水,0.01 mol/L柠檬酸修复液高压抗原修复,冷却后PBS洗3遍,10%山羊血清孵育30 min;倾去血清,滴加适当比例稀释的一抗湿盒中4 ℃孵育过夜,PBS冲洗3次,荧光二抗室温孵育,PBS避光冲洗,抗荧光淬灭剂避光封片,激光共聚焦显微镜观察、照相。
1.2.4Western blot检测
取出冻存的血管组织,置冰上充分研磨后加入组织裂解液,4 ℃离心提取蛋白;十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE),半干转将蛋白转至PVDF膜,5%脱脂奶粉中封闭,一抗4 ℃过夜,PBS洗膜,二抗孵育,再PBS洗膜,滴加ECL发光液,机器曝光显影。
1.2.5qPCR
取出冻存的血管组织,Trizol提取总RNA,反转录cDNA,采用StepOnePlus Real-Time PCR System检测基因肿瘤坏死因子(TNF)-α、白细胞介素(IL)-1β、IL-6的转录水平,2-ΔΔCT方法计算目的基因的表达量,以GAPDH为内参。
1.3 统计学处理
2 结 果
2.1 两组小鼠瘤体直径和PAs累积比较
通过对两组小鼠主动脉样本的外径测量统计发现,与AAA组比较,Met组小鼠的瘤体直径减小,差异有统计学意义[(1.98±0.05)mmvs.(2.37±0.09)mm,P<0.01];同时,油红O染色发现Met组小鼠的瘤体PAs累积较AAA组明显减少,见图1。
2.2 免疫荧光染色和Western blot检测两组PAs中脂滴形成和HILPDA的表达
免疫荧光染色结果发现,与AAA组比较,Met组PAs中脂滴形成减少,Met组HILPDA染色(红色)较浅;Western blot进一步证实Met组HILPDA表达较AAA组减少,见图2。

A:油红染色(×5),红色部分代表小鼠主动脉外周脂肪组织油红O染色结果,方框标注部分表示瘤体部位;B:瘤体直径测量统计图;a:P<0.01。
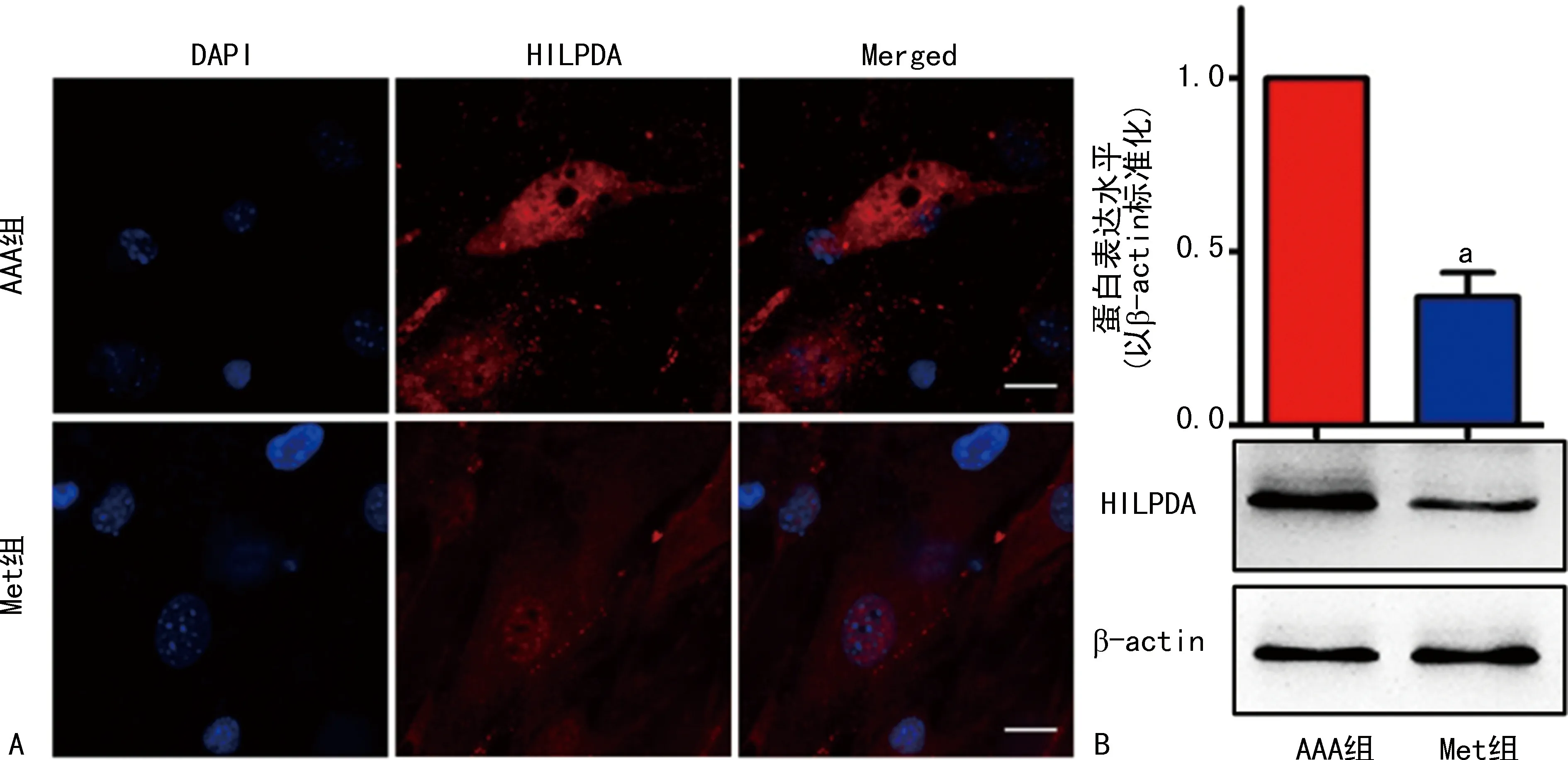
A:免疫荧光染色检测(×630),红色染色代表HILPDA表达,蓝色代表细胞核染色;B:Western blot;a:P<0.01,与AAA组比较。
2.3 qPCR检测两组小鼠瘤体组织中炎症因子TNF-α、IL-1β和IL-6的表达
qPCR检测两组小鼠瘤体外周脂肪组织中炎症因子的表达结果显示,与AAA组比较,Met组小鼠瘤体组织中炎症因子TNF-α、IL-1β和IL-6的表达水平降低(分别降低0.56倍、0.33倍和0.74倍),差异均有统计学意义(P<0.05和P<0.01),见图3。

a:P<0.05;b:P<0.01。
3 讨 论
AAA是血管外科最危险的疾病之一,血管细胞外基质改变、炎性反应、血管平滑肌细胞凋亡、氧化应激等参与其发病机制[10]。本研究采用AngⅡ灌注和高脂饮食诱导AAA小鼠模型证实了Met干预抑制AAA的作用,油红O染色发现Met组小鼠瘤体外周PAs累积显著减少;免疫荧光染色和Western blot检测发现Met处理导致PAs脂滴形成减少和HILPDA表达水平降低,以及qPCR证实PAs中炎症因子(TNF-α、IL-1β和IL-6)的表达水平同样明显降低,说明Met抑制AAA的作用与减少HILPDA表达及其介导的PAs脂滴形成,抑制血管外周脂肪组织增加带来的炎症环境相关。肥胖作为心血管疾病发病的主要因素之一,有研究发现,肥胖期间血管周围脂肪组织表现出活动性局部炎症,会增加主动脉瘤发病风险[11],而Met可抑制多种代谢性疾病相关的炎性因子[12],并且可以明显抑制脂肪细胞的成脂分化[13],说明本研究结果与以往报道一致,证实了以上结论。另外,临床上AAA患者Met用药队列研究结果同样发现,糖尿病患者采用Met治疗可显著降低AAA的膨胀速率[14],提示本研究结论可能是其作用机制之一。
近年来有关Met抑制动脉瘤相关的机制研究主要是针对血管平滑肌细胞进行的,如WANG等[15]报道了Met抑制AngⅡ诱导的ApoE-/-小鼠AAA是通过抑制PI3K/AKT/mTOR信号途径发挥抗AngⅡ诱导的血管平滑肌细胞增殖、凋亡、迁移和自噬的作用;LI等[16]研究发现Met具有调节血管平滑肌细胞表型转换和炎症因子分泌并抑制脑动脉瘤的作用,其分子机制是通过激活AMPK/ACC信号途径实现的。本研究发现Met抑制AAA瘤体外周PAs的累积,进而抑制血管炎症和AAA的形成是从另一个角度诠释AAA的病理生理学机制,提示Met在多类型细胞中发挥抑制AAA形成和进展的作用。
值得注意的是,尽管在动物模型中已经证实了炎症和蛋白降解机制的干预可以有效抑制AAA的形成和发展,但是目前临床研究结果均以失败告终,甚至某些炎症干预措施会促使AAA的发展或者加速血管的破裂[17]。新近研究报道巨噬细胞中HILPDA表达的抑制能够增强甘油三酯的脂解作用,减少脂滴形成[18],但并没有抑制脂肪组织中的炎症水平,提示HILPDA作为分子治疗靶点要考虑其组织细胞特异性,在巨噬细胞中抑制其表达对血管外周脂肪组织炎症减少可能同样没有意义;与此相反,本研究结果表明在血管外周PAs中抑制HILPDA的表达却能够发挥重要的抗炎作用(减少脂肪组织中TNF-α、IL-1β和IL-6的表达),提示脂肪组织中HILPDA表达的抑制影响血管外周炎症环境的分子机制研究将是重要方向。
综上所述,Met通过抑制PAs中HILPDA的表达、减少脂滴的形成、脂肪细胞增殖及相关炎症因子的表达来发挥抑制AAA的作用,HILPDA可能是一个新颖的分子治疗靶点。
