GSK-3β参与氯化锂修饰颅内感染后癫痫发作的可能机制
2022-03-23李志民余巨明蒋国会
李志民,曹 兴,余巨明,蒋国会
(川北医学院附属医院神经内科,四川南充 637000)
癫痫是一种脑部神经元异常放电且反复发作为特征的常见脑部疾病[1],目前还没有太多办法能够抑制癫痫的发生。颅内感染作为癫痫的重要病因[2],抑制颅内感染炎性环境从而抑制癫痫的发生无疑是研究的方向。虽然抗感染治疗能降低脑炎病死率,但不能改变脑炎后形成癫痫的结果。目前亦推荐预防性抗癫痫治疗[3-5]。尽管颅内感染是如何导致癫痫发作和癫痫形成的具体机制迄今还不十分清楚,但推测可能与促炎细胞因子[白细胞介素(IL)-1β、 肿瘤坏死因子(TNF)-α]、抗炎细胞因子(IL-10)失衡,胶质细胞异常激活及神经元的变性坏死共同导致脑神经网络引起异常兴奋有关[6-7]。
糖原合成激酶-3β (GSK-3β)是炎症TLR4信号通路的关键调节器,抑制GSK-3β可以达到明显抗炎作用,而激活GSK-3β则具有明显促炎作用[8],因而对维持机体炎症平衡起到至关重要的作用。它作为丝氨酸/苏氨酸蛋白激酶功能并不单一。GSK-3β通过丝氨酸/苏氨酸蛋白激酶去磷酸化激活可导致细胞凋亡,然而通过促进丝氨酸/苏氨酸蛋白激酶磷酸化(P -GSK-3β)而达到细胞保护的作用,均通过pI3K/Akt通路影响GSK-3β的活性[9]。Wortmannin(WT)抑制pI3K使丝氨酸/苏氨酸蛋白激酶去磷酸化而激活[10],因此被视为GSK-3β的激动剂。氯化锂(LiCl)和丙戊酸(VPA)能使GSK-3β磷酸化失活,故被视为GSK-3β的抑制剂。LiCl在精神疾病中发挥了重要作用,目前研究其在神经系统疾病如脑和脊髓损伤[11]及神经变性疾病如帕金森病[12]的治疗也发挥一定作用。然而,LiCl对大鼠颅内感染及颅内感染后癫痫发作的影响还鲜见报道。本实验发现LiCl对癫痫发作的影响可能与剂量相关,小剂量LiCl(小于40 mg/kg)可能抑制癫痫发作,而大剂量LiCl(大于60 mg/kg)可促进癫痫的发作[13]。本课题组前期实验得出LiCl对大鼠颅内感染后癫痫发作的影响具有剂量依赖效应,但具体机制尚不清楚。因此本研究采用不同水平的LiCl、VPA及WT干预颅内感染模型大鼠,通过免疫组织化学、Western blot、ELISA、电生理检测的方法,探讨GSK-3β在LiCl影响颅内感染大鼠癫痫发作的关系,进而为颅内感染后癫痫的预防提供方向。
1 材料与方法
1.1 一般材料
选取8~10周龄约200 g的成年雄性Sprague-Dawley大鼠(均由川北医学院实验动物中心提供);LiCl、LPS(美国Sigma 公司)、小胶质细胞抗体 (IBA-1,日本Wako 公司)、毛果芸香碱(Pilo,美国Sigma公司)、Wortmannin (美国Abmole公司)、抗-Phospho-GSK-3α/β抗体、抗-GSK-3α/β抗体(美国R&D公司)、IL-10、IL-1β、TNF-α检测试剂盒(武汉博士德公司)、神经元特异性核蛋白抗体(NeuN,美国Millipore公司)、β-actin多克隆抗体(北京中杉金桥公司)。川北医学院实验动物伦理委员会批准该实验。
1.2 方法
1.2.1模型制备及分组
制备脂多糖(LPS)颅内感染大鼠模型[14]:在大鼠侧脑室 (前囟后0.8 mm,旁开1.3 mm,入脑 3.5 mm) 采用注射LPS 50 μg,建立大鼠颅内感染模型。对照组(5只)给予侧脑室注射同体积生理盐水5 mL/kg。观察记录实验鼠行为活动,并于24 h检测实验鼠海马组织中炎症因子和GSK-3β的水平。
侧脑室注射LPS诱导颅内感染大鼠105只,然后将其均分为LPS组,LPS-10、20、40、80 mg/kg LiCl组,以及LPS-VPA组和LPS-WT组。对应分组分别进行腹腔注射生理盐水5 mL/kg,LiCl 10、20、40、80 mg/kg,以及VPA 30 mg/kg和WT 0.6μg/kg[15],LiCl<40 mg/kg时为LPS-小剂量LiCl组。每24小时1次,连续3 d。
1.2.2癫痫大鼠模型造模及其电生理检测[16]
根据3.3 mL/kg的比例,采用水平为10%水合氯醛对大鼠进行腹腔注射麻醉,然后将其置于脑立体定位注射仪上。乙醇消毒后对大鼠进行备皮,沿颅骨中缝剪开头皮后以Bregma十字缝为参照向左移2.6 mm,向后移3.6 mm为中点用颅骨钻开一边长为3 mm骨窗。在骨窗近鼻端钻2小孔并插入固定小螺栓用于连接参考电极。参照大鼠脑图谱,以Bregma十字缝为参照向后3.6 mm,向左2.6 mm移动 4×4微阵列排列的16导微丝电极至左侧海马CA1区并用微推进器向下刺入脑中3.5 mm,然后连接相应电极。待大鼠麻醉苏醒后,使用16导在体电生理记录仪(美国Plexon公司)和OmniPlex®D神经信号采集系统(美国Plexon公司)记录大鼠海马CA1区神经元的电活动信号。首先,采集15 min大鼠清醒状态下的脑电信号作为基准线;然后按照360 mL/kg的剂量腹腔注射毛果芸香碱诱发癫痫持续状态(SE)并记录30 min。采用脑电分析系统(NeuroExplorer®v4.0)对实验大鼠脑电信号进行ripples振荡和SE海马局部场电位的FRs的功率谱密度均值。
1.2.3IL-1β、TNF-α和IL-10水平检测
用水合氯醛(3.3 mL/kg,腹腔注射)麻醉大鼠后断头取脑,快速分离双侧海马组织(冰上操作)迅速放入匀浆管制作匀浆,而后将匀浆液移入离心管,于4 ℃、 12 000 r/min离心15 min。取上清液,用Bradford 法测定蛋白水平后分装于0.5 mL离心管。根据ELISA试剂盒说明书进行IL-1β、TNF-α和IL-10检测。
1.2.4p-GSK-3β和GSK-3β水平检测[16]
采用Western blot对p-GSK-3β和GSK-3β两个靶蛋白进行定量分析。将实验大鼠海马区提取的蛋白质裂解液用10%的十二烷基磺酸钠-聚丙烯酰胺凝胶电泳进行分离。然后,采用半干式转印法将蛋白质条带转移至硝酸纤维素薄膜上。检测条件:5%脱脂牛奶,室温封闭硝酸纤维素薄膜2 h;然后,将封闭液更换为一抗溶液,分别为1∶1 000稀释的兔抗鼠的p-GSK-3β多克隆抗体溶液、GSK-3β多克隆抗体溶液和β-actin多克隆抗体溶液,4 ℃冰箱孵育过夜。次日,回收一抗溶液,并用PBS洗涤硝酸纤维素薄膜3次,每次5 min。然后,室温用HRP标记的羊抗兔IgG孵育1.5 h。PBS洗涤硝酸纤维素薄膜3次后,用新鲜配制的化学发光显色剂对蛋白质条带进行显影。用Image J软件测定各蛋白质条带的灰度值,以靶蛋白与内参蛋白β-actin的灰度值之比表示靶蛋白的相对表达水平。
1.2.5神经元和小胶质细胞检测
采用水平为10%的水合氯醛,按照3.3 mL/kg的剂量,对大鼠实施腹腔注射麻醉。将小鼠固定后用生理盐水灌流大鼠洗涤血细胞。待右心耳流出液呈无色后再用4%多聚甲醛灌流大鼠。大鼠灌流完成后小心取出脑组织并置于4%多聚甲醛溶液中后固定24 h。将后固定好的脑组织经脱水处理后,用石蜡包埋并制作连续的冠状组织切片(每片4 μm厚)。海马区脑组织切片每间隔4张取1张进行免疫组织化学染色。使用小胶质细胞特异性抗体IBA-1(1∶200)检测活化的小胶质细胞;用神经元特异性抗体NeuN(1∶1 000)检测神经元细胞。所有组织切片均用苏木精进行复染。
参照YANG等[17]的方法,对免疫组织化学染色的脑组织切片进行阳性细胞计数。在40倍放大的显微镜视野下,选取海马CA1及邻近皮质区中具有代表性的,非重叠区域(400 μm×400 μm)进行NeuN+和IBA-1+细胞计数。所有的细胞计数区域均由观察者预先设定,并采用Image-Pro Plus Media Cybernetics系统对NeuN+和IBA-1+细胞自动计数。计数视野中,只有形态结构完整,细胞清晰可辨的NeuN+和IBA-1+细胞才会被计数。由于大鼠左、右大脑半球的细胞数目无明显差别,故不特意区分左、右半球,并将Image-Pro Plus Media Cybernetics系统获得的结果用于统计分析。
1.3 统计学处理
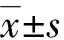
2 结 果
2.1 颅内感染大鼠模型中海马GSK-3β和p-GSK-3β的变化
2.1.1LPS颅内感染大鼠模型
相比对照组大鼠而言,LPS组活动明显减少、食物摄入量降低、饮水量增加、体温上升明显。在LPS组的海马组织中存在明显的促炎性细胞因子IL-1β和TNF-α的水平增高,与对照组比较差异有统计学意义(P<0.05),见图1。

a:P<0.05,与对照组比较。
2.1.2大鼠海马组织中GSK-3β和p-GSK-3β的表达
Western blot分析表明LPS组的大鼠海马组织中GSK-3β水平较对照组升高(P<0.05),而p-GSK-3β水平却明显比对照组降低,见图2。
2.2 不同干预对颅内感染模型大鼠各种检测指标的影响
2.2.1炎性因子在不同干预处理组中的表达
与LPS组相比LPS-小剂量LiCl组及LPS-VPA组的海马组织中IL-10的表达水平明显升高(P<0.05)。LPS-80 mg/kg LiCl组和LPS-WT组的海马组织中IL-10的表达水平明显降低(P<0.05),见图3A。LPS-小剂量LiCl组、LPS-VPA组的海马组织中IL-1β和TNF-α的表达水平明显降低(P<0.05),LPS-80 mg/kg LiCl组及LPS-WT组的海马组织中IL-1β和TNF-α的表达水平明显升高(P<0.05),见图3B、C。
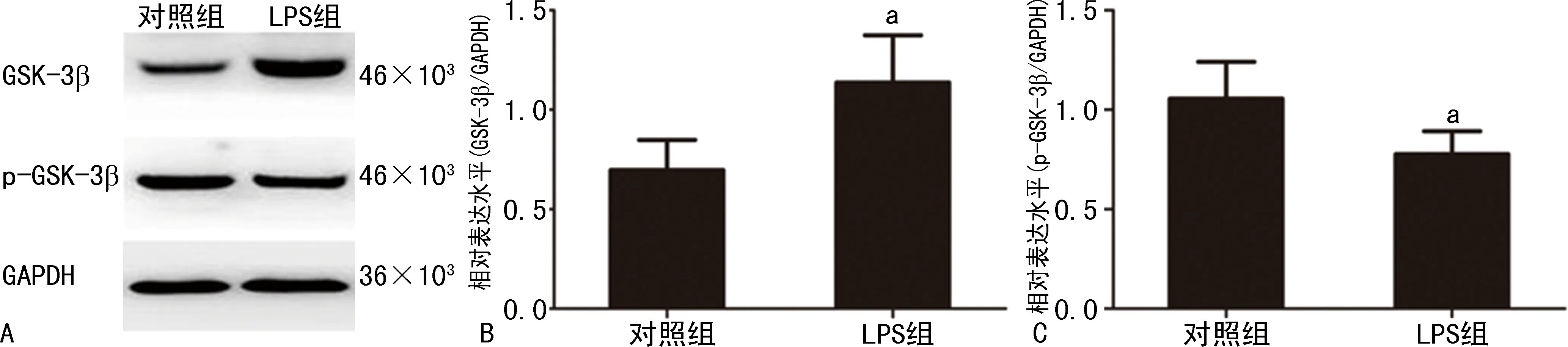
A:Western blot检测;B:GSK-3β相对表达水平;C:p-GSK-3β相对表达水平;a:P<0.05,与对照组比较。
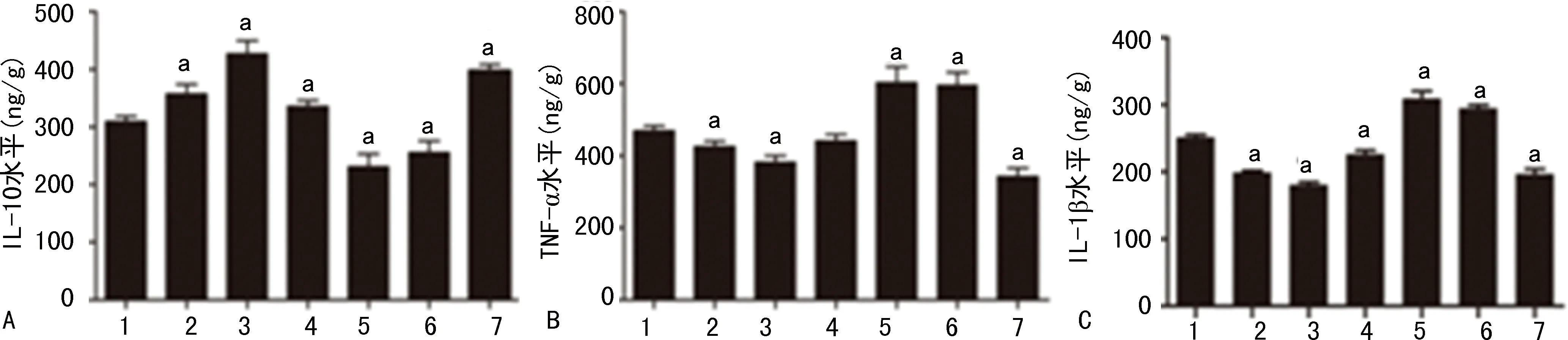
A:IL-10;B:TNF-α;C:IL-1β;1:LPS组;2~5:分别为LPS-10、20、40、80 mg/kg LiCl组;6:LPS-VPA组;7:LPS-WT组;a:P<0.05,与LPS组比较。
2.2.2不同干预对颅内感染大鼠模型海马CA1区神经元的影响
LPS-小剂量LiCl组和LPS-VPA组的海马CA1区神经元形态结构比LPS组的更为完整,排列也更整齐而致密、细胞核脱失少、染色较深。小剂量LiCl干预组和LPS-VPA组的海马CA1区神经元数量与LPS组相比差异有统计学意义(P<0.05)。LPS-80 mg/kg LiCl组及LPS-WT组的海马CA1区神经元形态结构的损坏比LPS组更为严重,神经元排列松散、散乱,细胞核脱失严重、着色较浅。海马CA1区神经元数量与LPS-80 mg/kg LiCl组、LPS-WT组和LPS组之间差异有统计学意义(P<0.05),见图4、5。
2.2.3不同干预对颅内感染大鼠模型海马CA1区小胶质细胞的影响
LPS-小剂量LiCl组和LPS-VPA组的海马CA1区小胶质细胞的激活比LPS明显要少(P<0.05);而LPS-80 mg/kg LiCl组和LPS-WT组的海马CA1区小胶质细胞的激活比LPS组显著增多(P<0.05),见图6、7。

1:LPS组;2~5:分别为LPS-10、20、40、80 mg/kg LiCl组;5:LPS-VPA组;6:LPS-WT组;a:P<0.05,与LPS组比较。

A:LPS组;B~E:分别为LPS-10、20、40、80 mg/kg LiCl组;F:LPS-WT组;G:LPS-VPA组。

A:LPS组;B~E:分别为LPS-10、20、40、80 mg/kg LiCl组;F:LPS-WT组;G:LPS-VPA组。

1:LPS组;2~5:分别为LPS-10、20、40、80 mg/kg LiCl组;6:LPS-VPA组;7:LPS-WT组;a:P<0.05,与LPS组比较。
2.2.4不同干预对颅内感染模型大鼠癫痫发作的影响
比较各干预组和LPS组的基础脑电信号、痫性首次发作和SE潜伏期、SE期的局部场电位变化。(1)不同干预对海马局部场电位ripples振荡功率的影响:LPS-小剂量LiCl组和LPS-VPA组的海马CA1区的ripples振荡功率与LPS组相比,明显降低(P<0.05)。LPS-80 mg/kg LiCl组和LPS-WT组的海马CA1区的ripples振荡功率与LPS组相比,显著升高(P<0.05),见图8。(2)不同干预对颅内感染模型大鼠SE潜伏期的影响:LPS-小剂量LiCl组和LPS-VPA组的SE潜伏期与LPS组相比明显延长(P<0.05),LPS-80 mg/kg LiCl组和LPS-WT组的SE潜伏期与LPS组相比明显缩短(P<0.05)。LPS-小剂量LiCl组和LPS-VPA组的癫痫发作频谱能量与LPS组相比明显降低(P<0.05),LPS-80 mg/kg LiCl组和LPS-WT组的癫痫发作频谱能量与LPS对照组相比显著升高(P<0.05),见图9、10。(3)不同干预对颅内感染模型大鼠SE期FRs的功率谱密度均值的影响:LPS-小剂量LiCl组和LPS-VPA组的海马区SE期FRs的功率谱密度均值与LPS组相比明显降低(P<0.05),LPS-80 mg/kg LiCl干预组和LPS-WT组的海马区SE期FRs的功率谱密度均值与LPS组相比明显升高(P<0.05),见图11、12。
2.2.5不同干预对颅内感染模型大鼠海马组织中GSK-3β和p-GSK-3β的影响
Western blot分析显示,LPS-小剂量LiCl组和LPS-VPA组海马组织中GSK-3β/p-GSK-3β的比值与LPS组相比明显变小(P<0.05)。LPS-80 mg/kg LiCl组和LPS-WT组海马组织中GSK-3β/p-GSK-3β的比值与LPS组相比明显增大(P<0.05),见图13。

1:LPS组;2~5:分别为LPS-10、20、40、80 mg/kg LiCl组;6:LPS- VPA组;7:LPS-WT组;a:P<0.05,与LPS组比较。
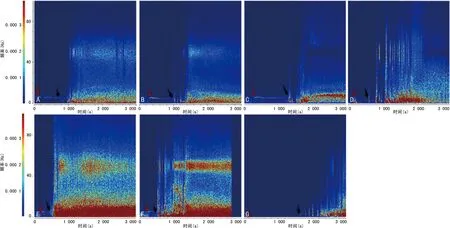
A:LPS组;B~E:分别为LPS-10、20、40、80 mg/kg LiCl组;F:LPS-WT组;G:LPS-VPA组。深红色箭头指示了腹腔注射毛果芸香碱的起始时间,黑色箭头指示了模型大鼠进入SE的起始时间。癫痫发作频谱图的横坐标代表时间(s),纵坐标代表癫痫发作频率(Hz),左侧彩色条带为频谱能量示例,频谱能量较高的以红色表示,频谱能量较低的则以蓝色表示。

1:LPS组;2~5:分别为LPS-10、20、40、80 mg/kg LiCl组;6:LPS-VPA组;7:LPS-WT组;a:P<0.05,与LPS组比较。

1:LPS组;2~5:分别为LPS-10、20、40、80 mg/kg LiCl组;6:LPS- VPA组;7:LPS-WT组;a:P<0.05,与LPS组比较。

A:LPS组;B~E:分别为LPS-10、20、40、80 mg/kg LiCl干预组;F:LPS-WT组;G:LPS-VPA组。

1:LPS组;2~5:分别为LPS-10、20、40、80 mg/kg LiCl组;6:LPS-VPA组;7:LPS-WT组;a:P<0.05,与LPS组比较。
3 讨 论
本实验采用不同剂量的LiCl干预颅内感染大鼠,电生理研究结果海马局部场电位(LFPs)显示小剂量LiCl干预后延长了毛果芸香碱诱发颅内感染大鼠癫痫发作的潜伏期,降低了SE期的快速高频振荡(FRs)功率谱密度均值,大剂量LiCl干预后则结果相反,由此得出小剂量LiCl降低了颅内感染后癫痫发作的易感性及减轻癫痫发作程度,LiCl对大鼠颅内感染后癫痫发作差异性影响的机制目前尚不十分清楚。尽管有证据表明感染所致的血脑屏障通透性增加、胶质细胞活化增殖、炎性介质大量释放、神经元兴奋性改变及变性坏死等一系列病理生理改变,均可能参与了颅内感染后痫性发作和癫痫形成的过程[11-13]。本实验也得出小剂量LiCl干预后减少了颅内感染大鼠海马小胶质细胞的活化,降低了海马促炎细胞因子IL-1β、TNF-α水平,增加了抗炎细胞因子IL-10水平,减轻了海马神经元的变性坏死。而大剂量LiCl干预后则结果相反。
本研究首先确定大鼠侧脑室注射LPS 24 h后,大鼠活动明显减少、食物摄入量降低、饮水量增加、体温上升明显,且海马促炎细胞因子显著增高,表明成功诱导大鼠颅内感染,并发现大鼠感染后脑内海马GSK-3β水平有升高及p-GSK-3β水平降低变化,因此推测大鼠颅内炎症严重程度可能与GSK-3β的活性有关。在LPS致大鼠颅内感染的基础上,采用GSK-3β间接抑制剂VPA(30 mg/kg)和GSK-3β激动剂WT(0.6 μg/kg)分别干预颅内感染模型大鼠后,Western blot结果显示VPA与小剂量LiCl干预后均使颅内感染大鼠海马中p-GSK-3β/GSK-3β比值明显变大(P<0.05),WT、与大剂量LiCl干预后均使颅内感染大鼠海马p-GSK-3β/GSK-3β比值明显变小(P<0.05),p-GSK-3β与GSK-3β 的比值大小体现GSK-3β活性的高低。因此VPA与小剂量LiCl干预后抑制了颅内感染模型大鼠海马GSK-3β活性,WT、与大剂量LiCl干预后则增加了颅内感染模型大鼠海马GSK-3β活性。研究证实抑制GSK-3β可有效减轻外周和中枢神经系统的炎症[18],而激活GSK-3β可间接诱导IL-6、TNF-α的产生来促进CD11b表达而加重炎症[19]。本实验结果小剂量LiCl与VPA减少了海马CA1小胶质细胞的激活,同时海马促炎细胞因子IL-1β、TNF-α分泌减少,抗炎细胞因子IL-10分泌增加,而大剂量LiCl与WT干预后则得出相反的结果,YU等[20]发现LiCl通过促进GSK-3β的磷酸化而抑制GSK-3β的活性来实现抑制神经炎症作用。本实验表明LiCl对颅内炎症影响的差异可能是通过调节GSK-3β的活性来实现的。
LiCl和VPA作为膜稳定剂,对多种中枢神经系统疾病具有抗炎及神经保护作用,LiCl通过调节GSK-3β的活性来直接影响颅内感染后癫痫的发作,还是通过调节GSK-3β的活性来调控颅内炎症从而间接影响颅内感染后癫痫的发作,目前尚不清楚。但LiCl在其他神经系统疾病的研究中发现,LiCl主要通过抑制GSK-3β的活性来发挥神经保护。众多研究发现通过调节GSK-3β途径亦发挥神经保护作用[21-22]。本实验和其他研究均发现LPS诱发颅内感染大鼠的海马总GSK-3β水平增加[23]。LPS诱发颅内感染大鼠癫痫发作的敏感性显著增加。推测GSK-3β可能与癫痫发作的敏感性有关。本实验发现小剂量LiCl与VPA干预后明显延长了颅内感染后SE潜伏期,而大剂量LiCl与WT干预后明显缩短了颅内感染后SE潜伏期,这种结果可能与LiCl参与调节GSK-3β的活性有关。研究表明毛果芸香碱诱导癫痫发作后海马的GSK-3β的水平增加,因此GSK-3β与癫痫的发作可能直接相关[24]。 本研究利用的GSK-3β抑制剂VPA干预,结果与小剂量LiCl干预相同,均降低了痫性发作的敏感性。而利用GSK-3β的激动剂,结果与小剂量LiCl干预结果相反,与大剂量LiCl干预结果相同,增加了痫性发作的敏感性。本实验结果显示LPS诱发的颅内感染大鼠海马的GSK-3β水平增高,p-GSK-3β的水平降低。GREEN等[23]用LPS刺激体外培养的星形胶质细胞和小胶细胞发现细胞GSK-3β水平较未刺激组明显增加,而p-GSK-3β水平较未刺激组明显减少,因而证明了炎症提高了GSK-3β的表达活性,同样用LiCl和LPS同时干预发现LPS-LiCl组较LPS组GSK-3β的表达活性明显降低,而p-GSK-3β的表达活性相反,表明GSK-3β与炎症直接相关。然而在红藻氨酸诱导癫痫模型的研究中敲出多巴胺D2受体(D2R)基因的小鼠,意外发现其海马中 GSK-3β显著活化,增加了红藻氨酸对小鼠的兴奋毒性,促进了海马神经元的凋亡,增加了小鼠对红藻氨酸诱发癫痫的敏感性;然而使GSK-3β磷酸化后,明显减轻了红藻氨酸对海马神经元兴奋毒性,减少了海马细胞的凋亡和坏死[25]。提示GSK-3β通过影响海马神经元兴奋毒性及变性坏死导致癫痫发作。然而本研究发现小剂量LiCl和VPA干预后海马局部场电位功率谱密度值ripples振荡功率谱较LPS组明显降低,且海马神经元凋亡和坏死较少,而大剂量LiCl和WT干预则出现相反的结果。海马局部场电位ripples振荡功率谱可能与癫痫发作相关[26],其功率谱密度值的高低则代表作海马神经元的兴奋性。因此小剂量LiCl降低了颅内感染大鼠海马神经元兴奋性,而大剂量LiCl和WT则作用相反。似乎也验证了通过调节GSK-3β活性而影响神经网络的兴奋性。虽然有报道红藻氨酸诱发癫痫24 h后海马中的GSK-3β的活化明显[27]。但也有报道称颞叶癫痫患者海马组织中的p-GSK-3β明显高于没有癫痫的患者,但GSK-3β水平轻微增高[28]。GSK-3β仅是WNT信号通路的一部分,有研究发现癫痫后GSK-3β的活化改变可独立于WNT途径[25];也有学者认为GSK-3β是通过多因素多途径共同作用于兴奋性神经递质如谷氨酸释放影响癫痫发作[28]。近年研究发现洛伐他汀通过抑制GSK-3β的活性,成功的减少了癫痫大鼠海马齿状回(DG)苔藓纤维发芽(MFS)[24],DG中的MFS是反复自发性发作的发作频率和颞叶癫痫的严重性高度相关的重要指标[29-31]。因此抑制GSK-3β的活性可以减轻癫痫的发作程度和脑损伤。已有研究报道FRs可作为癫痫发作的严重程度的标志[32-34],且与神经元变性丢失相关[35]。本实验发现LPS-小剂量LiCl组及LPS-VPA组SE期FRs的功率谱密度均值较LPS组比较明显降低(P<0.05),因此可以得出小剂量LiCl及VPA减轻了颅内感染模型大鼠的癫痫发作程度和神经元的变性丢失。因此GSK-3β并非直接影响LiCl对颅内感染后癫痫的发作。而是小剂量LiCl抑制颅内感染大鼠海马组织中GSK-3β的表达,抑制炎症因子,减轻组织病理损伤,延长脑炎后癫痫放电潜伏期,降低海马神经元兴奋性,提高癫痫发作阈值,降低脑炎后癫痫发作的敏感性,减轻癫痫发作程度;大剂量LiCl则结果相反。提示GSK-3β可能参与LiCl修饰颅内感染后癫痫发作的机制。
综上所述,LiCl可能通过影响GSK-3β活性,从而影响胶质细胞的活化和炎性细胞因子的分泌,进一步影响神经元的变性,最后影响神经元的异常放电,达到影响颅内感染后癫痫的发作。因此调控GSK-3β的活性可望成为改善颅内感染后癫痫的发作治疗靶点。
