菌酶协同对荷斯坦犊牛生长性能、粪便微生物和养分含量的影响
2022-03-22刘兴琳杨在宾戴伟星李会荣陈正平姜淑贞
■刘兴琳 杨在宾 刘 婕 戴伟星 李会荣 陈正平 姜淑贞*
(1.山东农业大学动物科技学院,山东泰安 271018;2.山东省畜产品质量安全中心,山东济南 250100;3.青岛市崂山区沙子口街道农业农村中心,山东青岛 266012)
犊牛的营养供给不仅直接影响现阶段的生长发育,还会间接影响其成年后的繁殖性能和产奶性能。犊牛断奶后随着固体饲料进食量的增加,消化器官快速发育,胃肠道容积和表面积增加,各种消化酶分泌量增加,胃肠道微生物菌群数量增加、种类趋于稳定。以上变化必将影响犊牛对食入饲粮各养分的消化能力[1-2]。微生物饲料添加剂是采用农业农村部认可的有益微生物经发酵制成的人工培养菌群及其代谢产物,饲喂消化道发育尚不完善的犊牛,可激发犊牛自身有益菌种繁殖增长,有效抵制有害菌系的生长,提高犊牛机体免疫力和饲料利用率,预防和治疗一些消化道疾病,有效减少有害气体排放[3]。饲料酶制剂通过补充犊牛内源消化酶的不足,有效降解饲粮中的抗营养因子,从而达到调节稳定犊牛肠道微生物菌群、提高犊牛免疫力和饲料营养价值等功效[4]。菌酶协同发酵饲料的效果往往会优于单独使用微生态制剂或酶制剂[5-6]。但复方微生态制剂(酵母菌和枯草芽孢杆菌)和复方酶制剂(木聚糖酶、纤维素酶和葡聚糖酶)协同对荷斯坦犊牛的生长性能、粪便微生物和养分含量的影响尚未见报道。本研究选择断奶后荷斯坦犊牛为研究对象,探讨单一的复方微生态制剂/复方酶制剂或者菌酶协同对荷斯坦犊牛生长性能、粪便微生物和养分含量的影响,以期为犊牛实际生产提供理论依据。
1 材料与方法
1.1 试验材料
复方微生态制剂:酵母菌≥5.0×1011CFU/kg、枯草芽孢杆菌≥1.0×1013CFU/kg,由某生物有限公司提供。
复方酶制剂:木聚糖酶≥2.0×107U/kg、纤维素酶≥2.0×106U/kg、葡聚糖酶≥8.0×106U/kg,由某生物有限公司提供。
1.2 试验动物
选择1月龄荷斯坦犊牛40头,随机分成4个处理,每个处理10头。对照组饲喂基础TMR日粮(见表1);微生物组在基础TMR日粮中添加复方微生态制剂(250 mg/kg);酶组在基础TMR日粮中添加复方酶制剂(250 mg/kg);微生物+酶组在基础TMR日粮中同时添加复方微生态制剂(250 mg/kg)和复方酶制剂(250 mg/kg)。进行30 d的饲养试验。
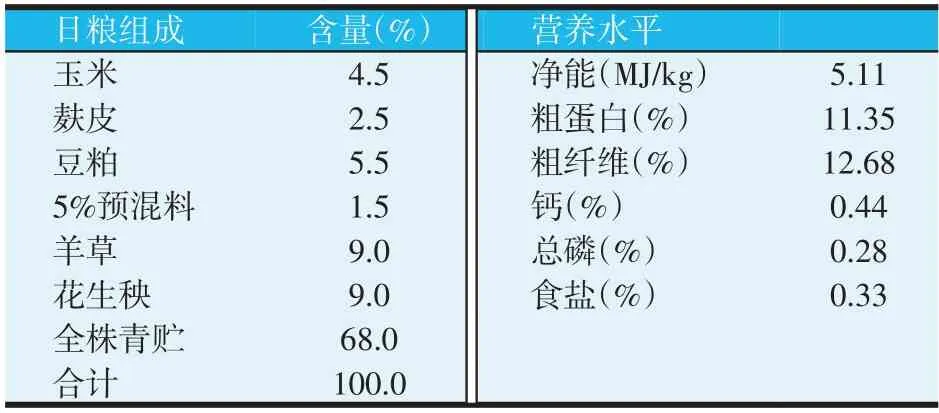
表1 基础日粮组成和营养水平(干物质基础)
1.3 测定指标
生长性能:每天记录采食量,试验开始和结束时对试验牛进行称重,计算料重比。
粪便营养成分:干物质(DM)、粗灰分(CA)、有机物(OM)、粗蛋白(CP)、粗脂肪(EE)含量和总能(GE)的测定参考AOAC(2012)和国标的方法进行。DM含量采用(103±2)℃烘干法(GB/T 6435—2006)测定,CP含量采用半微量凯氏定氮法(GB/T 6432—1994)测定,EE含量采用索氏乙醚提取法(GB/T 6433—2006)测定,OM含量采用550℃灰化法(GB/T 6438—2007)测定。碳水化合物(TCHO)和GE按照以下公式计算。
OM(%)=DM(%)-CA(%)
TCHO(%)=DM(%)-CP(%)-EE(%)
GE(MJ/kg)=(5.6×CP+4.2×TCHO+9.4×EE)×4.18/1 000
粪便微生物:在试验结束当天的晨饲前直肠取粪样,放入已灭菌的4 mL离心管中,并将装有样品的离心管放入装有冰袋的泡沫箱中保存(离心管不能直接接触冰袋,应在离心管和冰袋之间加一个纸挡板),用于测定微生物群落。采用细菌培养基培养法测定好氧菌、大肠杆菌、厌氧乳酸菌和沙门氏菌的数量。
按常规方法配制好氧菌培养基、大肠杆菌培养基(麦康凯琼脂培养基)、乳酸菌培养基(MRS琼脂培养基)和沙门氏菌培养基(HE琼脂培养基)。将各培养基121℃灭菌15 min,倒入直径90 mm的培养皿中,好氧菌培养基厚度4 mm,厌氧菌培养基与皿口相平。细菌数量通过平板菌落计数法用肉眼观察菌落个数。
平板菌落计数法:①灭菌:培养皿和枪头放入高压蒸汽锅中灭菌。②编号:取无菌培养基若干,分别用标签纸标记培养皿10-4、10-5、10-6、10-7、10-8和10-9各3份。③稀释:取1.0 g粪样加入9 mL生理盐水,充分振荡使粪样在无菌生理盐水中分布均匀,取混悬液做系列稀释,依次稀释。④取样,分别用移液枪吸取10-4、10-5、10-6、10-7、10-8和10-9稀释液各0.2 mL,加入相应的培养皿中间。⑤倒平板:分别向盛有不同稀释度菌液的培养基中倒入冷却至45℃左右的选择培养基,摇匀,37℃培养48 h。⑥计数:计算同一稀释度3个平板中的菌落平均数,根据稀释倍数计算出每克粪便中所含的菌数(用对数lg CFU/g表示)。
1.4 数据统计与方法
试验数据处理采用SAS 9.4软件进行统计,各处理组间差异采用单因子方差(one-way ANOVA)分析,用TuKey多组极差检验法进行多重比较,显著性水平P<0.05。
2 结果与分析
2.1 菌酶协同对犊牛生长性能的影响(见表2)
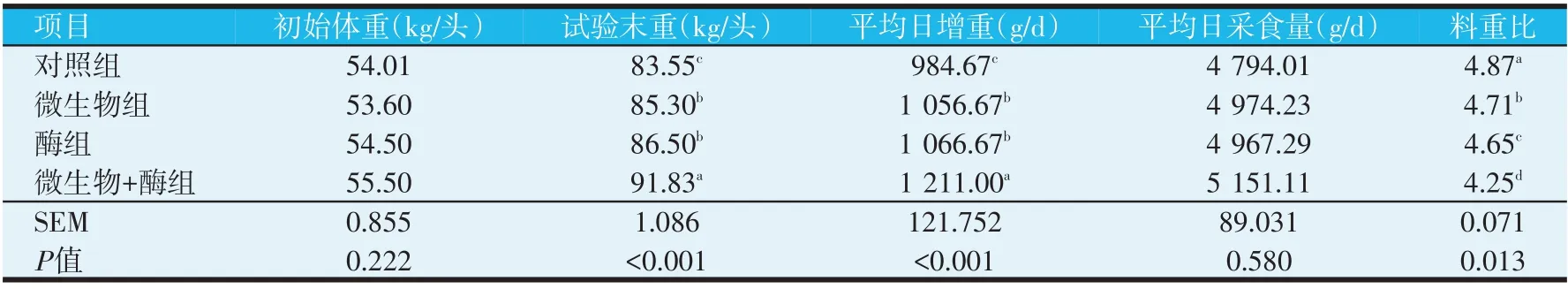
表2 犊牛生长性能的比较分析
生长性能方差分析表明,微生物+酶组的试验末重和平均日增重显著高于酶组、微生物组和对照组(P<0.05),而料重比显著低于酶组、微生物组和对照组(P<0.05)。酶组和微生物组的试验末重和平均日增重显著高于对照组(P<0.05),而料重比显著低于对照组(P<0.05)。酶组的料重比显著低于微生物组(P<0.05),其他均差异不显著(P>0.05)。
2.2 菌酶协同对犊牛粪便微生物的影响(见表3)
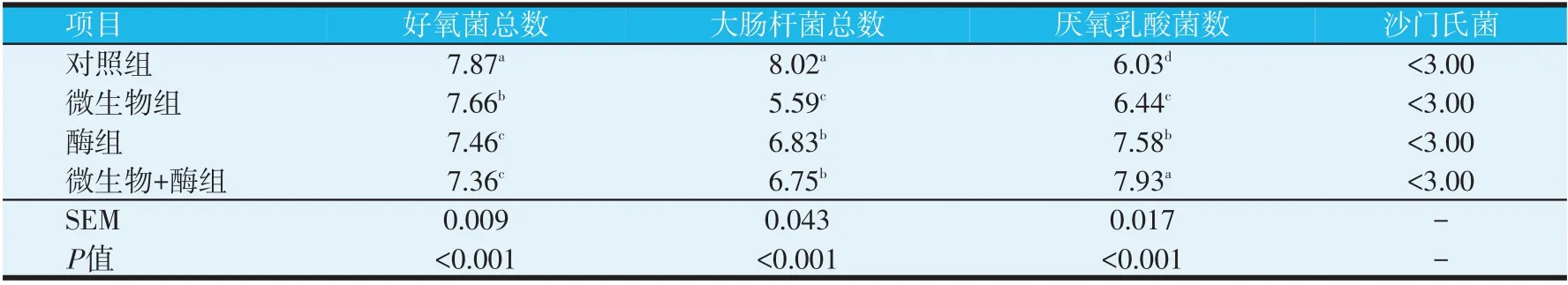
表3 犊牛粪样微生物的比较分析(lg CFU/g)
方差分析表明,与对照组相比,微生物组、酶组和微生物+酶组的好氧菌和大肠杆菌总数均显著降低(P<0.05),而厌氧乳酸菌数显著升高(P<0.05)。微生物+酶组和酶组的大肠杆菌总数、厌氧乳酸菌数均显著高于微生物组(P<0.05),而好氧菌总数则显著低于微生物组(P<0.05)。微生物+酶组的厌氧乳酸菌数又显著高于酶组(P<0.05),其他均差异不显著(P>0.05)。
2.3 菌酶协同对犊牛粪便鲜样基础上养分含量的影响(见表4)
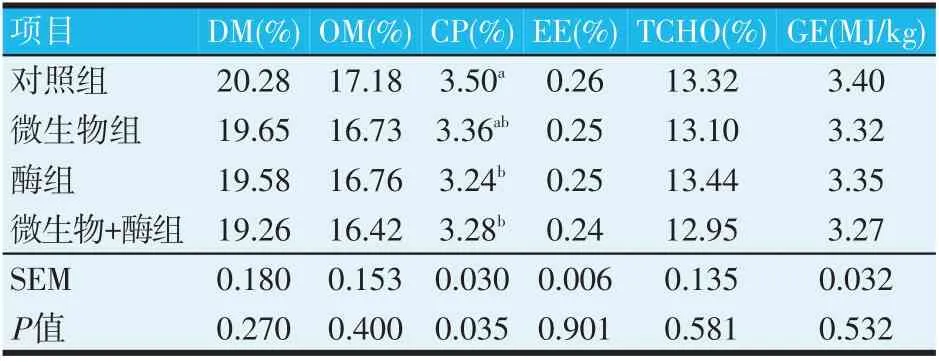
表4 犊牛鲜粪养分含量的比较分析
方差分析表明,微生物+酶组和酶组鲜粪的CP含量显著低于对照组(P<0.05),其他均差异不显著(P>0.05)。
2.4 菌酶协同对犊牛粪便DM基础上养分含量的影响(见表5)
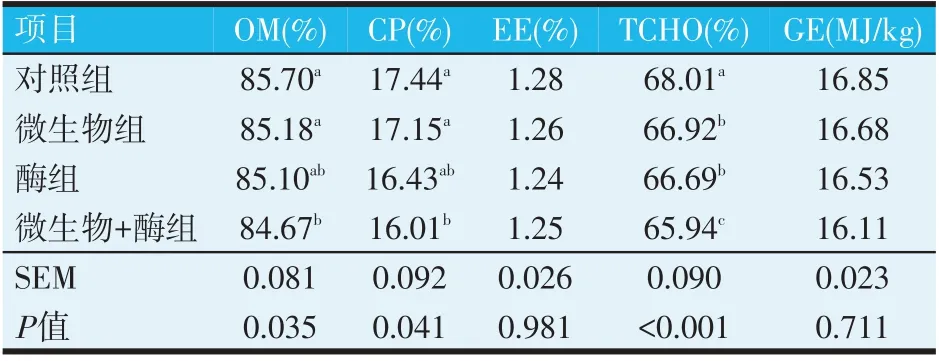
表5 犊牛干粪养分含量的比较分析
方差分析表明,微生物+酶组的OM、CP含量和TCHO含量显著低于对照组(P<0.05)。微生物组、酶组的TCHO含量显著低于对照组(P<0.05),其他均差异不显著(P>0.05)。
3 讨论
3.1 菌酶协同对犊牛生长性能的影响
犊牛的平均日增重、平均日采食量和料重比是反映犊牛生长性能最直观的指标[7]。犊牛等幼龄反刍动物的消化系统不完善,消化道所分泌的消化酶的数量远远不能满足需要,犊牛主要依赖皱胃和小肠来消化牛奶和日粮,其消化特征与单胃动物类似。30日龄左右的西杂母犊牛日粮中添加复合酶制剂(纤维酶、木聚糖酶、果胶酶、葡萄糖和淀粉酶)显著提高日增重[8]。复合酶制剂(木聚糖酶、β-葡聚糖酶、β-甘露糖酶、纤维素酶、果胶酶和中性蛋白酶)对70日龄左右的断奶西门塔尔公犊牛的平均日采食量没有显著影响,但200 g/t添加量组的平均日增重显著高于对照组,可能是酶制剂提高了日粮中的非淀粉多糖的分解,促进了犊牛对日粮的消化和吸收,从而使犊牛的日增重上升[9]。犊牛胃肠道内微生物种类和数量远远低于成年牛,不能依赖胃肠道内的微生物来消化食糜。地衣芽孢杆菌显著提高新生荷斯坦犊牛的平均日增重,但对平均日采食量均无显著影响[10]。但是复合菌(植物乳杆菌和枯草芽孢杆菌)及益生元(植物乳杆菌、枯草芽孢杆菌和低聚果糖)均没有显著改善3日龄荷斯坦母犊牛的平均日采食量和平均日增重[11]。微生态和酶制剂联合添加对犊牛生长性能的研究较少。谭树义等[12]研究表明,1 kg/t复合酶和20 g/t乳酸菌制剂制作的青贮鲜食玉米秸秆显著提高11月龄海南黑牛的试验末重和平均日增重。郑海英等[13]研究证实,复合微生态制剂和纤维素复合酶制剂显著改善250 kg左右西门塔尔架子牛的生长性能。本试验中,复方微生态制剂(酵母菌和枯草芽孢杆菌)和复方酶制剂(木聚糖酶、纤维素酶、葡聚糖酶)联合使用显著提高犊牛的平均日增重和试验末重,而料重比则显著降低,表明菌酶协同效果显著优于单独使用酶制剂或微生物添加剂,显著提高犊牛的生长性能。
3.2 菌酶协同对犊牛粪便微生物含量的影响
犊牛粪便中的大肠杆菌、厌氧乳酸菌、好氧菌和沙门氏菌含量是反映犊牛肠道健康状况的重要指标。有研究表明,当肠道内大肠杆菌数量超过乳杆菌的2~5倍时,就会出现犊牛消化功能障碍或抵抗力下降的情况,进而引发疾病[14]。尚未见菌酶协同影响犊牛粪便微生物含量的文献报道。0.2%复合酶制剂(β-葡聚糖酶、木聚糖酶和纤维素酶)的早籼稻型饲粮显著降低体重约35 kg的“长加”二元杂交猪粪便中的大肠杆菌数量[15]。卢奇成等[16]研究表明,酵母菌(布拉氏酵母菌)降低新生荷斯坦犊牛粪便中大肠杆菌的数量,提高乳酸菌数量。给30日龄左右的海福特牛和日本黑牛杂交一代犊牛的基础饲粮中添加丁酸梭菌(4 g/d和8 g/d),粪便中丁酸梭菌数量分别提高了5.3倍和7.4倍,大肠杆菌较对照组显著降低,8 g/d组沙门氏菌数量显著低于对照组[17]。研究发现,菌酶协同[1 g/kg植物乳杆菌+1 g/kg复合酶(β-葡聚糖酶、β-木聚糖酶、β-甘露糖酶和蛋白酶)]使断奶仔猪粪便中乳酸菌数量和乳酸菌/大肠杆菌比值有增加趋势,大肠杆菌数量有降低趋势[18]。复合酵母培养物(5 g/kg)和菌酶协同(5 g/kg复合酵母培养物+0.3 g/kg木瓜蛋白酶)处理的断奶仔猪粪便乳酸菌数量和乳酸菌/大肠杆菌值显著高于对照组,大肠杆菌数量显著低于对照组[19]。本试验中,复方微生态制剂(酵母菌和枯草芽孢杆菌)组犊牛粪便中的大肠杆菌最低,菌(酵母菌和枯草芽孢杆菌)酶(木聚糖酶、纤维素酶、葡聚糖酶)协同作用对好氧菌和厌氧乳酸菌的效果最明显。综上所述,菌酶协同降低犊牛粪便好氧菌和大肠杆菌总数,提高厌氧乳酸菌数量,对于犊牛腹泻具有一定的预防作用。
3.3 菌酶协同对犊牛粪便养分含量的影响
牛粪中各养分的含量受日粮组成、营养水平、牛品种、牛本身对饲料的消化情况、饲料品质以及饲料的加工程度等多因素的影响[20]。研究表明,复合酶(淀粉酶和胃蛋白酶)显著提高35~60日龄犊牛对OM、淀粉和CP的表观消化率[21]。地衣芽孢杆菌、枯草芽孢杆菌和米曲菌的复合酶制剂(3 g/kg)显著提高4~6月龄荷斯坦犊牛对颗粒TMR日粮的CP、酸性洗涤纤维的表观消化率[22]。微生态和酶制剂联合添加对犊牛表观消化率的研究较少。菌酶协同(0.25%复合酶制剂+0.25%芽孢杆菌类微生态制剂)显著提高断奶仔猪能量、CP和粗纤维的表观消化率[23]。本试验中,菌酶协同作用显著降低鲜粪中CP和干粪的OM、CP、TCHO含量,说明菌酶协同能够促进奶犊牛对饲料OM、CP和TCHO的吸收和利用。但是菌酶协同对犊牛养分消化率的影响需要代谢试验进一步证实。
4 结论
本试验条件下,菌酶协同作用可以降低奶犊牛的料重比,降低犊牛鲜粪的CP含量和干粪的OM、CP和TCHO含量,从而提高犊牛生长性能,且对于粪便微生物的影响优于单独使用微生物制剂或酶制剂。
