左归丸对6.0 Gyγ射线损伤大鼠卵巢组织凋亡和p53蛋白表达的影响
2022-03-22赵粉琴赵艳刘洁颖胡芝霞苟雅姣谢知慧李淑萍
赵粉琴 赵艳 刘洁颖 胡芝霞 苟雅姣 谢知慧 李淑萍
放射治疗手段已经成为恶性肿瘤延缓生命的一种方法,尤其是盆腔放射治疗对对卵巢造成不可逆的损伤成为卵巢功能早衰(premature ovarian failure,POF)的主要原因之一[1-2],严重影响女性生殖健康。雌激素补充治疗虽然可以治疗POF引起的一系列症状,改善生育以及维持骨量有一定意义[3]。但是长期用药可导致内膜癌和乳腺癌[4-5],因此,限制其在临床的使用。肾藏精,主生殖,为天癸之源,故《傅青主女科》有“经水出诸肾”之说[6]。左归丸作为经典的滋补肾阴的药物,临床用来治疗骨质疏松[7-8]、闭经以及围绝经期综合征[9-11]取得很好疗效。但是左归丸对于辐射损伤卵巢的保护作用机制方面研究目前未见相关报道,基于肾主生殖的中医理念,本实验采用模拟临床肿瘤治疗的放射剂量对大鼠进行照射,用左归丸进行干预处理,观察大鼠血清性激素水平、卵巢组织凋亡率,以及p53蛋白表达情况,探讨左归丸对于辐射损伤卵巢的修复作用。
1 材料与方法
1.1 实验动物以及模型制备
雌性SPF级8周龄SD大鼠60只,体质量(220±20)g。实验动物许可证号:SYXK(甘)2015-0005。在自然光照条件下(白/昼12小时/12小时)饲养,3天后用于实验研究。随机分为照射组(50只):照射条件:γ射线6.0 Gy,6 mV,剂量率3 Gy/分钟,照射时长:2.2分钟, (甘肃省人民医院放疗科,高能直线加速器,型号:ONCOR Impression Plut),照射源皮距为100 cm,在10 cm×10 cm特制铅模中,照射野大小为2.0 cm×2.0 cm照射范围;正常组(10只):不进行照射常规饲养。
1.2 主要仪器与试剂
倒置显微镜(日本OLYMPUSC×31,型号:CX21FS1);蛋白电泳仪(Bio-rad,型号:164-5050);ELISA激素水平检测试剂盒(CUSABIO,96T);卵泡雌激素(follicular stimulating hormone,FSH)批号:CSB-E06869r;黄体生成素(luteinizing hormone,LH)批号:CSB-E12654r;雌二醇(estrogen,E2)批号:CSB-E05110r;p53蛋白单克隆抗体(CUSABIO,96T)批号:CSB-RP155094r,规格:20 μL; DAB 显色试剂盒(中杉金桥);二抗(中杉金桥):生物素标记山羊抗鼠免疫球蛋白(SP-9002)、生物素标记山羊抗兔免疫球蛋白(SP-9001);三抗(中杉金桥):辣根过氧化物酶标记的链霉卵白素工作液(SP-9001)。
1.3 实验分组以及药物制备
辐照24小时后随机分成模型组、补佳乐组、左归丸高剂量组、左归丸低剂量组和左归丸高剂量+补佳乐组。灌胃药物剂量计算:补佳乐(按70 kg的成人一天服用左补佳乐1 mg计算,大鼠剂量0.09 g/(kg·d),制备成0.09 mg/mL),按照0.018 g/200(g·d)给药,给药时称重,调整用药剂量;左归丸剂量(按70 kg的成人一天服用左归丸的生药量为105 g 计算,大鼠剂量9.45 g/(kg·d),制备左归丸低浓度煎剂为0.945 g生药/mL(相当于临床等效给药量)、高剂量为5倍4.725 g生药/mL),左归丸(熟地黄、炒山药、山茱萸、牡丹皮、泽泻、茯苓,草药由甘肃中医药大学附属医院提供),按照0.189 g生药/200 g和0.946 g生药/200 g给药。各组大鼠进行无菌饲养(房间用1∶5000浓度的高锰酸钾喷洒消毒,空气用紫外线灯照射30分钟,2次/日,饲料、水及垫料均经高压灭菌)。连续用药21天。
1.4 观察指标及检测方法
1.4.1 大鼠血清性激素水平的检测 治疗结束后,心脏取血1.5 mL,在4℃以3000 r/min离心10分钟,吸取上层血清移入EP管,用96孔ELISA试剂盒检测血清中FSH、E2和LH的水平。
1.4.2 卵巢组织病理学 治疗结束后大鼠采用颈椎脱位处死。取卵巢固定,苏木精—伊红染色观察卵巢内不同发育阶段卵泡数量的变化。用10%戊二醛0.1 mol/L磷酸缓冲液(pH 7.3)固定2小时。常规包埋,取4 μm切片,HE染色。显微镜下观察卵巢组织卵泡变化情况,每个卵巢观察5张切片,计算所有切片卵泡数量以及正常卵泡和闭锁卵泡比例。
1.4.3 通过AnnexinV-FITC/PI法分析细胞凋亡(流式细胞仪检测) 取一侧卵巢组织约0.5 cm2,用眼科剪剪成肉糜状,300目尼龙网过滤,离心,冷乙醇固定,终浓度70%~75%,留取悬液,计数细胞终浓度1×106个/mL,上机检测,计数10000个细胞,测定各期细胞比例及凋亡率。
1.4.4 免疫组化法检测卵巢组织内p53蛋白的表达情况 取固定好的一侧卵巢组织,切片,脱水。3%过氧化氢室温避光作用20分钟,蒸馏水洗,正常山羊血清封闭液室温作用30分钟,倒掉封闭液后,滴加一抗(p53)工作液(1∶100),4℃孵育过夜。分别滴加生物素化二抗(SP试剂盒)、三抗,分别室温作用30分钟,再滴加DAB显色液(1∶20)室温避光作用5分钟,显微镜下控制显色时间,一旦出现最佳颜色,使用蒸馏水停止其显色反应,苏木素复染,酒精脱水,中性树胶封片。同时设染色对照,每张切片随机选取5个不同区域。使用Image-Pro Plus软件(6.0版)测量卵巢内组织中雌激素受体、卵泡雌激素受体和黄体生成素受体阳性表达的平均光密度值。
1.5 统计学处理
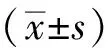
2 结果
2.1 各组大鼠卵巢组织病理切片分析
正常对照组大鼠卵巢可见各级生长卵泡生长活跃,颗粒细胞排列整齐,卵泡体积较大,卵泡液多。辐射模型组大鼠卵巢体积明显缩小,卵泡卵母细胞固锁,周边颗粒细胞固锁,颗粒细胞层较正常减少且排列紊乱,与正常对照组比较,正常卵泡/所有卵泡比例明显减少(P<0.01);给予补佳乐、左归丸处理后,卵巢中窦状卵泡可见,初级卵泡减少,仍有部分卵泡闭锁,颗粒细胞层次较模型组有所增多。尤以左归丸高剂量+补佳乐组窦状卵泡数量增加,正常卵泡/所有卵泡比例与辐射模型组比较明显增加(P<0.05)。结果见表1。

表1 各组大鼠卵巢窦状卵泡所占比例分析
如图所示,正常对照组可见窦状卵泡和多个初级卵泡,卵母细胞核清晰,周边颗粒细胞排列有序。辐射模型组可见多个闭锁卵泡,次级卵泡卵母细胞核固锁(红色箭头),周边颗粒细胞排列紊乱,固锁(黑色箭头)。补佳乐组可见多个初级卵泡和窦状卵泡(卵母细胞核清晰,周边颗粒细胞部分固锁),卵母细胞溶解,颗粒细胞固锁(红色箭头),排列紊乱。左归丸高剂量组可见初级卵泡(卵母细胞核清晰)和次级卵泡(卵母细胞核溶解),周边颗粒细胞固锁(红色箭头),排列紊乱。左归丸低剂量组可见少量初级卵泡(卵母细胞核清晰)和周边颗粒排列有序,未见次级卵泡。左归丸高剂量+补佳乐组可见次级卵泡(卵母细胞核溶解)、窦状卵泡的卵母细胞固锁(红色箭头),周边颗粒细胞排列紊乱,部分固锁(黑色箭头)。见图1。
2.2 各组大鼠血清FSH、LH和E2含量分析
实验过程除正常对照组以外,其余各组均有大鼠死亡。与正常组比较,辐射模型组大鼠血清FSH和LH增高,E2含量降低,差异比较有统计学意义(P<0.05);与模型组比较,补佳乐和左归丸剂量组FSH降低,差异比较有统计学意义(P<0.05),LH降低,E2增高,但差异无统计学意义(P>0.05)。结果见表2。
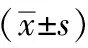
表2 各组大鼠血清FSH、LH和E2含量比较
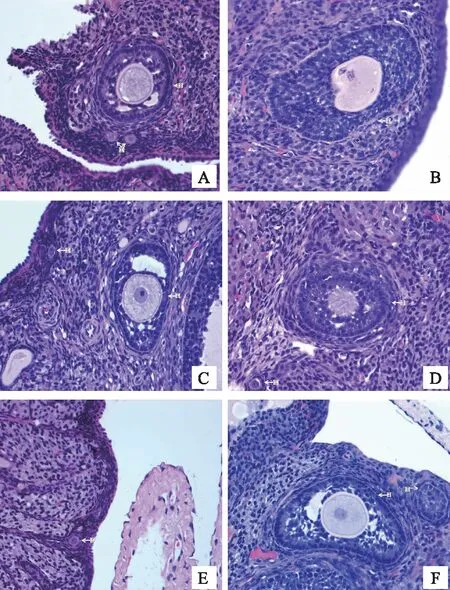
注:①原始卵泡;②次级卵泡;③窦前卵泡;④窦状卵泡。A对照组; B模型组; C补佳乐组; D左归丸高剂量组; E左归丸低剂量组;F左归丸高剂量+补佳乐组。
2.3 各组大鼠卵巢细胞凋亡率和p53蛋白含量分析
与正常对照组比较,辐射模型组流式细胞仪检测出现明显的亚二倍体峰(凋亡峰),卵巢组织凋亡明显,p53蛋白含量增加,比较有显著性差异(P<0.01);与辐射模型组比较,补佳乐和左归丸高剂量组可以降低卵巢组织凋亡率(P<0.05),尤以左归丸高剂量+补佳乐组降低明显(P<0.05);左归丸高剂量组、左归丸高剂量+补佳乐组p53蛋白降低(P<0.05),尤以左归丸高剂量组+补佳乐组降低明显(P<0.05)。结果见表3,图2~3。
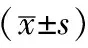
表3 各组大鼠卵巢组织凋亡和p53蛋白表达比较
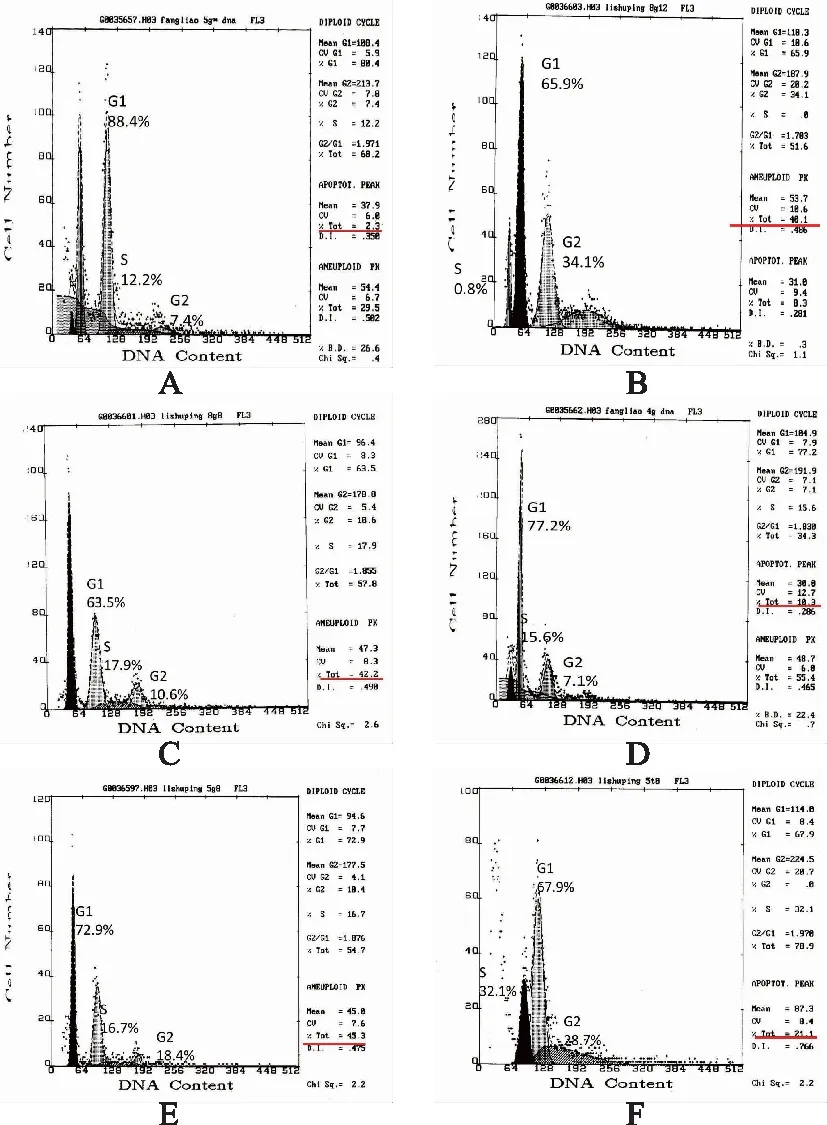
注:A对照组; B模型组; C补佳乐组; D左归丸高剂量组;E左归丸低剂量组;F左归丸高剂量+补佳乐组。
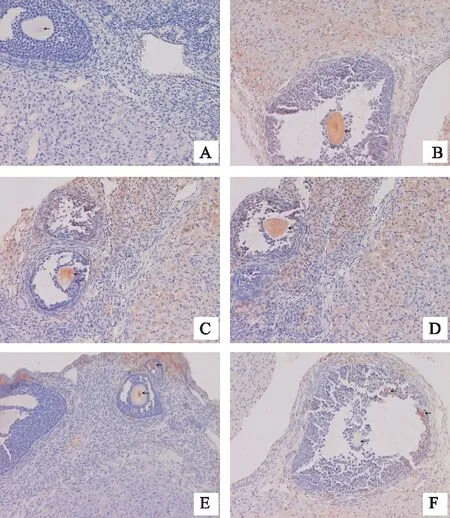
注:A正常组;B辐射模型组;C补佳乐组;D左归丸高剂量组;E左归丸低剂量组;F左归丸高剂量+补佳乐组。p53在卵母细胞上表达,阳性结果显示为棕黄色颗粒(黑色箭头)。
3 讨论
放射治疗对在女性生殖系统损伤中,卵巢最为敏感[12-13],6.0 Gy就可导致卵巢功能衰竭[14]。放疗对卵巢损伤主要在早期卵泡DNA损伤,卵母细胞凋亡,刺激卵泡闭锁,卵泡储备显著下降,发展为POF[15]。完整卵泡由三部分组成,包括卵母细胞、颗粒细胞以及卵泡膜细胞。颗粒细胞起着关键作用,分泌E2,维持卵泡发育,颗粒细胞凋亡是导致卵泡闭锁的主要原因[16]。
颗粒细胞凋亡有多种途径,当细胞氧化应激,辐射引起DNA损伤时,激活p53,抑制细胞周期相关蛋白,细胞停滞在G1/S期,引发凋亡[17]。p53基因与卵泡闭锁机制密切相关[18],在介导颗粒细胞凋亡引起的卵泡闭锁过程中起重要作用[19]。辐照剂量为6.0 Gy 是依据临床辐照模型[20],探讨辐射对卵母细胞损伤以及中医药治疗的作用机制。电离辐射属于中医学的“火邪”,具有直中脏腑导致热毒内蓄损伤人体气血津液、脾肾造化不及作用而产生病证。
研究显示辐射导致POF的主要机制是促进颗粒细胞和卵母细胞凋亡,激发卵泡闭锁,同时激活细胞凋亡的p53途径,加快生长卵泡凋亡,导致卵巢分泌雌激素水平下降,反馈刺激垂体释放促性腺激素(FSH和LH),加速卵巢内残余原始卵泡的发育,如果多次反复辐射,生长卵泡则进一步凋亡,最终导致POF发生。
中医认为肾主生殖,肾气亏损造成卵泡闭锁,是POF主要机制。左归丸出自张仲景的《景岳全书》,具有滋补肾阴,填精益髓等功效。研究表明左归丸具有修复神经系统损伤、促进生殖发育、改善骨代谢、调节免疫、调节内分泌等作用[21],但在辐射损伤卵巢功能恢复方面研究较少。
本研究结果显示:与模型组比较,各药物组处理后大鼠卵巢组织中有初级和次级卵泡发育,但也存在多个闭锁卵泡,血清FSH、FSH/LH明显降低,E2明显增高,p53蛋白表达明显下降,尤以左归丸高剂量和补佳乐组作用最显著。推测可能是:(1)左归丸通过补肾填精促进颗粒细胞增值继而促进卵泡的发育,促进卵巢合成雌激素,负反馈抑制下丘脑—垂体—卵巢轴,降低了FSH、FSH/LH分泌;(2)辐射导致POF,雌激素水平下降,反馈性促进垂体分泌FSH,促进参与原始卵泡发育;(3)左归丸通过下调卵巢组织p53蛋白的表达抑制细胞凋亡。与前期研究左归丸含药血清促进卵巢颗粒细胞增殖一致[22]。Liu等[23]研究发现左归丸可以改善低雌激素状态,与补肾药物可以改善卵巢功能低下状态功能一致[24]。
因此,放疗损伤引起的POF是一种不可逆的损伤,尤其是对卵母细胞的发育。经典补肾药物左归丸对POF在临床以及动物实验已经证明,其可以促进卵巢功能恢复,调理女性生殖内分泌[25],为左归丸临床应用防治辐射损伤卵巢保护作用提供依据。
