闽江下游湿地植物硅素空间分布特征及其影响因素
2022-03-22王赛翟水晶邱思婷俞新慧
王赛,翟水晶,b*,邱思婷,俞新慧
(福建师范大学 a.地理科学学院,b.地理研究所,福州 350007)
硅(Si)是多种植物生长所需的营养元素[1],也是控制陆地和水生生态系统机能的重要元素。植物在其生长过程中不断地从水体或土壤溶液中吸收可溶性硅酸盐并以生物硅(BSi)的形式贮存在植物体内。生长结束后,植物残体逐渐分解,其体内的BSi逐渐释放到土壤中,其中大部分被植物再吸收,少量保留在土壤中[2-4]。植物与土壤之间存在着强烈的硅生物地球化学循环,这不仅对陆地生态系统硅养分平衡至关重要,还能阻止溶解性硅酸盐由陆地生态系统经由河流向海洋生态系统转移[4-6],特别是河流沿岸的植物对其具有一定的截留作用,减缓了硅向河流、海洋的输出[3,7-8],对全球硅的生物地球化学循环有重要的影响。目前关于河流硅素方面的研究较多,主要集中在分布特征、化学行为、硅限制和硅收支等领域[9-11],而关于河流沿岸植物硅素的研究相对较少。鉴于此,以闽江下游为研究对象,对闽江下游沿岸湿地植物硅素的分布特征及其影响因素进行研究,以期为河流湿地植物对硅素的截留研究提供基础数据。
1 材料与方法
1.1 研究区概况
闽江发源于福建、江西交界的建宁县均口镇,闽江下游是指水口电站堤坝下至入海口(含闽江北港和南港、长门水道及梅花水道),既流经经济和工业较为发达的福州市区[12],又受到比较明显的闽江河口潮汐的影响[13]。其气候类型为亚热带海洋性季风气候,温暖潮湿,雨热同期;土壤中富含铁、铝等黏土矿物;河口区域受陆地、海洋和大气之间相互作用较为强烈[14-15]。
1.2 样品采集与处理
于2019 年10 月沿闽江下游岸边湿地设置6 个样点,分别为S1(安下村,优势种为半夏Pinelliaternata)、S2(闽侯大桥北侧,优势种为丁香蓼LudwigiaprostrataRoxb)、S3(塔礁洲,优势种为短叶江芏Cyperusmalaccensis)、S4(蝙蝠洲,优势种为芦苇Phragmitesaustralis)、S5(晓澳村,优势种为互花米草Spartinaalterniflora)、S6(梅北村,优势种为互花米草Spartinaalterniflora)。在每个样点随机选取3 个25 cm×25 cm的样方,用剪刀沿地面割下植物地上部分,用挖掘法将样方内根系全部挖出装袋;用卷尺测量出植物株高,计算密度,并做好记录;将植物样品在实验室内分根、茎、叶、鞘、枯和穗,清洗干净并放入烘箱中杀青烘至恒重,称重做记录;将植物样品研磨后均过60目筛,装袋待测。同时在每个样方附近用直径10 cm,高80 cm的土壤柱状采样器采集0~60 cm土样,以10 cm为间距分成6 层,立即装入自封袋带回实验室,自然风干后研磨,过80 目筛,保存待测。
1.3 样品测定
采用“热碱法提取—硅钼蓝法”测定植物生物硅。具体操作为:称取30 mg左右植物样品,放于50 mL聚乙烯离心管中,加入50 mL 85℃ 0.1 mol·L-1的Na2CO3,放入85℃恒温水浴5 h,用硅钼蓝比色法测定提取液中的硅含量[16]。
土壤理化指标的测定:含水率采用土壤墒情速测仪测定;pH采用水土质量比5∶1浸提液的方法测定;EC采用便携式电导率仪(EC Testr11+ Multi Range)测定,粒度采用激光粒度分析仪(Mastersizer 2000F)测定。不同样地土壤理化性质见表1,表中数值为6 个样点6 层土壤的平均值±标准误(n=108)。
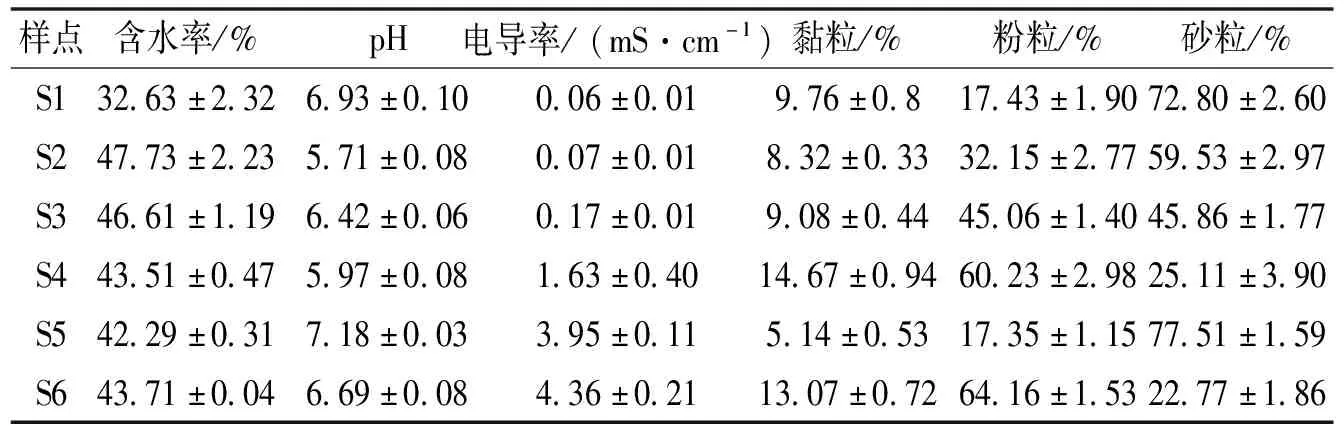
表 1 不同样地土壤理化性质
1.4 指标计算
不同植物各组织生物硅储量(Ri,g·m-2)为各组织(i,包括根、茎、叶、鞘、枯和穗)生物硅含量(Ci,mg·g-1)与其生物量(Bi,g·m-2)的乘积,即:
Ri=Ci×Bi/1000
(1)
不同植物各组织生物硅储量分配比(Ai,%)为各组织生物硅储量与总生物硅储量之比,采用以下公式计算:
(2)
不同植物生物硅含量的茎/根比、叶/根比、鞘/根比、枯/根比和穗/根比可参照Dahmani-Muller[17]提出的公式计算,即地上各组织生物硅含量(Ci,mg·g-1)与根系生物硅含量(Croot,mg·g-1)之比,用来评价植物生物硅从地下部分向地上各部分的转移能力。转移系数D可表示为:
(3)
植物根冠比一般指植物地下生物量(B下,g·m-2)与地上生物量(B上,g·m-2)的比值,即:
(4)
1.5 数据分析
采用Excel 2007和Origin 8.0进行数据分析和绘图处理,采用SPSS进行单因素方差分析(One-way ANOVA)和Pearson相关分析。
2 结果与分析
2.1 闽江下游湿地植物基本生态特征
整体而言,闽江下游湿地植物的总生物量随着距海距离的缩短而变大;具体而言,各样点植物的地上生物量(183.89~2 568 g·m-2)均高于地下生物量(86.19~590.40 g·m-2),且地上生物量与地下生物量的差值也随着距海距离的缩短而变大(图1)。闽江下游湿地植物密度与株高未呈现明显变化规律且不同植物相差悬殊,其中密度最高值出现在S3-短叶茳芏,为1 002.67 株·m-2,最低值出现在S2-丁香蓼,为64 株·m-2,株高最高值出现在S4-芦苇,为156.78 cm,最低值出现在S1-半夏,为40.39 cm。
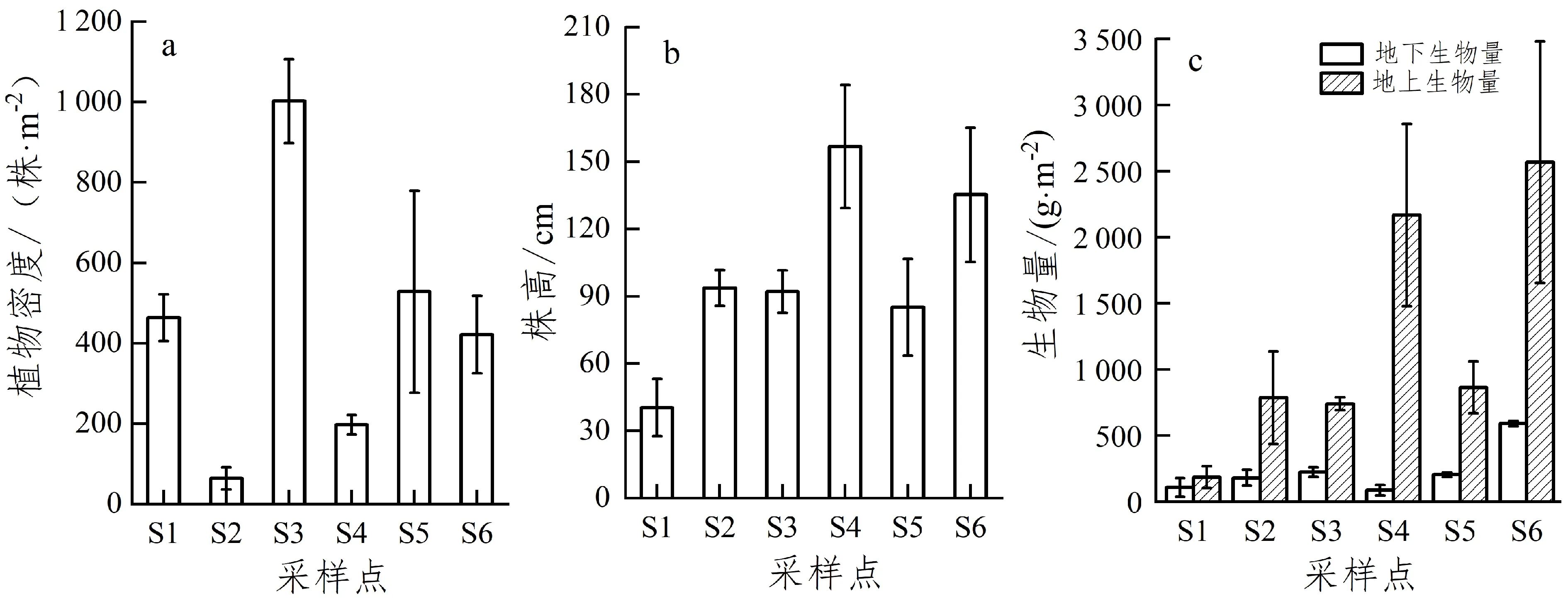
图 1 闽江下游湿地植物基本生态特征
2.2 闽江下游湿地植物各组织生物硅含量分布特征
闽江下游湿地不同种植物生物硅含量差异较大,而同种植物互花米草在S5点和S6点生物硅含量比较接近(图2)。就地下根系的生物硅含量对比而言,不同样点的植物中,S5-互花米草和S6-互花米草根的生物硅含量最小,分别为2.02 mg·g-1和2.37 mg·g-1,而S4-芦苇根的生物硅含量最大,为16.88 mg·g-1;就地上部分各组织生物硅含量对比而言,茎叶鞘枯在5种植物中均呈现出最高含量。
2.3 闽江下游湿地植物各组织硅储量的分配比
据图3可知,整体而言,多数植物生物硅占比最大的组织为茎,就地下根系而言,S2-丁香蓼占比最大为22.51%。同种植物互花米草在S5点和S6点各组织生物硅占比较为相近。
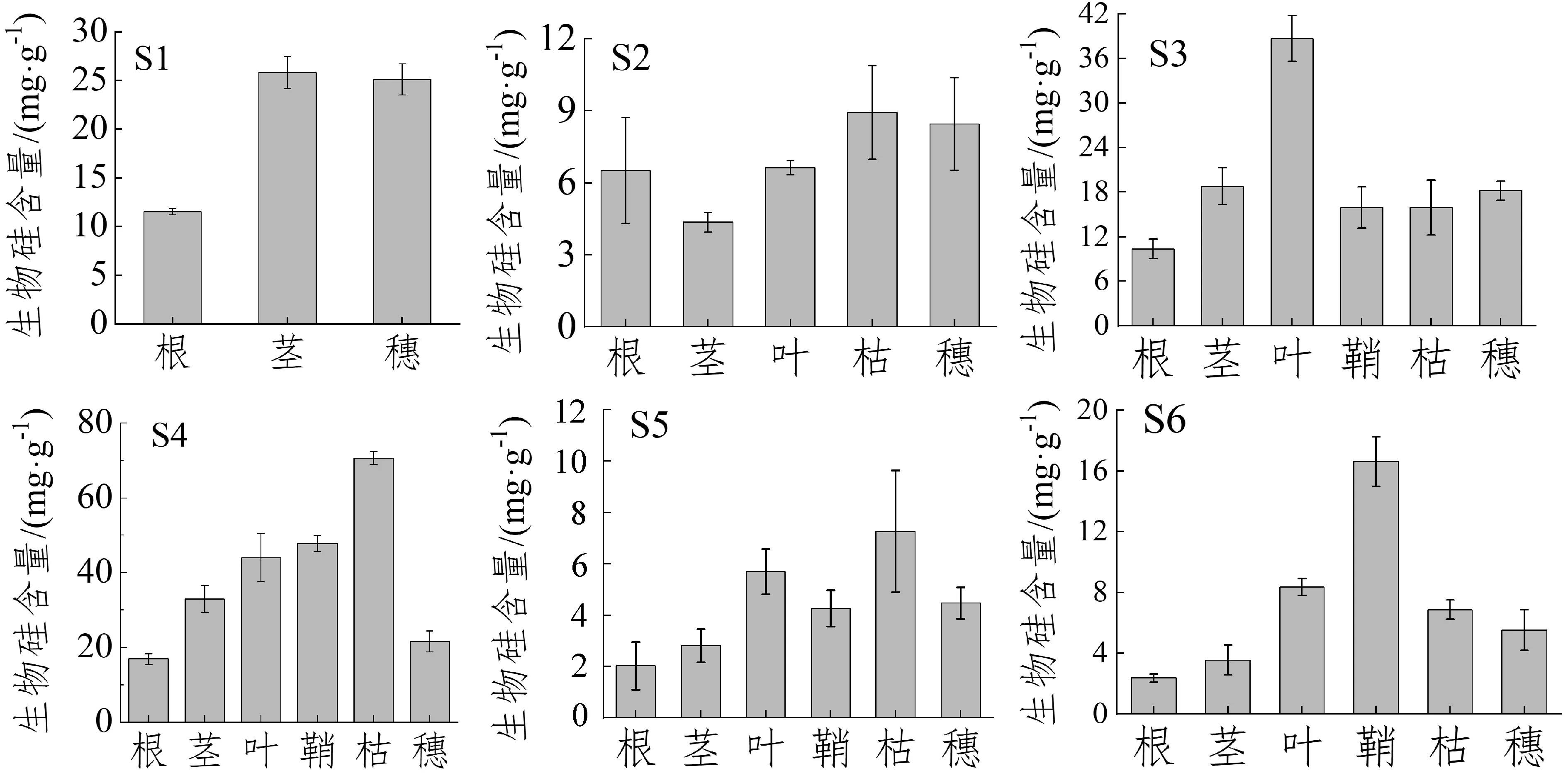
图 2 闽江下游湿地植物生物硅含量分布特征
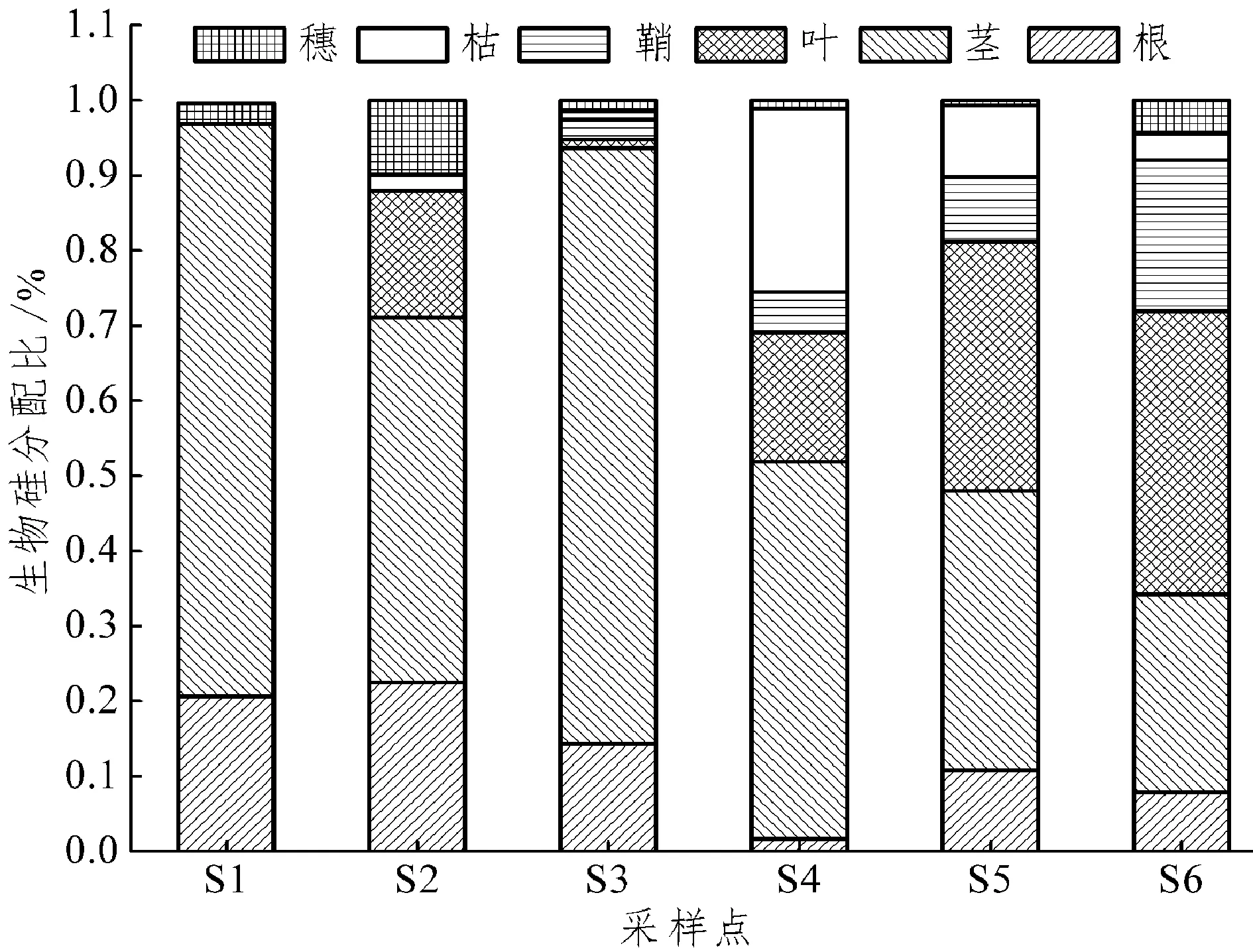
图 3 闽江下游湿地植物生物硅分配比
2.4 闽江下游湿地植物转移系数和根冠比
据表2可知,除S2-丁香蓼外,绝大多数植物地上各部分与地下根系生物硅的比值高于1,本研究中各样点植物均呈现出明显的末端集中趋势。据表3可知,S1-半夏根冠比相较其余各点植物明显偏大为0.581,S2-丁香蓼和S6-互花米草根冠比最小为0.229。

表 2 闽江下游湿地植物转移系数

表 3 闽江下游湿地植物根冠比
3 讨论
3.1 植物的生长特性对闽江下游植物硅素分布的影响
本研究发现6个样点的植物中,除了S1-半夏之外,其余各点的植物中,S2-丁香蓼、S4-芦苇、S5-互花米草中枯体的生物硅含量大于其余所有组织的生物硅含量,其余两点的短叶茳芏和互花米草中的枯体的生物硅含量也较大,这是因为枯体部分生物硅含量会随着枯体易变成分(如有机碳和有机氮)的淋溶和分解(碳、氮分解比硅快)而在枯体中相对增大[18]。由于植物正处于生长期,硅在植物各组织中的分配比例因不同的生长阶段而异,早期(生长期)以茎的分配比例最大,其次为穗和叶,此外,由根系吸收的水体硅酸盐可能会在茎中沉淀[19],因为在向上传输过程中硅素从茎到叶的转移存在一个过渡期,因此推断这种存在于茎的硅是否为沉淀形态且较难向其他组织转移,由此造成叶含硅量低,这还需要进一步证实。本研究还发现,各组织中地下根系生物硅含量普遍很低,主要有两个原因:一是地下根系硅的富集能力较地上各部分低,且植物根系吸收生物硅后并不在根系中沉积,而是通过茎向地上部分输送,并在蒸发作用最强烈的地方因生物硅饱和而沉积下来[19];二是由于地下根系生物量分配比明显高于地上各组织,稀释效应较为明显,导致地下根系生物硅含量较低。不同样点的植物其生物硅分配比大部分集中于茎,且均高于其他组织。这主要是由于生长旺季不同植物各组织对养分需求存在差异,而茎在养分充足的条件下生长迅速,生物量迅速增加,茎生物量及其分配比均远高于其他组织,尽管其生物硅含量不是很高,但其生物硅分配比仍远高于其他组织。
运用单因素方差分析同一植物不同组织、同一组织不同植物的生物硅含量。分析同一植物不同组织发现,除了S4-芦苇各组织生物硅含量呈现较显著差异之外,其余5个点的4种植物生物硅含量在不同组织均未呈现显著差异;分析同一组织不同植物发现枯体生物硅含量在不同植物中呈显著差异。综合来看,生物硅在大多数植物的组织分化中并不占据特殊的主导作用。在植物的各个组织中,枯体在不同植物中生物硅含量呈现显著差异的原因可能是不同植物枯体的各种成分淋溶分解情况比较复杂,导致不同植物枯体的生物硅含量相对变化情况比较复杂,从而导致不同植物枯体生物硅含量差异较大。
据表2可知,绝大多数植物地上各部分与地下根系生物硅的比值高于1,说明植物吸收硅后,在根系中沉积较少,而主要是通过蒸腾流向地上部分,并沉淀于地上部分。据李晓艳等的研究,因不同植物对硅的吸收与累积机制以及不同组织对硅素的营养功能不同,导致硅在植物体内的分布存在着组织间的差异,且存在“末端分布现象”的规律,即从根到叶呈现逐渐增加的趋势[20]。本研究中各样点植物均呈现出明显的末端集中趋势,这表明闽江下游植物符合“末端分布现象”的规律。
植物株高和密度是植物最基本的形态特征,在一定程度上可以指示植物的生长环境[21-22],能够反映种群的生态学特性、生产力以及生长发育状况[23]。对本研究中植物株高和密度与植物各组织生物硅含量进行Pearson相关分析,发现在密度方面,除叶与植物密度呈现正相关之外,其余各组织均与密度呈负相关关系;在株高方面,发现除穗外,其余各组织均与株高呈正相关关系,这与法国布雷斯特湾湿地发现的植物生物硅含量与植株高度线性相关比较接近[24]。本研究还发现,在最值方面,本地土著种短叶茳芏占据种群密度最大值,本地入侵种芦苇占据株高最大值[25]。
3.2 影响闽江下游植物硅素分布的环境因素
植物根系生存环境及其生长状况可以决定个体的长势,影响植物的根冠比、生物量和植物群落等,进而影响植物对营养元素的吸收与富集能力[26]。根冠比是植物地下生物量与地上生物量的比值,是描述植物地上部分生物量与地下部分生物量配置关系的一个重要参数[27]。对各样点植物根冠比与土壤含水率进行Pearson相关性分析,发现二者呈现负相关关系,其中S1-半夏土壤含水率最低(32.6%),其根冠比也最大(0.58)。这可能是因为植物长期生活在较为缺水的环境中,为了适应水分缺乏等不利条件的影响,将更多的能量分配给根部,特别是集中于地下对于水分、养分的吸收,从而促进了植物地下根系的生长。
利用Pearson分析植物根系生物硅含量与土壤盐度的相关性发现:植物根系生物硅含量与盐度均呈负相关关系。这可能是因为植物生长会受到盐分胁迫的限制,进而降低植物的初级生产力,对可溶性硅酸盐的吸收与累积较差[19,24],使得随着盐度的增大植物根系生物硅含量呈降低趋势。本研究对不同样点植物各组织生物硅含量与根系生物量进行Pearson相关分析,发现其呈负相关关系,这一点与高会等研究闽江口鳝鱼滩湿地近岸区植物生物硅含量高于近海区源于其根系生物量较大的结论相反[28],这从侧面反映了本研究及鳝鱼滩湿地的研究中远海区植物生物硅含量高于近海区的原因更大可能是受到盐分胁迫的影响。对植物根系生物硅含量与土壤其他理化指标进行Pearson相关分析,发现在含水率方面,根系生物硅含量与其呈负相关关系;在pH方面,根系生物硅含量均与pH呈负相关关系,这可能是因为水分适中而酸度较大的环境有利于土壤中硅酸盐矿物的分解,从而会增加植物根系对于硅的吸收,导致植物体内硅含量增高。在粒径方面:植物根系生物硅含量与黏粒含量呈负相关关系;根系生物硅含量与粉粒含量呈显著正相关关系(P<0.05);根系生物硅含量与砂粒含量呈极显著正相关关系(P<0.01)。这表明,土壤粒径越大,植物生物硅含量越大,这可能是因为土壤粒径越大,硅酸盐分解速度越快,从而有利于植物根系对于硅的吸收。
4 结论
1)闽江下游植物枯体生物硅含量普遍较高,地下根系生物硅含量普遍较低。
2)闽江下游植物生物硅含量与种群密度呈负相关关系,与株高呈正相关关系。
3)闽江下游植物根系生物硅含量与土壤盐度呈负相关关系,与根系生物量也呈负相关关系,表明近海区植物根系生物硅含量低于远海区,这主要是因为近海区受到盐分胁迫的限制。
