基于金属有机骨架材料和酶切放大的适配体荧光法检测副溶血性弧菌
2022-03-22冯润婵谭树良毋福海苏政权贺锦灿
冯润婵,袁 萍,谭树良,毋福海,苏政权,白 研,贺锦灿
(广东药科大学 公共卫生学院,广东 广州 510310)
副溶血性弧菌(Vibr io parah aemol yticus,V.P)是革兰氏阴性菌,多存在于海水、海产品及盐渍食品中[1]。误食V.P污染的海产品容易导致胃肠道疾病[2],致病率甚至超过鼠伤寒沙门氏菌、大肠杆菌等食源性细菌[3]。由V.P引起的食物中毒事件越来越多,对食品质量安全和人体健康造成了极大威胁。目前,检测V.P的方法主要有传统平板培养法、双层平板法、酶联免疫法、PCR法、实时荧光PCR法、双重PCR法、环介导等温扩增法(LAMP)、纳米材料辅助信号法等[4-9]。其中平板法操作复杂、耗时长,无法实现V.P的快速检测[4-5];免疫法和PCR法操作不当易导致假阳性结果[6-7];LAMP法对技术人员的要求高[8]。基于纳米材料的分析方法具有简单、快速的优点,但灵敏度有限。因此,建立一种快速、灵敏的海产品中V.P的检测方法具有重要意义。
纳米材料与DNA酶放大技术结合可显著提高纳米分析方法的灵敏度。例如,Lu等[9]以纳米石墨烯为荧光猝灭平台,建立了一种核酸酶辅助信号放大法检测三磷酸腺苷和可卡因的分析方法,检出限比未放大的方法低3个数量级。金属有机骨架材料(MOFs)[10]是一类由金属离子(或簇)与有机配体连接而成的晶体结构的杂化材料,比表面积大,孔隙率高,在分离、催化、生物传感等领域中具有重要应用[11]。特别地,MOFs可通过π-π作用和电荷作用吸附带负电的单链DNA分子[12],且过渡金属离子的开放位点以及有机配体的共轭π电子系统具有荧光猝灭性质,背景信号低,是理想的纳米荧光猝灭材料。核酸适配体(Aptamer)[13]是对特定靶标具有特异性识别作用的短链DNA分子,具有特异性好和亲和力高等特点,可以提高方法的选择性[14-16]。核酸外切酶Ⅰ(ExoⅠ)[17]具有特异性好、敏感性高、操作简单、反应条件简单、无需依赖特定识别位点等优点,在信号放大[18]中起关键作用。
本文基于Cu-MOF的荧光猝灭性质,适配体的特异性和ExoⅠ的催化水解作用,建立了一种快速、灵敏检测V.P的适配体荧光法。在室温下合成Cu-MOF,研究其形貌、结构及荧光猝灭机理,通过优化Cu-MOF的体积、猝灭时间、ExoⅠ用量及恢复时间等分析条件,建立了快速检测V.P的适配体荧光分析方法,并成功应用于实际水产品中V.P的检测。
1 实验部分
1.1 仪器与试剂
F-7000荧光分光光度计(日本日立有限公司);FA1204B电子分析天平(上海佑科仪器仪表有限公司);DF-101S磁力搅拌器(巩义市予华仪器有限责任公司);H3-18K台式高速离心机(河南可成仪器设备有限公司);YC-S30恒温水浴锅(天津市泰斯特仪器有限公司);LGJ-10C冷冻干燥机(北京四环科学仪器厂有限公司);Hitachi S-4800扫描电子显微镜(日本日立有限公司);SmartLab X射线衍射仪(日本理学有限公司);Zsizer Nano ZS90 zeta电位仪(英国马尔文公司)。
均苯三甲酸(H3BCT)、醋酸铜(上海阿拉丁生化科技股份有限公司);V.P(ATCC17802)、沙门氏菌(S.A,ATCC14028)、单增李斯特菌(L.M,ATCC19115)、大肠杆菌(E.coli,ATCC25922)、TCBS琼脂(广东环凯微生物科技有限公司);荧光素标记的V.P核酸适配体(3′-FAM-TCTAAAAATGGGCAAA GAAACAGTGACTCGTTGAGATACTAAA-5′[19])购于生工生物工程(上海)股份有限公司;ExoⅠ(C610019,BBI生命科学有限公司);实验用水为三次蒸馏水。
1.2 实验方法
1.2.1细菌培养及计数将复苏液(3%NaCl碱性蛋白胨水)加入到V.P冻干菌种中混匀,制成菌悬液,于36℃培养箱中培养24 h。用生理盐水稀释至不同浓度,参考国标测定菌落总数[20],用倾注平板法进行V.P计数,以浊度为横坐标,浓度为纵坐标,得到标准曲线回归方程。
1.2.2Cu-MOF的合成量取100 mL 20 mmol/L的H3BCT加入250 mL三颈烧瓶中,一边搅拌一边加入等体积、等浓度的醋酸铜溶液,搅拌30 min后转移至15 mL离心管中,离心,用乙醇-水溶液(2∶8,体积比)洗涤两次,通过冻干机获得Cu-MOF蓝色冻干粉末。
1.2.3分析方法向微量离心管中依次加入一定体积的Cu-MOF溶液(2.32 mg/mL)、荧光素FAM标记的适配体溶液,在涡旋器上振荡混匀,避光猝灭一定时间;加入一定浓度的V.P菌悬液、适量ExoⅠ溶液和缓冲溶液,于37℃下孵育一段时间后,混合液置于荧光分光光度计中检测。设置实验组和对照组,每组平行3次。
1.2.4样品处理与分析准确称取25 g新鲜虾肉、八爪鱼,分别向其中加入225 mL 3%的NaCl碱性蛋白胨水,采用均质器混匀,离心[21],取上清液,按照“1.2.3”实验方法进行测定。
2 结果与讨论
2.1 分析原理
本研究的原理见图1,Cu-MOF具有荧光猝灭性质及保护适配体不被ExoⅠ水解的作用,当荧光分子标记的核酸适配体吸附在Cu-MOF上,荧光被猝灭,加入V.P后,核酸适配体与V.P选择性结合,脱离Cu-MOF表面,荧光得到一定程度的恢复。在ExoⅠ的催化作用下,脱离Cu-MOF表面的适配体被水解,释放出V.P,V.P进一步结合其他吸附在Cu-MOF上的适配体,使水解反应循环进行,荧光信号进一步放大。在一定范围内,V.P浓度与荧光恢复程度(ΔF)呈线性关系,据此建立MOFs材料和酶切放大的适配体荧光法。
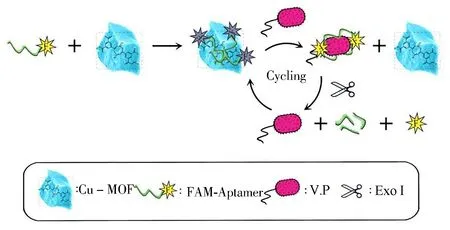
图1 方法的原理图Fig.1 Schematic illustration of the method
2.2 Cu-MOF的表征
采用扫描电子显微镜(SEM)对Cu-MOF的外观和尺寸进行扫描。如图2A所示,Cu-MOF表面粗糙呈不规则多面体晶型结构,棱角较为分明,颗粒粒径约为50~200 nm。采用X射线衍射仪(XRD)对Cu-MOF进行表征,得到的图谱见图2B。在11°左右出现特征衍射峰,与文献报道相符[22],说明Cu-MOF具有较好的结晶度。
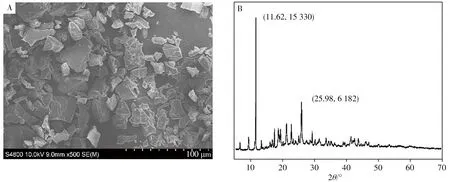
图2 Cu-MOF的扫描电镜图(A)及粉末X射线衍射图(B)Fig.2 Scanning electron microscope graph(A)and powder-XRD pattern(B)of Cu-MOF
2.3 荧光猝灭机理的考察
从图3可以看到,修饰了FAM的适配体溶液在激发波长490 nm时,在522 nm处有一最大发射峰;加入Cu-MOF后,荧光被猝灭;引入V.P后,荧光发生一定程度的恢复;加入ExoⅠ后荧光恢复程度显著增大。而加入铜盐溶液或H3BCT溶液后,荧光被大幅度猝灭,引入V.P后,荧光基本不恢复。加入溶剂(乙醇-水,2∶8),荧光未被猝灭,由此推测荧光猝灭效果主要由Cu(Ⅱ)和H3BCT导致。其中Cu(Ⅱ)的d电子层存在空轨道,这种结构容易发生光诱导电子转移(PET),引起荧光猝灭[12];而H3BCT和FAM分子由于都含有芳香环,存在n电子,二者共存时易发生n-n堆积效应,导致荧光共振能量转移(FRET),从而引起荧光猝灭[13]。
此外,Cu-MOF的Zeta电位为+1.59 mV,适配体的Zeta电位为-2.31 mV,将Cu-MOF和适配体混合后,得到混合溶液的Zeta电位为-0.051 4 mV,说明适配体与Cu-MOF之间发生了静电相互作用,因此推测静电作用是引起荧光猝灭的另一个原因。
2.4 实验条件的优化
2.4.1Cu-MOF体积的影响当Cu-MOF的用量不足时,荧光无法被完全猝灭,使体系的背景值过高,进而降低方法的灵敏度;而Cu-MOF用量过多时,则会阻碍V.P与其适配体的特异性结合。因此,考察了不同体积Cu-MOF(2.32 mg/mL)溶液对体系的荧光猝灭情况,结果如图4A所示。当加入体积为90μL时,荧光猝灭效率最大(达到92%),继续加入Cu-MOF未出现更大的猝灭效率。因此,后续实验选择90μL作为Cu-MOF的加入体积。
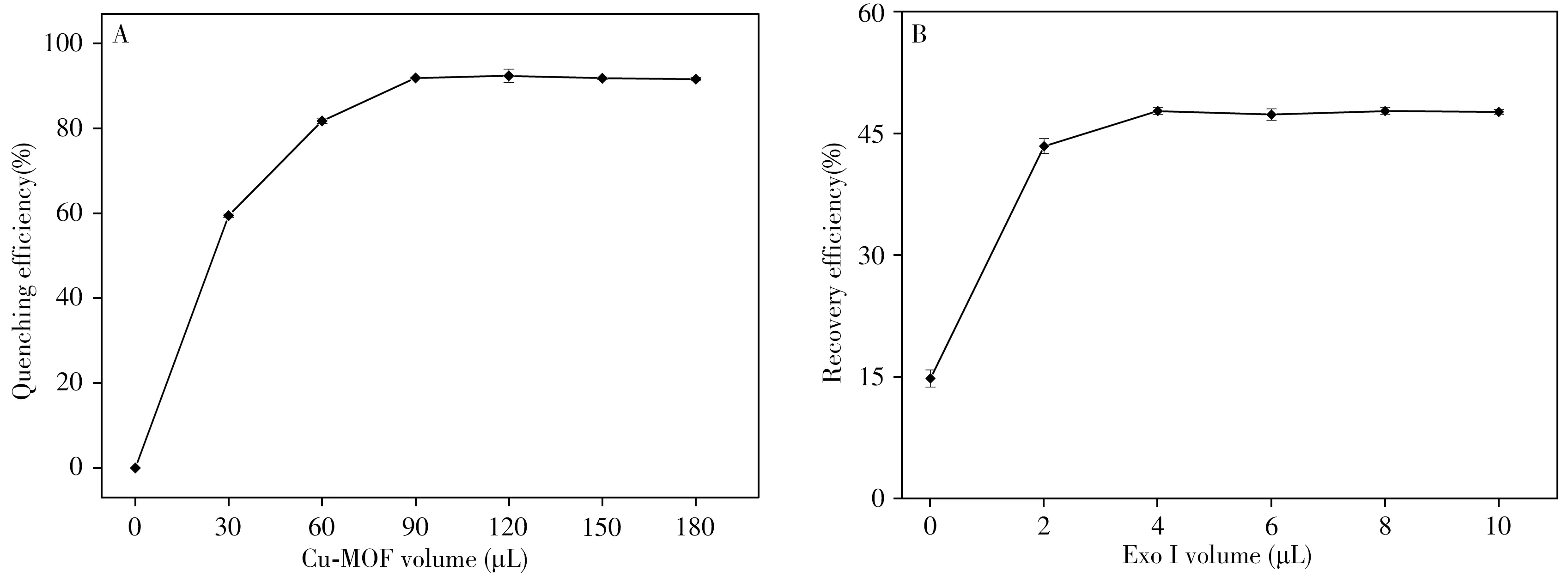
图4 Cu-MOF体积对荧光猝灭效率的影响(A)及酶体积对荧光恢复效率的影响(B)Fig.4 Cu-MOF volume on effect of fluorescence quenching efficiency(A),and enzyme volume on effect of fluorescence recovery efficiency(B)
2.4.2猝灭时间的影响Cu-MOF与适配体结合需要一定的时间。若时间过短,Cu-MOF对适配体的吸附不充分,导致猝灭不充分,影响背景值;若时间过长,则Cu-MOF对适配体吸附过于牢固,后续加入V.P需更长时间脱附,不能满足快速检测的需求。本文考察了不同猝灭时间(0、10、20、30、40、50和60 min)对实验结果的影响。结果显示,当猝灭时间为10 min时,猝灭效率达到91%,随着时间的延长,猝灭效率趋于稳定。因此,实验选择10 min作为猝灭时间。
2.4.3ExoⅠ体积的影响为了评估ExoⅠ辅助信号放大的效果,考察了ExoⅠ体积对荧光恢复的影响,结果如图4B所示。当ExoⅠ的体积为0时,荧光恢复效率为15%,当ExoⅠ的体积为4μL时,荧光恢复效率达到48%。由此对比,后者的信号放大了3倍左右,且随着体积增大,信号趋于稳定。因此,实验选择4μL ExoⅠ溶液作为最佳实验条件。
2.4.4荧光恢复时间的影响V.P与适配体结合需要一定的时间。时间过短,结合不充分,将会影响方法的重现性;时间过长,ExoⅠ的酶切效率可能受影响。实验考察了荧光恢复时间(10、20、30、40、50 min)的影响。结果显示,当恢复时间为20 min时,荧光恢复效率最大且趋于稳定,30 min后荧光恢复程度下降。综合考虑,选择20 min作为恢复时间。
2.4.5加入顺序的影响由于Cu-MOF的吸附性较强,可能对细菌产生一定的吸附作用而影响实验结果,实验通过筛选试剂的加入顺序以降低吸附作用的影响。如图5所示,加入或未加入ExoⅠ时,Cu-MOF+V.P+Aptamer的加入顺序均比Cu-MOF+Aptamer+V.P的荧光恢复效率低,说明Cu-MOF对菌株具有一定的非特异性吸附作用,降低了体系的荧光恢复效率。值得注意的是,对于不同加入顺序,存在ExoⅠ的体系均比不存在ExoⅠ时得到的荧光恢复效率高,且加入ExoⅠ后,两种不同加入顺序得到的荧光恢复效率的差值(ΔRE)由2.49%降至0.95%,说明ExoⅠ的引入不但放大了荧光信号,同时也降低了Cu-MOF对菌株的非特异性吸附造成的影响。因此,为了减少Cu-MOF对细菌的非特异性吸附,提高方法的灵敏度,实验选择Cu-MOF+V.P+Aptamer+ExoⅠ作为试剂的加入顺序。
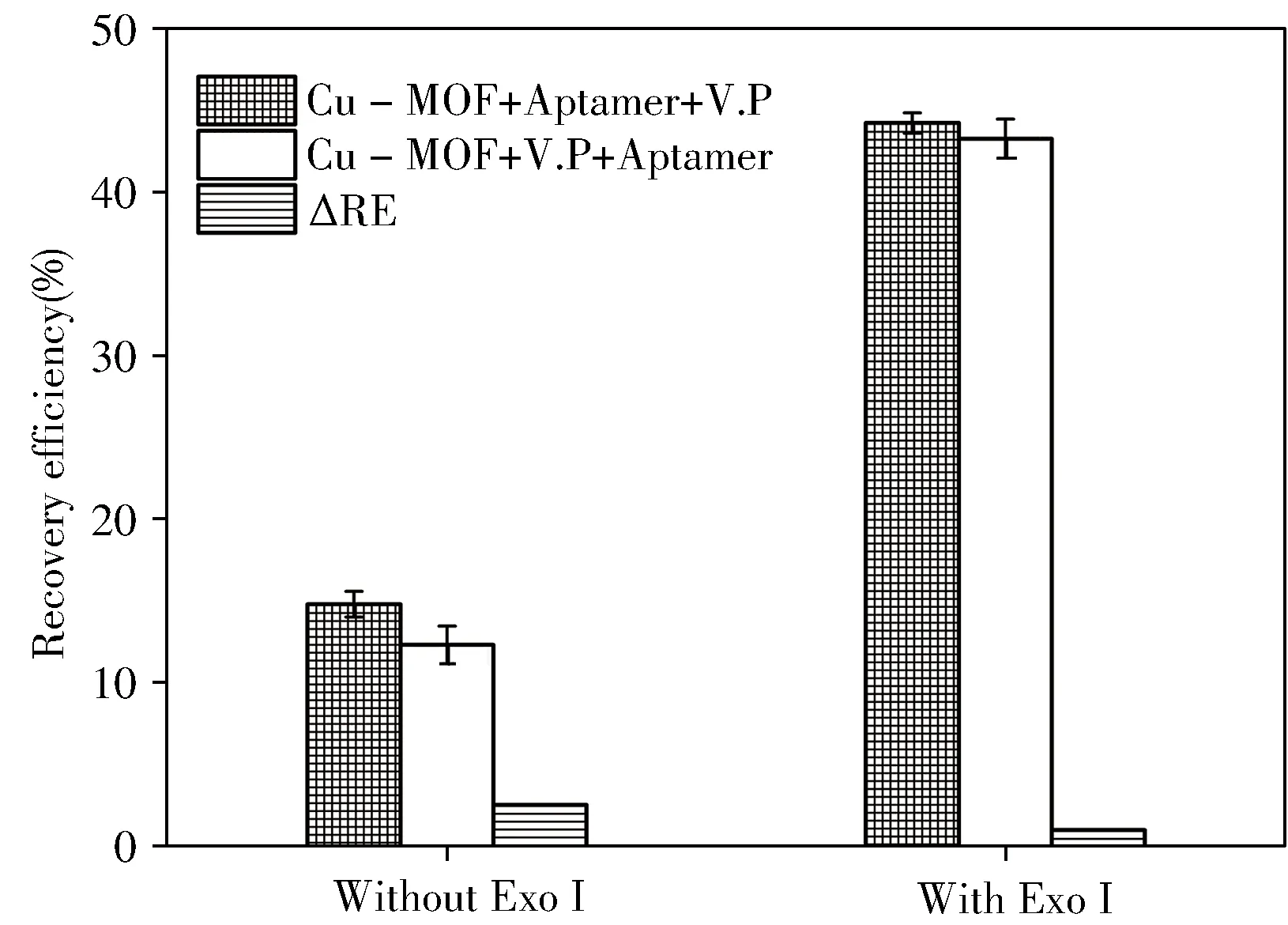
图5 试剂加入顺序的影响Fig.5 Effect of the agents’addition order on fluorescence recovery efficiency
2.5 线性范围与检出限
根据上述优化实验条件,在该体系中加入不同浓度的V.P菌悬液,测定荧光强度。实验结果显示,在8.4×102~2.0×105CFU/mL浓度范围内,V.P浓度的对数与荧光恢复程度(ΔF)呈良好线性关系,线性方程为ΔF=7.30lgc-19.58(r2=0.998 6),检出限为37 CFU/mL。同时比较了不加ExoⅠ的非放大荧光法,得到的线性范围为4.12×104~8.23×106CFU/mL,检出限为1.0×104CFU/mL。说明ExoⅠ的加入拓宽了方法的线性范围,降低了检出限。
2.6 方法的选择性
在优化条件下,用浓度均为105CFU/mL的V.P、沙门氏菌(S.A)、李斯特菌(L.M)、大肠杆菌(E.coli)进行实验,结果如图6所示,只有加入V.P体系的荧光恢复程度最大,加入其他3种细菌荧光基本不能恢复,说明该方法对V.P具有高选择性。
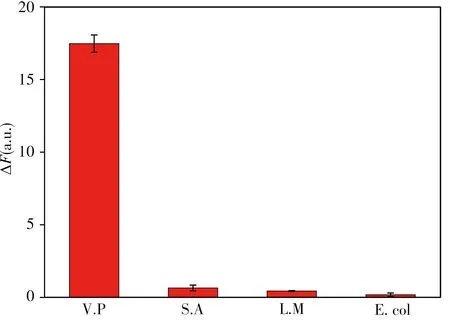
图6 不同细菌加入该体系后的荧光恢复情况Fig.6 The value of fluorescence recoveries after adding different bacterias in the system
2.7 实际样品的分析
在优化条件下,将该方法用于虾肉和八爪鱼样品中V.P的分析。结果显示,虾肉和八爪鱼样品均未检出V.P。分别加入6.79×104、6.79×105、6.79×106CFU/mg V.P进行回收率实验,测得加标回收率为88.8%~109%,相对标准偏差(RSD)为3.7%~6.6%(见表1),说明该方法的准确度和精密度较好。
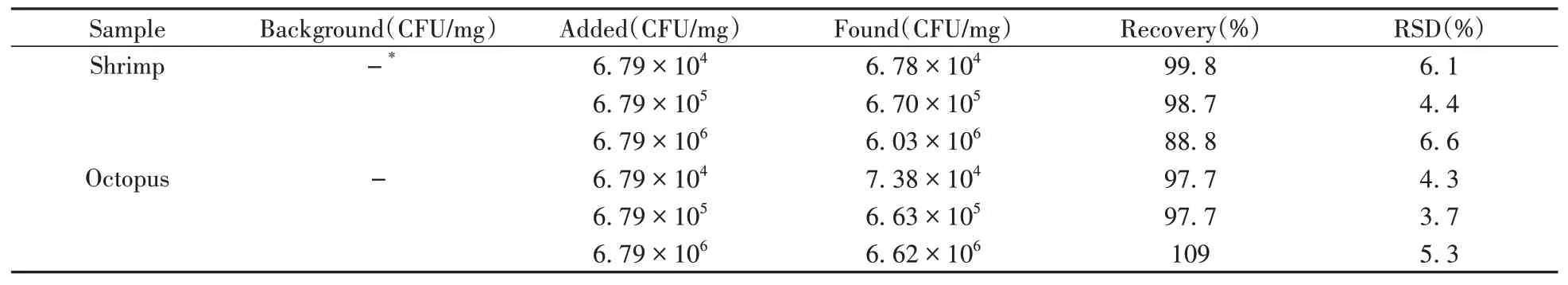
表1 虾、八爪鱼样品中V.P的加标回收实验Table 1 Spiked recoveries of V.P in shrimp meat and octopus samples
3 结 论
本文建立了一种基于Cu-MOF和酶切放大的适配体荧光法。在8.4×102~2.0×105CFU/mL浓度范围内,V.P浓度的对数(lgc)与荧光恢复程度(ΔF)呈良好线性关系,线性方程为ΔF=7.30lgc-19.58(r2=0.998 6),检出限为37 CFU/mL,整个分析过程不超过30 min。将方法应用于虾、八爪鱼样品的检测,加标回收率为88.8%~109%,RSD为3.7%~6.6%。该方法具有检测速度快、线性范围宽、灵敏度高、选择性好等优点,对实际食品样品中V.P的分析具有一定潜力。
