镉胁迫对艾纳香抗性生理、亚细胞镉分布和镉化学形态的影响
2022-03-21陈子涵任建国庞玉新王俊丽
陈子涵, 任建国, 庞玉新, 王俊丽
(1.贵州医科大学公共卫生与健康学院,环境污染与疾病监控教育部重点实验室,贵州省食品营养与健康工程研究中心, 贵阳 550025;2.广东药科大学中药资源学院, 广东 云浮 527500)
由于草药易于获取且副作用较少,近年来世界各国对草药的使用量明显增加[1]。已有研究显示,影响草药产品质量的因素之一是重金属含量超标,原因很可能是草药种植基地的土壤受到重金属污染,且多包含镉[2-3]。2014年《全国土壤污染状况调查公报》显示,Cd作为我国耕地的主要污染物之一,被农作物吸收并积累在植物体内,通过食物链进入人体,损害人体肾脏、肝脏等脏器,进而引发癌症。
已有研究报道,Cd对植物产生的损伤主要体现在DNA损伤、抑制DNA损伤修复系统、氧化应激和细胞死亡等方面[4]。为了抵御Cd的毒害,植物通过区室化隔离作用,如将重金属隔离在液泡中或将Cd沉积在其他亚细胞组分中[5-6]来避免重金属的毒害。此外,植物对细胞内Cd解毒的主要途径之一是通过巯基化合物[如谷胱甘肽(GSH),植物螯合肽(Phytochelatins,PCs)和金属硫蛋白(Metallothinein,MT)]与重金属进行螯合[7-8],形成较小毒性的镉络合物,从而将Cd更快的转移到储存场所。有研究表明,GSH和PCs在重金属Cd跨液泡膜转运中起着核心作用,且PCs的作用远超GSH[9]。此外,植物中Cd的生物活性与其化学形态有关[10],植物通过形成生物活性低的化学形态Cd(果胶、蛋白螯合态和难溶性磷酸盐形态),从而降低Cd的毒害作用[7-8]。Cd胁迫还会导致植物体内活性氧自由基(Reactive oxygen species,ROS)的过量积累[11],进而攻击生物膜上的多不饱和脂肪酸(Polyunsaturated fatty acid,PUFA),引发脂质过氧化作用,形成脂质过氧化产物,如丙二醛(MDA),因此MDA能间接反映植物体内的过氧化程度[12-13]。此外,植物抗氧化防御系统,包括抗氧化酶系统,如超氧化物歧化酶(SOD)、过氧化物酶(POD)和非酶系统,如抗坏血酸(ASA)、谷胱甘肽(GSH)可以通过对Cd胁迫下产生活性氧的解毒作用来提高镉的耐受性[14]。
艾纳香(Blumeabalsamifera(L.)DC)作为贵州省道地药材,其药效成分主要包括倍半萜内酯类化合物、黄酮类等多种化合物[15-16],以艾纳香叶片为唯一原材料制取的天然冰片[17],具有镇痛、镇静、抗炎、抗肿瘤等功效,在临床上被广泛应用,市场需求量较大[18-19]。为适应市场需求,在贵州省罗甸县建立了艾纳香规范化种植基地,但有研究表明,黔产艾纳香对土壤重金属元素Cd的富集能力较强[20-21],为此有必要对Cd胁迫下的艾纳香解毒机制进行探讨。目前,关于Cd胁迫下艾纳香各器官的生理生化改变[22]及镉解毒机制[23]研究较少,为此本研究拟通过盆栽试验,分析Cd胁迫对艾纳香各器官抗性生理指标、Cd积累分布特征及Cd结合形态的影响,以探讨艾纳香对Cd的耐性和解毒机制。
1 材料与方法
1.1 试验材料
1.1.1供试植物
选取贵州省罗甸县艾纳香GAP基地长势一致的艾纳香幼苗作为供试植物。
1.1.2供试土壤
贵阳市贵安新区党武镇农田土壤为试验土壤。将土壤置于通风处自然风干,去除石块等杂质后,捶碎,过3 mm筛并充分混合后用于盆栽试验。土壤基本理化性质为:pH=7.56,速效氮114.92 mg/kg,有效磷12.791 mg/kg,速效钾31.56 mg/kg,有机质12.81 mg/kg,土壤Cd的背景值为0.069 5 mg/kg,按照《土壤环境质量农用地土壤污染风险管控标准》(GB 15618-2018),该土壤污染风险低。
1.2 试验设计
采用盆栽试验,称取5 kg风干土壤,分别置于已编号的塑料盆中(直径30 cm,高23 cm)。称取一定量的CdCl2·2.5 H2O(分析纯),用去离子水配制成水溶液,均匀喷洒于供试土壤表面,根据课题组前期研究结果进行处理组浓度设计[23],使供试土壤中外源镉的质量分数分别为0.5 mg/kg和5 mg/kg 。沉降并静置14 d后,充分混匀盆内土壤,选取长势一致的艾纳香幼苗随机种植于盆中,每盆定植一株,每个处理3次重复,每重复3盆,每个处理组共9盆。以不额外施Cd的土壤为对照(0 mg/kg)。人工避雨,视盆内土壤水分状况,不定期浇水。
1.3 测定指标与方法
1.3.1样品的采集及预处理
盆栽培养150 d后,采集艾纳香的根用20 mmol/L Na2-EDTA浸泡20 min后,与茎和叶一起用自来水、纯水依次进行冲洗,室温晾干。随机选取部分样品置于-80 ℃冰箱保存,用于抗性生理和Cd的亚细胞分布和化学结合态分析;部分样品置于烘箱中烘干至恒重,用研钵研磨成粉状,放入密封袋并置于干燥器中保存,用于测定各器官的Cd含量。
1.3.2各器官Cd质量分数及转运系数的测定
分别称取一定量根、茎、叶样品,加入7 mL HNO3-H2O2(体积比5∶2),用微波消解仪进行消解。用contrAA 700石墨炉原子吸收光谱仪测定Cd含量,进而计算各器官Cd质量分数。并根据下列公式计算转运系数和富集系数。
富集系数=艾纳香地上部Cd含量/土壤中Cd含量;
转运系数=艾纳香地上部Cd含量/根部Cd含量。
1.3.3各器官抗性生理的测定
用试剂盒测定各器官膜脂过氧化指标MDA含量、抗氧化酶系统指标SOD、POD活性和发挥螯合作用多肽指标NPT、GSH、植物金属螯合肽(PCs)含量(南京建成生物工程研究所提供试剂盒),每组设置3个重复。
1.3.4各器官亚细胞Cd质量分数的测定
参考Weng等[7]的方法,将各器官亚细胞组分分为细胞壁组分(FⅠ)、细胞器组分(FⅡ)和可溶组分(FⅢ,包括细胞质、液泡内高分子、大分子有机物质和无机离子),并用原子吸收光谱仪测定各组分的Cd质量分数,每组设置3个重复。
1.3.5各器官化学结合形态Cd质量分数的测定
参考贺远等[24]的方法,进行各器官化学结合形态Cd的提取,提取剂的提取顺序依次为80%乙醇、去离子水、1 mol/L氯化钠溶液、2% 醋酸、0.6 mol/L盐酸溶液,并用原子吸收光谱仪测定F乙醇、F水、F氯化钠、F醋酸、F盐酸和F残渣组分的Cd质量分数,每组设置3个重复。
1.4 数据统计与分析
采用Excel 2016软件进行数据整理,SPSS 19.0软件进行数据分析,对于服从正态分布且方差齐的数据,采用LSD法进行差异显著性检验,对于服从正态分布但方差不齐的数据,采用Games-Howell软件进行差异显著性检验,对于不服从正态分布的数据采用非参数检验,显著性水平设置为α=0.05,所有结果以均数±标准差(Mean±SD)表示。
2 结果与分析
2.1 Cd胁迫下艾纳香各器官Cd的分布
不同Cd处理浓度下,艾纳香各器官Cd质量分数及地上部富集系数和转运系数变化情况如表1所示。结果显示,随着外源Cd浓度的增加,艾纳香各器官Cd质量分数均明显增加,且Cd质量分数从大到小表现为叶、茎、根。在0 mg/kg Cd处理浓度下,虽然没有额外向土壤中施加Cd,但艾纳香体各器官均有一定量的Cd存在,暗示了艾纳香对Cd的富集作用。

表1 Cd 胁迫处理对艾纳香各器官Cd 积累和富集系数、转运系数的影响
各处理组中地上部富集系数和转运系数均大于1,其中以0.5 mg/kg Cd处理浓度下的富集系数最大(8.163),未额外施加Cd的处理组次之(2.397),5 mg/kg Cd处理组最低(1.652)。转运系数以未额外施加Cd的处理组最高(2.346),5 mg/kg Cd处理组次之(1.899),0.5 mg/kg Cd处理浓度下转运系数最低(1.794)。表明艾纳香对低浓度Cd具有较强的转运能力。
2.2 Cd胁迫下艾纳香各器官非蛋白巯基化合物变化
不同浓度Cd胁迫下,艾纳香各器官GSH、NPT、PCs含量见表2。在不同外源Cd浓度胁迫下,各器官非蛋白巯基化合物(NPT)以茎部含量最高,叶其次,根最低,且艾纳香各器官GSH、NPT、PCs含量均大于对照组。在0.5 mg/kg Cd处理浓度下,艾纳香各器官GSH含量以茎(52.92 μmol/g)最高,根(21.49 μmol/g)其次,叶(17.06 μmol/g)最低;而PCs含量以叶(34.75 μmol/g)最高,根(30.50 μmol/g)其次,茎(18.59 μmol/g)最低。在5 mg/kg Cd处理浓度下,艾纳香各器官GSH含量以茎(51.10 μmol/g)最高,根(24.27 μmol/g)其次,叶(18.77 μmol/g)最低;而PCs含量以叶(50.21 μmol/g)最高,茎(22.74 μmol/g)其次,根(21.87 μmol/g)最低。
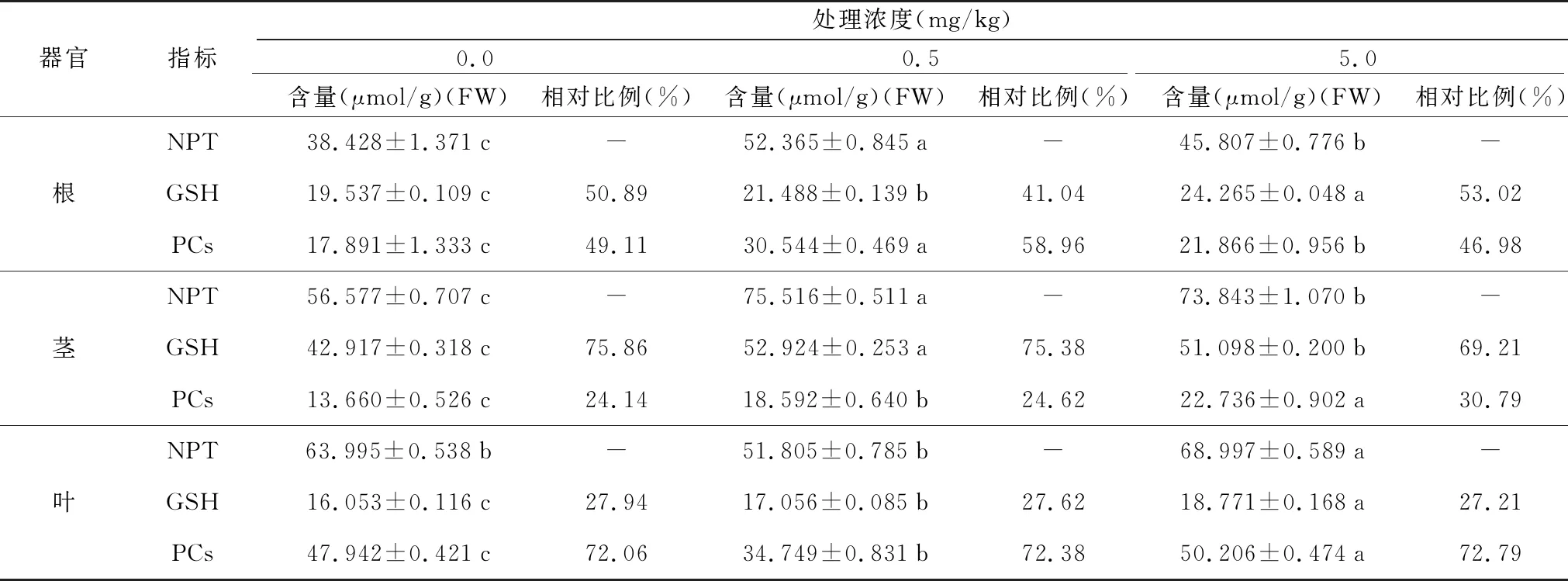
表2 Cd胁迫处理对艾纳香各器官GSH、NPT和PCs含量和相对比例的影响
不同浓度Cd胁迫导致各器官GSH和PCs分布有所变化(表2)。由表2可知,在根部:PCs以0.5 mg/kg处理组占比最高(58.96%),5 mg/kg处理组占比最低(46.98%);而GSH以5 mg/kg处理组占比最高(53.02%),0.5 mg/kg处理组占比最低(41.04%)。在茎部:0、0.5、5 mg/kg各处理组均以GSH占比最高,分别为75.86%、75.38%、69.21%,PCs的相对比例随着外源Cd处理浓度的增加而增加。在叶片中,0、0.5、5 mg/kg各处理组PCs占比最大,且各处理组之间PCs相对比例变化不明显,分别为72.06%、72.38%、72.79%,GSH的相对比例随着外源Cd处理浓度的增加而降低。
不同Cd胁迫处理下,根、茎和叶中GSH和PCs含量和相对比例变化结果表明,艾纳香各器官对Cd胁迫响应具有组织特异性,表现为在茎部启动以GSH为主的螯合解毒作用,而在叶片中启动以PCs含量为主的螯合解毒作用。
2.3 Cd胁迫下艾纳香各器官膜脂过氧化及抗氧化酶变化
随着外源Cd胁迫浓度的增加,艾纳香各器官MDA含量均增加,SOD、POD活性总体呈先升后降的趋势,具体表现为0.5 mg/kg Cd处理浓度下,SOD和POD酶活性最高。各处理组SOD、POD活性和MDA含量均大于对照组,具体结果见表3。上述结果说明,Cd处理加剧了植株脂质过氧化程度,而植株抗氧化酶系统则表现出有限的Cd氧化胁迫清除能力。

表3 Cd胁迫处理对艾纳香各器官MDA含量和SOD、POD活性的影响
2.4 Cd胁迫下艾纳香各器官亚细胞Cd分布变化
随着外源Cd胁迫浓度的增加,艾纳香各器官亚细胞组分Cd质量分数明显增加,主要以细胞壁组分(FⅠ)中Cd质量分数最高,其次为可溶性组分(FⅢ),细胞器组分(FⅡ)最低(见表4)。
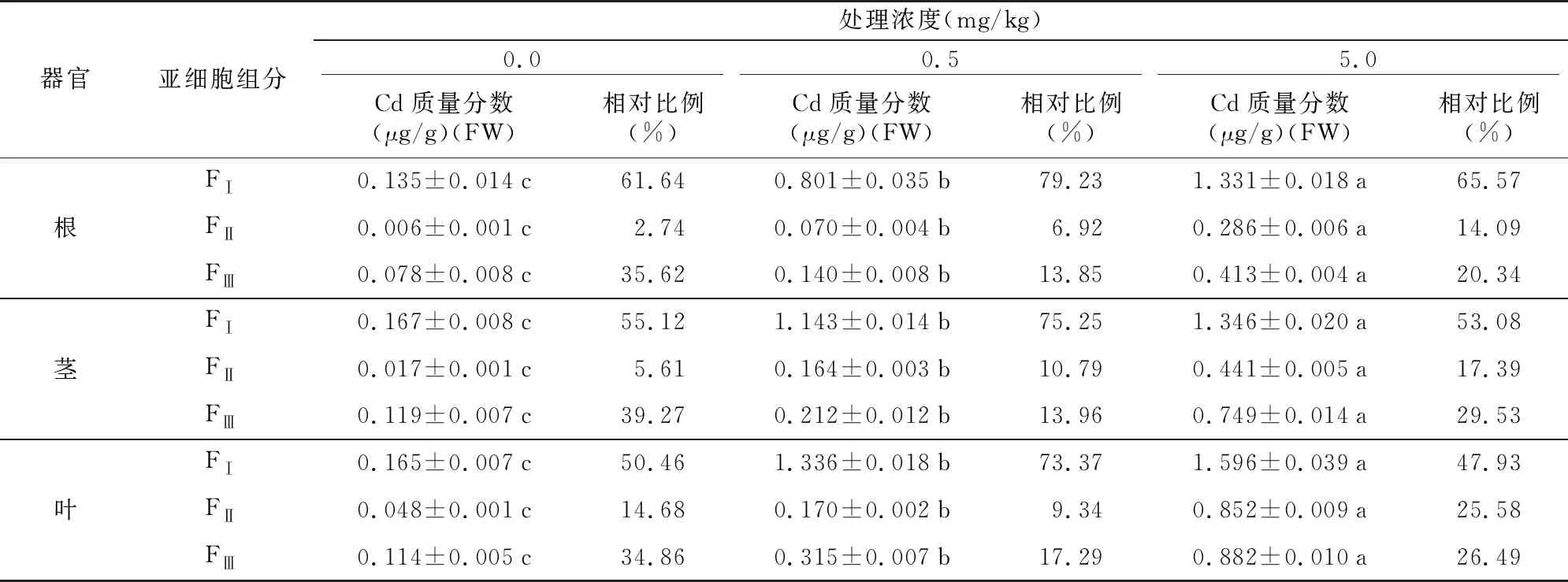
表4 Cd胁迫处理对艾纳香各器官亚细胞组分Cd质量分数和相对比例的影响
从亚细胞Cd分布比例来看(表4),不同外源Cd处理浓度下,各器官均以细胞壁组分(FⅠ)占比最高,可溶组分(FⅢ)次之,细胞器组分(FⅡ)最低,且以0.5 mg/kg Cd处理组中各器官细胞壁组分占比最大,但这3种组分Cd所占比例因外源Cd处理浓度的不同而有所不同。叶中细胞器组分Cd所占比例较根、茎高(0.5 mg/kg Cd处理组除外)。在根部,对照组、0.5 mg/kg处理组和5 mg/kg处理组的FⅠ、FⅡ和FⅢ的Cd占比分别为61.64%、2.74%、35.62%,79.23%、6.92%、13.85%和65.57%、14.09%、20.34%。在茎部,对照组、0.5 mg/kg处理组和5 mg/kg处理组的FⅠ、FⅡ和FⅢ的Cd占比分别为55.12%、5.61%、39.27%,75.25%、10.79%、13.96%和53.08%、17.39%、29.53%。在叶片中,对照组、0.5 mg/kg处理组和5 mg/kg处理组的FⅠ、FⅡ和FⅢ的Cd占比分别为50.46%、14.68%、34.86%,73.37%、9.34%、17.29%和47.93%、25.58%、26.49%。
2.5 Cd胁迫下艾纳香各器官Cd结合形态的变化
艾纳香各器官Cd的结合形态含量及占比如表5所示。从艾纳香各器官不同结合形态Cd含量来看,在未施加外源Cd处理浓度下,艾纳香各器官Cd结合形态含量较小;在施加外源Cd之后,艾纳香各器官Cd化学结合形态含量均增加。0.5 mg/kg Cd处理浓度下,艾纳香根Cd化学形态以氯化钠提取态、醋酸提取态和盐酸提取态为主,茎和叶片以氯化钠提取态和醋酸提取态为主;5 mg/kg Cd处理浓度下,艾纳香根和茎Cd化学形态以氯化钠提取态和醋酸提取态为主,叶Cd化学形态以氯化钠提取态、醋酸提取态和盐酸提取态为主。各处理组不同器官的乙醇提取态和水提取态Cd含量均较低。
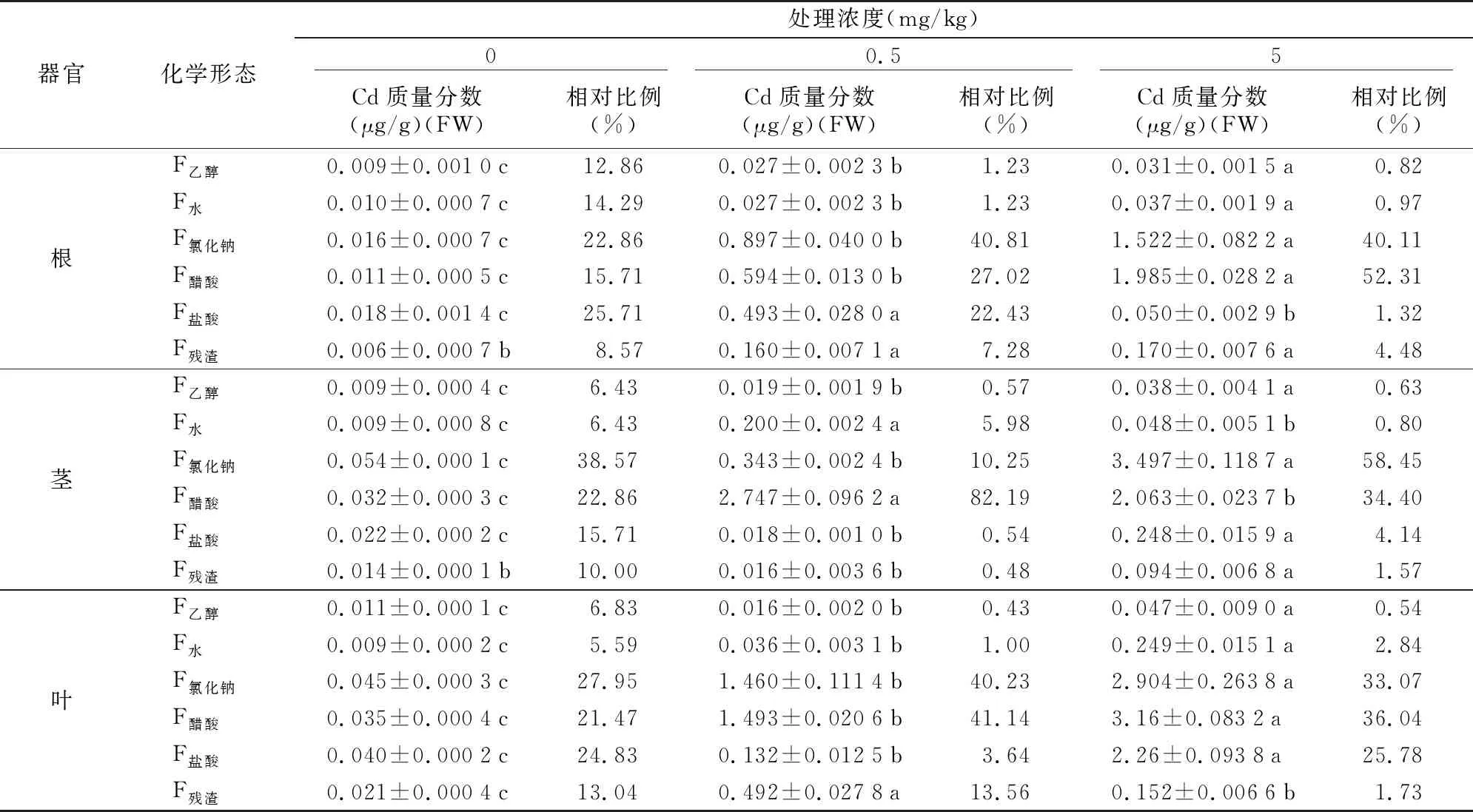
表5 Cd胁迫处理对艾纳香各器官不同化学形态Cd含量及相对比例的影响
从各种提取态Cd占比来看:随着外源Cd的施加,各器官乙醇提取态和水提取态Cd占比均减少(相比未外施Cd),而其他提取态Cd占比因器官不同而有所差异。在根部,随着外源Cd处理浓度的增加,醋酸提取态Cd占比明显增加,盐酸提取态Cd明显减少,而氯化钠提取态Cd则基本保持不变。在茎部,随着外源Cd处理浓度的增加,92%以上的提取态Cd集中在氯化钠提取态和醋酸提取态中,且不同Cd处理浓度下,二者所占比例差异较大:0.5 mg/kg Cd处理浓度下,氯化钠提取态Cd占10.3%,醋酸提取态Cd占82.2%;5.0 mg/kg Cd处理浓度下,氯化钠提取态Cd占58.5%,醋酸提取态Cd占34.4%。在叶片中,随着外源Cd处理浓度的增加,各提取态Cd的占比趋势不尽相同:在0.5 mg/kg Cd处理浓度下,氯化钠提取态(40.2%)和醋酸提取态(41.1%)Cd占总提取态Cd的81%以上,而在5.0 mg/kg Cd处理浓度下,氯化钠提取态(33.0%)、醋酸提取态(36.0%)和盐酸提取态(25.8%)Cd占总提取态Cd的94%以上。从以上数据分析可看出,受外源Cd胁迫后,乙醇提取态和水提取态Cd的比例降低,而氯化钠提取态和醋酸提取态Cd的相对比例增加,进而反映了艾纳香对Cd的耐性机制。
3 讨 论
3.1 艾纳香体内Cd的器官积累分布特征
土壤中的重金属污染物被植物吸收后,会将其分配到生长器官和细胞区室中,以达到对重金属的耐性[25]。不同类型的植物,其器官积累Cd的数量有所不同。如在大豆(Glycinemax(Linn.) Merr.)中各器官的Cd富集效应为根>茎>叶>可食用部分[26];在水稻中为根>茎>可食用部分>叶[26]。在木麻黄(Casuarinaequisetifolia.)中则为根>茎>小枝[27]。在棉花中各器官Cd的积累变化,随着土壤Cd含量的变化略有不同,当土壤Cd含量<5 mg/kg时,棉花各部位Cd含量大小为叶片>茎>棉絮>根;当土壤Cd含量为5~20 mg/kg时,Cd含量为叶片>茎>根>棉絮[28]。在飞机草(Chromolaenaodorata)、三叶鬼针草(Bidenspilosa)中Cd含量则为叶片>茎>根[29]。在本试验中,艾纳香各器官Cd积累量表现为叶>茎>根,这与王俊丽等[23]的研究结果相一致。不同植物对重金属的吸收、积累部位略有差异,除了与蒸腾作用有关外,更重要的可能是与植物基因型[30]以及不同器官胞内区室化、螯合作用大小有关[31]。
3.2 艾纳香体内非蛋白巯基化合物对Cd胁迫的解毒作用
植物细胞通过体内的巯基化合物(NPT、PCs、GSH等)与Cd进行络合,以达到对Cd的解毒作用[32]。重金属胁迫下,植物体通过γ-谷氨酰半胱氨酸合成酶(GSH 1),谷胱甘肽合成酶(GSH 2)启动合成GSH[33],进而再以GSH为前体在植物螯合肽合成酶(PCS)的作用下合成植物螯合肽[34]以络合金属离子;而GSH不仅用于植物螯合肽的生物合成,还能直接作为活性氧自由基的清除剂和引发抵抗活性氧和丙酮醛(有害物质)产生的信号转导途径和防御反应等的小分子来调动植物体对外界胁迫的防御作用[35]。
在本研究中,外源Cd处理组艾纳香各器官的GSH和PCs含量均大于对照组,暗示GSH和PCs在艾纳香Cd胁迫的解毒中起到了重要作用。本研究结果也显示,在Cd胁迫下,艾纳香不同器官中GSH和PCs的相对比例存在明显差异。在叶中,以PCs为主,茎中以GSH为主,根中两者相对比例因外源Cd处理浓度的不同有所不同。造成不同器官GSH和PCs的相对比例存在差异的原因可能与不同器官中Cd积累量的作用效应有关,高浓度Cd有助于提高植物螯合肽合成酶(PCS)活性,进而合成更多植物螯合肽[36]。
本研究中,艾纳香各器官Cd含量顺序为叶>茎>根,再结合叶、茎器官PCs和GSH的相对比例情况分析可知,PCs合成途径比GSH合成途径更耐Cd毒,这与PCs含有高比例-SH残基有关[37]。对根部来说,外源Cd浓度为0和5.0 mg/kg的条件下,PCs和GSH的相对比例接近1∶1,而在0.5 mg/kg的条件下,PCs和GSH的相对比例大于1。从维持体内稳态的角度来说,艾纳香不同器官间非蛋白巯基化合物对Cd胁迫的差异响应作用有待进一步探讨。
3.3 艾纳香体内抗氧化酶系统对Cd胁迫的解毒作用
3.4 艾纳香体内Cd的亚细胞分布特征
植物将重金属离子隔离在细胞或组织中,以减轻重金属的毒性,这种区室化作用是植物对重金属解毒的重要机制,尤其以细胞壁沉积和液泡区室化为主[44]:一方面,Cd离子可以与细胞壁成分的官能团结合,如多糖[45],将其固定在细胞壁中,这是植物抵抗Cd胁迫的第一道屏障[46]。另一方面,液泡对重金属胁迫抵抗也至关重要。Cd离子以植物螯合肽-Cd复合物及谷胱甘肽-Cd复合物的形式在转运蛋白的帮助下进入液泡固定,从而起到提高宿主Cd耐性的作用[47]。
金属耐受蛋白(Metal tolerance proteins,MTPs),通过螯合作用与重金属阳离子形成螯合物,将其隔离在液泡中,降低了细胞质中重金属离子的浓度,从而减轻了影响细胞质生化反应的重金属毒性[25];在本试验中,在不同的外源Cd浓度处理下,艾纳香各器官亚细胞组分Cd主要存在于细胞壁中,其次为可溶性组分,占比最小的为细胞器组分,这与Cd在秋茄树(Kandeliaobovata)亚细胞组分中的分布情况一致[7],但与王俊丽等[23]在艾纳香Cd亚细胞分布的试验结果存在差异,原因可能是种植所用土壤理化性状不同:本次实验所用土壤,有效磷含量(12.791 mg/kg)高于前期研究所用土壤(5.53 mg/kg),速效钾含量(31.56 mg/kg)则低于前期研究所用土壤(192.22 mg/kg)。在本研究中,叶细胞器组分Cd所占比例较根和茎高的原因可能与Cd优先在叶绿体积累有关[48-49]。
3.5 艾纳香体内Cd的化学结合形态形式
Cd的化学形态与其毒性密切相关。不同化学形态的Cd具有不同的迁移能力和毒性。无机盐形态的Cd(80%乙醇提取)和水溶性Cd(去离子水提取)具有更高的迁移能力,且毒性明显高于果胶磷酸盐和蛋白质结合形态的Cd(用1 M NaCl提取)、难溶性磷酸盐态Cd(2%醋酸提取)和草酸态Cd(0.6 M 盐酸提取)[50]。本研究结果显示,随着外源Cd处理浓度的增加,氯化钠提取态和醋酸提取态的Cd占比增大,而乙醇和水提取态的Cd占比减小,进而说明在外源Cd胁迫下,艾纳香的根、茎、叶中积累的Cd以迁移力弱、毒性小的醋酸提取态和迁移力、毒性处于中间水平的氯化钠提取态存在,以减轻Cd的毒害作用,提高艾纳香耐镉能力。本研究结果与水狐尾藻(Myriophyllumaquaticum)[51]、三色苋(AmaranthustricolorL.)[52]中的不同化学形态Cd分布模式基本一致。
4 结 论
综上所述,艾纳香主要通过细胞壁沉积、蛋白质和有机酸的结合及形成不溶物和提高非蛋白巯基化合物含量、抗氧化酶系统的防御能力来实现对 Cd 的耐受。
