不同膻味水平的龙陵黄山羊肝组织转录组SNP分析
2022-03-21王宣懿叶绍辉
马 琳,杨 明,王宣懿,叶绍辉
(云南农业大学动物科学与技术学院,昆明 650201)
羊肉在世界各地广泛食用,但由于其膻味,在许多亚洲国家并不受欢迎。4-甲基辛酸(4-Methyl octanoic acid,MOA)、4-乙基辛酸(4-Ethyl octanoic acid,EOA)和4-甲基壬酸(4-Methyl Nonanoic acid,MNA)[1-3]这3 种化合物是引起羊肉膻味的主要物质,此外还有3-甲基吲哚(3-Methyl indole,MI)和4-甲基苯酚(4-Methyl phenol,MP)[4,5]。龙陵黄山羊(Longling yellow goat,LLG)是产于云南省保山市龙陵县及周边的地方品种,其具有体大、屠宰率高、耐粗饲等良种特性[6]。但膻味却一直制约着龙陵黄山羊的发展。羊的肝脏具有代谢功能,膻味物质的形成需要肝脏参与代谢,进而沉积到脂肪组织中,产生特有的羊膻味。目前龙陵黄山羊的研究主要集中在肉品质、养殖方式、繁殖性能和疾病的研究,鲜见其膻味研究的相关报道。
单核苷酸多态性(Single nucleotide polymorphisms,SNP),是指单个核苷酸的变异而导致的基因多态性,其数量很多,多态性丰富。每个SNP 位点都可以是4 种不同的变异形式(转换、颠换、插入、缺失),其中转换和颠换二者之比为2∶1,可能是因为CpG 二核苷酸中5-甲基胞嘧啶(5mC)脱氨基对胸腺嘧啶的高自发率而导致[7]。SNP 在CG 序列上出现最为频繁,是因为CG 中的C 常被甲基化而转换成T。SNP 位点极其丰富,几乎遍及整个基因组。虽然随着时空的改变转录基因种类可能会有些许变化,但转录组运用于检测转录区域多态性仍是1 种高效且经济的方法[8]。该研究旨在通过对龙陵黄山羊肝脏转录组SNP 进行分析,探索龙陵黄山羊膻味相关差异基因,为龙陵黄山羊膻味的相关研究提供理论依据。
1 材料与方法
1.1 试验材料
选择饲养健康的龙陵黄山羊、云岭山羊(Yunling goat,YLG)和大理绵羊(Dali sheep,DLS)共14只;龙陵黄山羊取自云南省保山市龙陵县,云岭山羊和大理绵羊取自云南省大理市宾川县。
1.2 样品采集
对试验山羊采用颈动脉放血处死,快速取其100~150 g 腰部皮下脂肪组织和肝脏组织,分别置于保鲜袋和无酶冻存管中,液氮条件下运回实验室,分别放入-20、-80 ℃冰箱保存待用。所采集的皮下脂肪组织用于测定致膻物质(MOA、EOA、MNA、MI 和MP)的含量。所采集的肝脏组织用于转录组的测序,按提取要求取适量样本,采用Trizol 法提取RNA,对提取的总RNA 按一定比例进行稀释。利用NanoPhotometer®分光光度计检测样品纯度(IMPLEN 公司),Qubit®3.0Flurometer(Life Technologies公司)检测RNA 样品浓度,安捷伦2100 RNA Nano 6000 AssayKit(Agilent Tech-nologies 公司)检测RNA样品的完整度和浓度。
1.3 膻味值计算
通过气相色谱法测定致膻物质(MOA、MEA、EOA、MI、MP)5 个指标的含量,然后将致膻物质的含量除以其膻味阈值得到膻味值,再将其膻味值进行加和得到总膻味值。其中膻味阈值是指人们能够感知该化合物气味的最小浓度[9],在pH=2 的介质中MOA 的膻味阈值是0.02 μg/g,MNA 的膻味阈值是0.65 μg/g,EOA 的膻味阈值是0.006 μg/g[9,10],MI的膻味阈值是0.303 μg/g,MP 的膻味阈值是0.7 μg/g[11,12]。对3 个羊品种的膻味值进行显著性差异检验。
1.4 高通量测序
根据膻味含量测定以及膻味值计算比较后,对挑选出的龙陵黄山羊(6 只)的肝组织进行转录组测序。总RNA 样本检测合格后,选用带有Oligo(dT)的磁珠进行富集纯化mRNA,向纯化得到的mRNA中加入Fragmentation Buffer 使其片段成为短片段,以片段后的mRNA 为模板,用六碱基随机引物合成cDNA 第1 链,并 加 入 缓 冲 液、dNTPs、RNaseH 和DNA Polymerase Ⅰ合 成cDNA 第2 链,经 过QIAQuick PCR 试剂盒纯化并加EB 缓冲液洗脱。洗脱纯化后的双链cDNA 再进行末端修复、加碱基A、加测序接头处理,然后经琼脂糖凝胶电泳回收目的大小片段并进行PCR 扩增,从而完成整个文库制备工作。质量合格的文库用Illumina 平台进行测序,测序由北京擎科科技有限公司昆明分公司完成。完成测序和质控的数据被用来与山羊参考基因组ARS1做比对,之后进行SNP 检测以及GO、KEGG 富集分析。
2 结果与分析
2.1 筛选转录组样本
以14 个样本总膻味值的平均数(771.845)来分类,高于771.845 膻味值的样本为高膻味水平组,低于771.845 膻味值的样本为低膻味水平组,14 个样本的膻味水平分组如表1 所示。

表1 所有样本膻味水平分组
对高膻味水平组和低膻味水平组进行差异检验发现(表2),云岭山羊和大理绵羊种内高低膻味水平组无显著差异(P>0.05),而龙陵黄山羊种内2 个水平组差异极显著(P<0.01),龙陵黄山羊种内高膻味水平和低膻味水平符合转录组样本的要求。
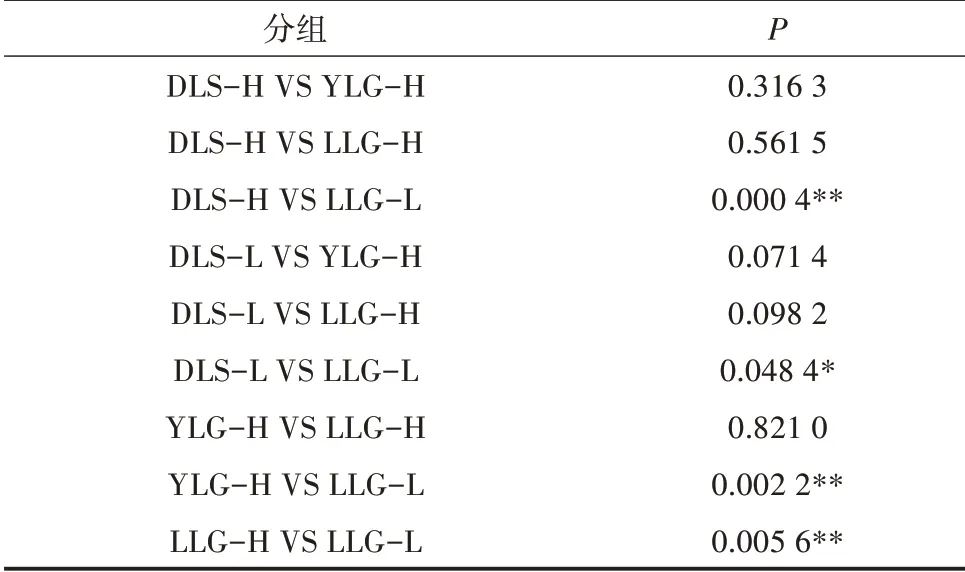
表2 高膻味水平与低膻味水平样本的差异检验
2.2 转录组测序结果
对高膻味水平(LLG-H)和低膻味水平(LLG-L)的龙陵黄山羊肝脏组织共6 个RNA 样品进行测序,结果如表3 所示,经过测序质量控制,共得到40.41 Gb 过滤后的数据,测序样本的总过滤序列数约为4 490 万,高质量序列数约为4 132 万,高质量序列比率约为92.01%,各样品Q30比率均大于89.00%。这表明测序数据质量良好,可用于后续分析。
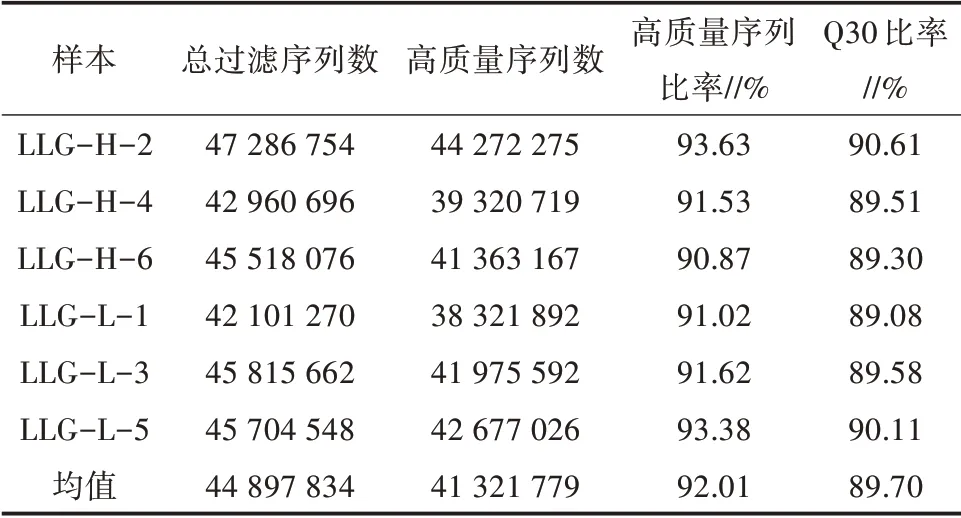
表3 龙陵黄山羊肝脏组织转录组测序结果
2.3 SNP 检测
2.3.1 SNP 统计 利用samtools 软件将经过排序、去PCR 重复后的比对文件同参考序列进行比对,得到每个样品的SNP 检测结果(表4)。进一步分析发现,其中LLG-H 特有的SNP(SNPLLG-H)有411 973个,LLG-L 特有的SNP(SNPLLG-L)有444 638 个,LLG-H 和LLG-L 共 有SNP(SNPLLG)856 611 个。根据变异的统计结果,对高膻味水平(LLG-H)和低膻味水平(LLG-L)龙陵黄山羊的SNP 突变类型的分布进行统计(图1),结果显示6 种单核苷酸变异中,C/T 和A/G 发生的频率最高。
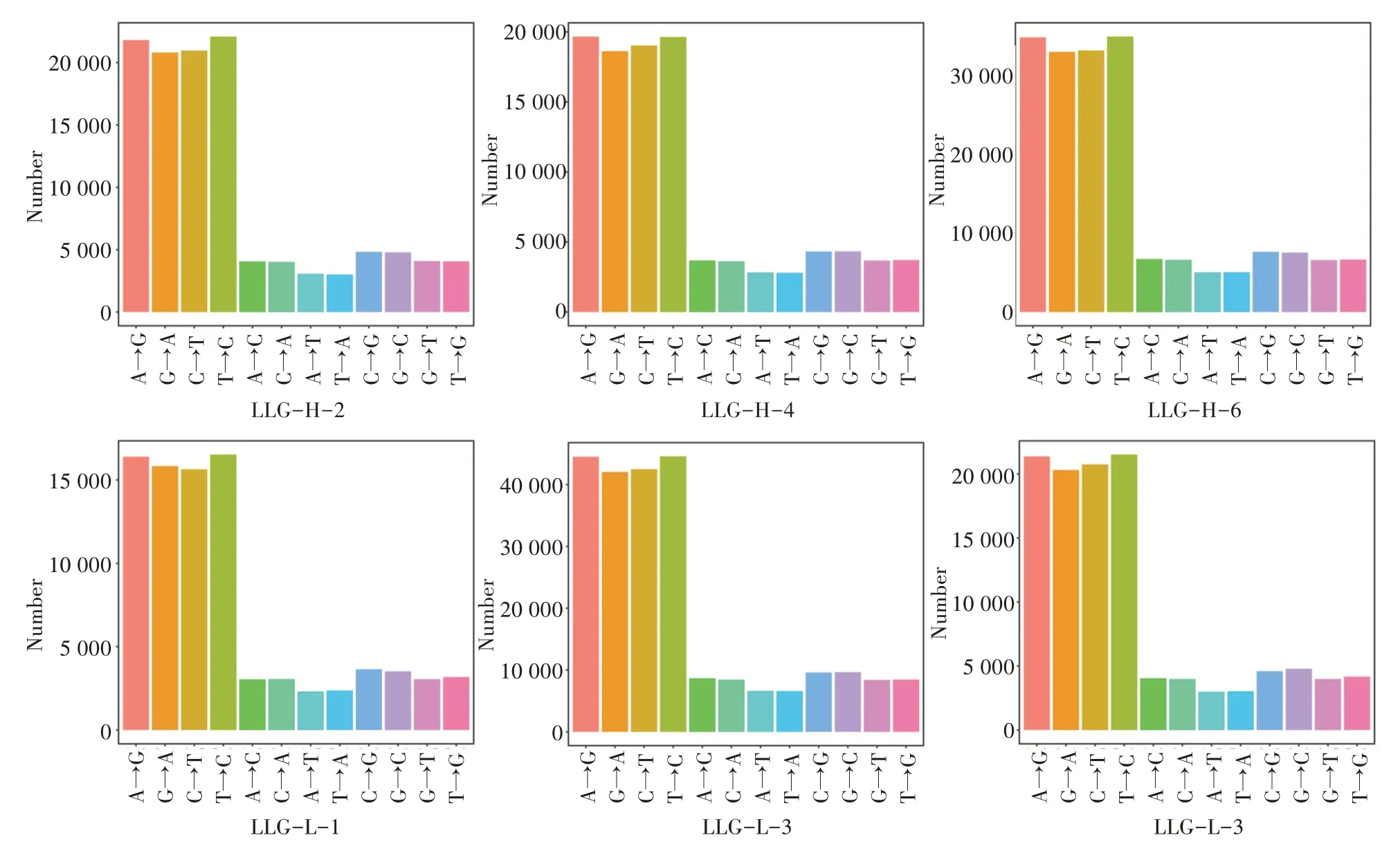
图1 SNP 突变类型

表4 肝脏转录组SNP 检测结果
2.3.2 SNP 所在基因的注释 利用Omicshare 统计SNPLLG-H、SNPLLG-L 和SNPLLG 3 组的SNP 所在基因的GO 富集情况,结果见图2,发现SNPLLG-H、SNPLLG-L 和SNPLLG 的SNP 所在的基因参与生物进程、分子功能和细胞组成3 个部分富集比例基本一致。但是SNPLLG-H 的SNP 所在基因在每个功能的富集比例均大于SNPLLG-L 所在基因。
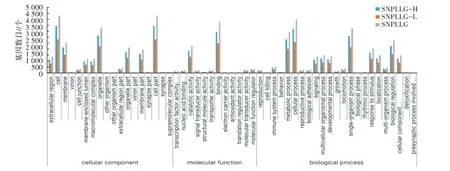
图2 SNP 所在基因的GO 分析
利用Kobas 对所有SNP 所在基因进行KEGG 富集分析,发现总共有4 073 个基因注释到339 个通路上。SNP 所在基因显著富集在磷脂酰肌醇信号系统、补体和凝血级联、胰岛素抵抗、拼接体、自噬-动物、辅因子的生物合成、内质网中的蛋白质加工、胞吞作用、AMPK 信号等通路(图3)。
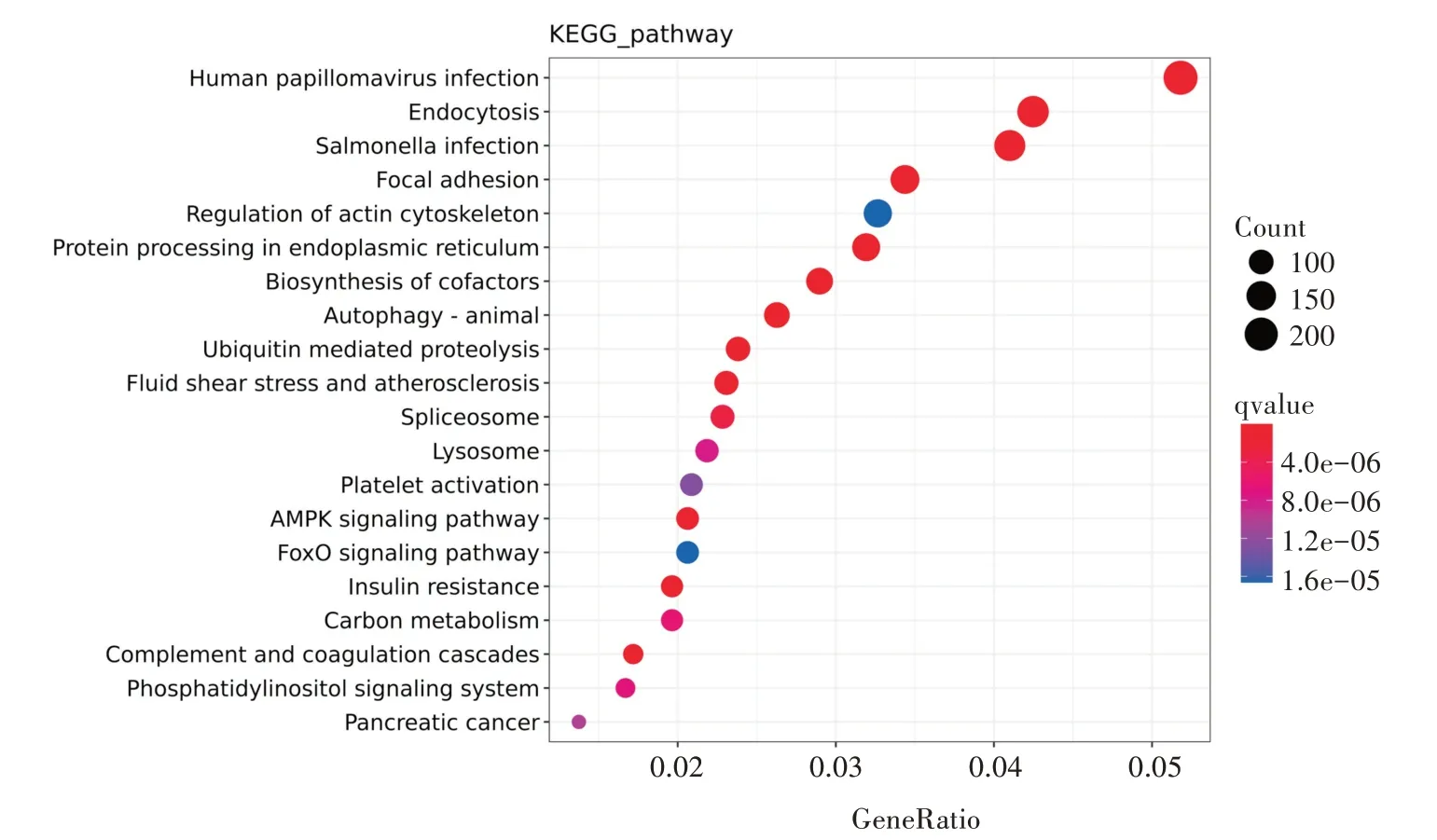
图3 SNP 所在基因的KEGG 分析
2.4 脂肪酸生物合成通路中SNP 功能的生物信息学分析
脂肪酸生物合成是膻味的关键来源,动物脂肪细胞中脂肪的合成直接影响脂肪酸的含量,羊肉膻味相关的脂肪酸正是在各种酶的参与调控下发挥作用。乙酸是脂肪酸合成的主要前体物质,在反刍动物瘤胃发酵下可以产生乙酸。在脂肪细胞内,乙酸在酶的作用下合成乙酰辅酶A,然后在乙酰辅酶A羧化酶的催化下形成丙二酸单酰辅酶A,随后由还原型烟酰氨腺嘌呤二核苷酸磷酸生成酶提供还原氢,脂肪酸合成酶(FASN)催化合成长链脂肪酸,之后细胞利用脂蛋白脂酶水解产生的脂肪酸和细胞从头合成的脂肪酸酯化形成甘油三酯,而激素敏感酯酶则催化甘油三酯水解为甘油和游离脂肪酸(短链脂肪酸)[13]。膻味就是由于其产生的短链脂肪酸而产生的。
根据KEGG 富集结果,发现共有19 个含SNP 的基因富集到脂肪酸生物合成通路,从其中随机挑选6 个有SNP 的基因进行生物信息学分析,结果见表5。由表5 可知,6 个基因中共有7 个SNP 位于同义编码(SYNONYMOUS_CODING)区域,利用Editseq将含有SNP 的SYNONYMOUS_CODING 区域序列翻译为氨基酸,与原氨基酸序列进行比对,发现2 个SNP 引起了氨基酸的改变,FASN、ACACA基因为沉默突变,ACSL3基因为沉默突变、无义突变和错义突变,其中ACSL3基因上的SNP 在高膻味水平和低膻味水平的龙陵黄山羊都有表现,ACSL6基因上的SNP 是低膻味水平龙陵黄山羊特有,但是其氨基酸没有改变,FASN、ACACA基因上的SNP 为高膻味水平龙陵黄山羊所特有。

表5 脂肪酸生物合成通路SNP 功能的生物信息学分析
3 小结与讨论
转录组测序广泛应用于定量基因表达和非注释转录本的鉴定,作为生物学信息的来源,可用于鉴定导致复杂性状变异的原因[14]。除此之外,也有研究表明利用转录组测序进行SNP 的筛选是可行的[15]。使用转录组测序技术大大降低了试验成本,并且获得的数据反映了基因表达,这是最基本的分子表型。转录组测序还能够在特定基因座处提供较高的深度,能够发现高表达基因中的偶发等位基因[16,17]。
该研究发现,6 种单核苷酸变异中,以C/T 和A/G 发生频率最高,这与转换突变发生频率高于颠换的结果相符合。通过对SNPLLG-H、SNPLLG-L、SNPLLG 的SNP 所在基因进行GO 富集,发现SNPLLG-H 的SNP 所在基因在每个功能的富集比例均大于SNPLLG-L 的SNP 所在基因。SNPLLG-H 的SNP 所在基因显著富集在核体、细胞器内膜、细胞-基底粘附体结、细胞质、胞内膜-有界细胞器、细胞外空间、嘌呤核糖核苷结合、过渡金属离子结合、核糖核酸结合、泛素样蛋白连接酶结合、磷酸酶结合、谷胱甘肽过氧化物酶活性的调节、囊泡介导的转运、脂肪酸代谢过程、内皮细胞迁移的调节、胆固醇代谢过程等类别,SNPLLG-L 的SNP 所在基因显著富集在胞内膜-有界细胞器、细胞外区域、核腔、细胞质、细胞-基底粘附体结、细胞外空间、膜、核糖核酸结合、蛋白结合、阳离子结合、过渡金属离子结合、嘌呤核糖核苷结合、激酶结合、泛素样蛋白连接酶结合、泛素样蛋白转移酶活性、磷酸酶结合、谷胱甘肽过氧化物酶活性的调节、修饰依赖性蛋白质分解代谢过
程、活性氧代谢过程、内胚层形成、细胞连接组件等类别。两组SNP(SNPLLG)所在基因富集在不同的生物功能,可能与龙陵黄山羊的膻味有关,龙陵黄山羊支链脂肪酸的产生导致羊膻味的发生。而膻味相关基因究竟是如何影响其膻味的,还需要进一步研究。
研究表明,ACACA、FASN是脂肪酸从头合成的关键限速酶,在细胞之类代谢过程以及脂肪酸生物合成中起重要调控作用,FASN表达模式虽有差异但其表达水平与脂肪含量都显著正相关[18],其表达受到多种激素的调控,当其表达上调时,能增加膻味的产生[19]。ACSL基因家族成员中不同成员在不同组织中有着不同的作用和表达,暗示了每种ACSL成员可能在特定的组织中发挥着不同的特定作用,ACSL6往往会促进长链多不饱和脂肪酸的产生[20],而支链脂肪酸是膻味的来源,ACSL6可能会抑制短链脂肪酸的生成,因此可能会降低羊的膻味[21]。该研究通过对SNP 所在基因KEGG 富集发现,SNP 所在基因显著富集在在磷脂酰肌醇信号系统、补体和凝血级联、胰岛素抵抗、拼接体、自噬-动物、辅因子的生物合成、内质网中的蛋白质加工、胞吞作用、AMPK 信号等通路。从与膻味相关的脂肪酸生物合成通路中随机挑选出6 个含SNP 的基因,发现6 个基因中,有2 个基因的SNP 导致了氨基酸的改变,其中ACSL3基因上的SNP 在高膻味水平和低膻味水平的龙陵黄山羊都有表现,ACSL6基因上的SNP 存在于低膻味水平的龙陵黄山羊,而FASN、ACACA基因上的SNP 为高膻味水平龙陵黄山羊特有。因此,ACSL6基因的变异可能会降低龙陵黄山羊的膻味,而FASN、ACACA基因的变异可能与龙陵黄山羊的高膻味有关。
