转sm-Ngt1 基因水稻遗传稳定性分析
2022-03-21谭艳平刘学群王春台
夏 栋,卢 卫,张 俊,谭艳平,刘学群,王春台
(中南民族大学生命科学学院/生物技术国家民委重点实验室/武陵山区特色资源植物种质保护与利用湖北省重点实验室,武汉 430074)
糖基转移酶通过对细胞中不同化合物的糖基化,参与植物各种代谢及代谢的调节[1]。糖基转移酶参与植物细胞壁多糖的合成,从而介导植物形态建成的过程[2]。糖基转移酶对微生物分泌的毒素的糖基化修饰使其对病原菌产生抗性,同时参与植物对逆境的防御。糖基转移酶基因Twi1沉默的转基因番茄表现出Twi1底物的显著积累和斑点枯萎病毒的易感性增强,进一步研究其机理发现是由于Twi1可调节番茄植物中的类黄酮槲皮苷和山柰酚水平,从而影响植物对病毒的抵抗力[3]。拟南芥中用PstDC3000 感染后,UGT76D1敲除突变体内二羟基苯甲酸(DHBA)糖苷和SA 水平降低,免疫反应延迟,而过表达UGT76D1会导致SA 大量积累,出现类似HR 的病斑表型,证明UGT76D1通过促进DHBA的糖基化,在SA 平衡和植物免疫反应中发挥重要作用[4]。MeSA 作为植物系统获得抗性的移动信号同样在植物体内存在糖基化修饰现象。拟南芥中UGT71C3通过对MeSA 葡萄糖化调节MeSA 和SA的平衡,促进对SAR 响应的负调控[5]。
sm-Ngt1基因是从烟草中分离得到1 个受甲基茉莉酸和水杨酸双重诱导的基因序列,其具有糖基转移酶的特性[6]。秦汉花等[7]将sm-Ngt1基因在拟南芥中超表达,发现其具有抗菌核病的功能。胡文[8]将sm-Ngt1基因转入水稻品种粤泰B(YTB)中,获得了部分可自花授粉结实的转基因植株,抗性鉴定表明带有这些转基因植株获得了稻瘟病抗性[9]。
外源基因能否在受体植株中稳定遗传和表达,直接关系到其商品化和实用化价值[10]。外源基因在受体植株中的表达方式十分复杂,其可能受转入方法、整合方式、甲基化以及环境条件等因素的影响导致沉默或者丢失。本试验旨在对外源基因sm-Ngt1在转基因YTB 植株后代中遗传稳定性进行检测。
1 材料与方法
1.1 材料
15 个转sm-Ngt1基因水稻株系(编号见表1)以及非转基因的转化受体品种水稻粤泰B(YTB),均由中南民族大学武陵山区特色资源植物种质保护与利用湖北省重点实验室提供。

表1 转sm-Ngt1 基因水稻材料编号
DL2000 DNA Marker、10×DNA loading buffer、rTaq、RNase、10×PCR Buffer、dNTP Mix 均购自Takara 公司;无水乙醇、CTAB、Tris-base、EDTA、氯仿、异戊醇等均为分析纯级国产试剂。
根据持家基因actin序列设计了引物actin-F/actin-R,sm-Ngt1基因的CDS 序列设计了2 对引物GT-F1/GT-R1 和GT-F2/GT-R2 用于目的基因检测;根据农业部转基因标记物鉴定方法设计9 对检测引物用于转基因标记物的检测[11-13];序列由昆泰锐(武汉)生物技术有限责任公司合成,具体见表2。
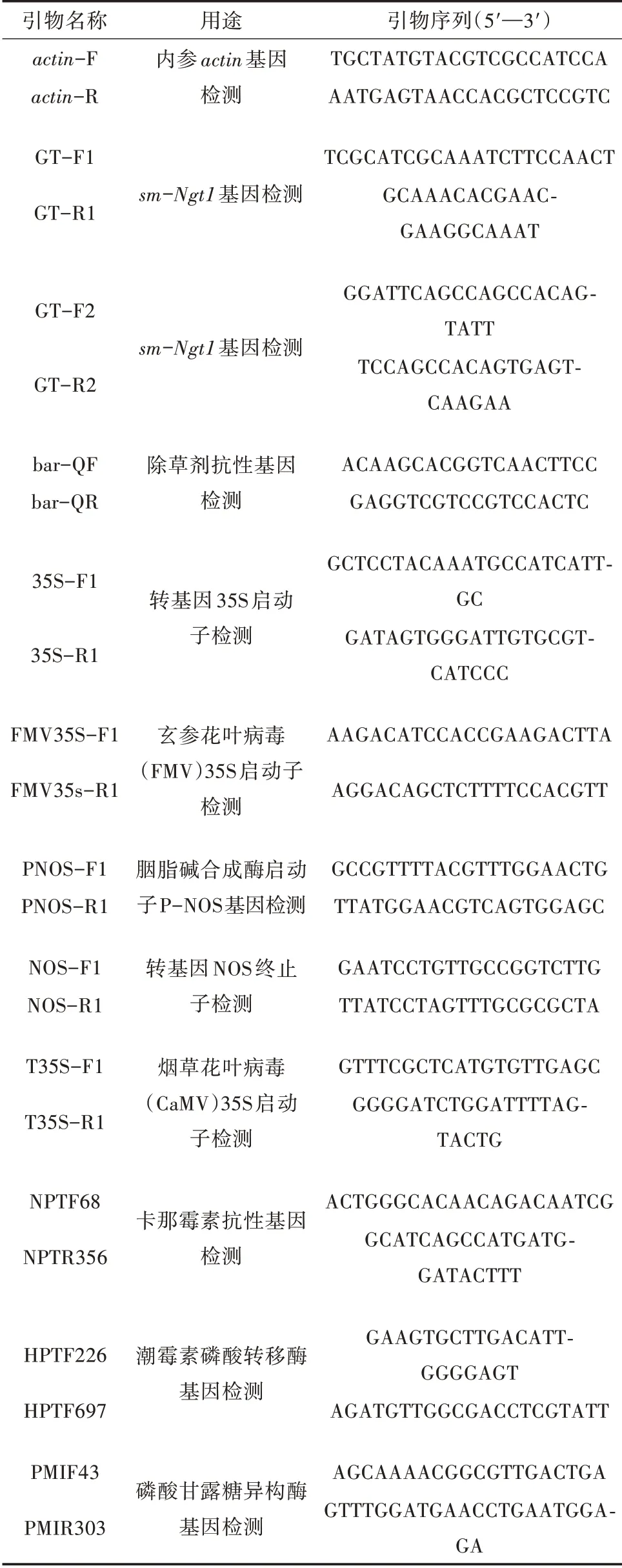
表2 引物序列
1.2 实验仪器
5415D、5417D 冷冻离心机(德国eppendorf);BioPhotometer DNA 浓度测定仪(德国eppendorf);Bio-Rad laboratories MJ Research 041BR-26334 电泳仪(美国);SBD50-1 Heto-Holten 水浴锅(丹麦);Universal Hold II 凝胶成像系统(美国);C1000 touch thermal cycler PCR 仪(美国Bio-Rad)。
1.3 方法
1.3.1 材料种植 将15 个转sm-Ngt1基因的株系材料连续两代(T5、T6 代)和品种YTB 种植在课题组实验室和华中农业大学农业转基因生物试验基地水稻种植区,随机区组设计,设3 次重复,每个小区面积为11 m2(2 m×5.5 m)。所有材料除全生育期不使用任何防稻瘟药物外,均按常规栽培管理。
1.3.2 农艺性状比较 对转sm-Ngt1基因水稻株系与受体品种进行生育期、株高、结实率及千粒重进行考察和统计分析。
1.3.3 CTAB 法提DNA 取材料长约2 cm 叶片于1.5 mL EP 管中,加入液氮迅速研磨至粉末状。加入65 ℃预热的1.67% CTAB 溶液650 μL 于EP 管中,65 ℃条件下保温1 h。室温冷却后加650 μL 的氯仿∶异戊醇(24∶1),4 ℃12 000 r/min 离心10 min,吸取上清于新的1.5 mL EP 管中,加入-20 ℃预冷的无水乙 醇800 μL,在-20 ℃条件 下 冷 却1 h 后,4 ℃12 000 r/min 离心15 min。沉淀中加入800 μL 75%乙醇,4 ℃12 000 r/min 离心1 min。加入1×TE 缓冲液(含RNase)30 μL 室温溶解DNA 后保存于4 ℃冰箱备用。
1.3.4 目的基因sm-Ngt1的PCR 检测 根据目的基因sm-Ngt1编码区的序列设计引物,对转sm-Ngt1基因水稻株系及YTB 的基因组DNA 进行actin和sm-Ngt1基因鉴定。PCR 扩增体系为:10×rTaq buffer 1.5 μL、F、R 引 物(10 μmol/L)各0.25 μL、2.5 mmol/L dNTP Mix 1.0 μL、DNA 模板1.5 μL、5 U/μL rTaq 聚合酶0.1 μL、去离子水10.4 μL;PCR 反应程序为:94 ℃预变性3 min、94 ℃30 s-57 ℃30 s-72 ℃1 min,34 个循环、72 ℃延伸5 min。
1.3.5 转基因标记物的分子检测 根据农业部转基因鉴定方法设计鉴定转基因标记物的9 对引物bar-QF/bar-QR、 35S-F1/35S-R1、 FMV35S-F1/FMV35s-R1、PONS-F1/PONS-R1、NOS-F1/NOS-R1、T35S-F1/T35S-R1、 NPTF68/NPTR356、 HPTF226/HPTF697、PMIF43/PMIR303,以转化水稻的pCAMBIAI1305.1:35S∷sm-Ngt1载体质粒DNA 为模板,检测其可扩增性和最佳复性温度,扩增体系及反应程序同上,复性温度在54~62 ℃,以1 ℃为温度梯度进行PCR 扩增,找出最佳温度后再进行转基因材料的扩增。
2 结果与分析
2.1 目的基因sm-Ngt1 的PCR 检测与分析
将采集的15 个转基因sm-Ngt1水稻株系连续两代(T5、T6 代)的剑叶叶片(每个株系取3 个单株作为重复)进行DNA 提取,actin-F/actin-R 扩增检测材料DNA 质量,结果如图1 所示。

图1 转基因材料DNA 质量
如图2 所示,用GT-F1/GT-R1 和GT-F2/GT-R2对T6 代进行转sm-Ngt1基因水稻阳性鉴定,编号2、4、6、10 这4 个株系中无条带,这表明这4 个株系均为阴性,sm-Ngt1基因没有插入;编号8 的株系中,3株有1 株无条带,表明该株系还处于分离状态;其余转基因株系均为阳性,sm-Ngt1基因稳定转入了YTB。

图2 PCR 鉴定阳性转基因株系
2.2 转sm-Ngt1 基因水稻株系与YTB 的农艺性状对比
转sm-Ngt1基因水稻株系与受体品种YTB 相比,除了茎秆明显增粗外,其生长适应性方面无明显差异。如表3 所示,T6 代转基因植株(编号1、编号3)的抽穗期、株高、结实率及千粒重与阴性(编号4)及受体YTB 差异均不显著。
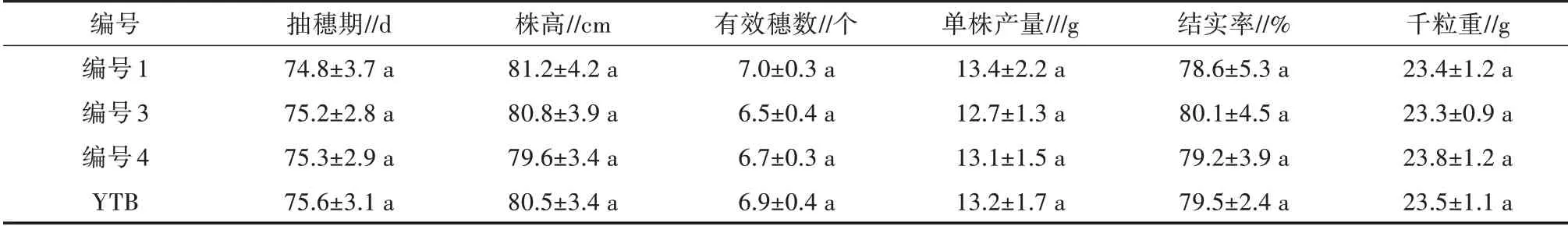
表3 转sm-Ngt1 基因水稻转化体与非转基因对照的农艺性状对比
2.3 转sm-Ngt1 基因水稻中转基因标记物分子检测
将转化水稻YTB 用的pCAMBIAI1305.1:35S∷sm-Ngt1载体质粒DNA 作为模板检测9 对引物的可扩增性和最佳复性温度,结果如图3 所示。由图3 可知,温度对不同引物的扩增无明显影响,5 对引物(35S-F1/35S-R1、NOS-F1/NOS-R1、T35S-F1/T35SR1、HPTF226/HPTF697、NPTF68/NPTR356)可以扩增明显的条带,说明载体pCAMBIAI1305.1 含有这5种元件。表明pCAMBIAI1305.1:35S∷sm-Ngt1载体质粒可以作为sm-Ngt1植株中不同转基因原件PCR 鉴定时稳定的对照。
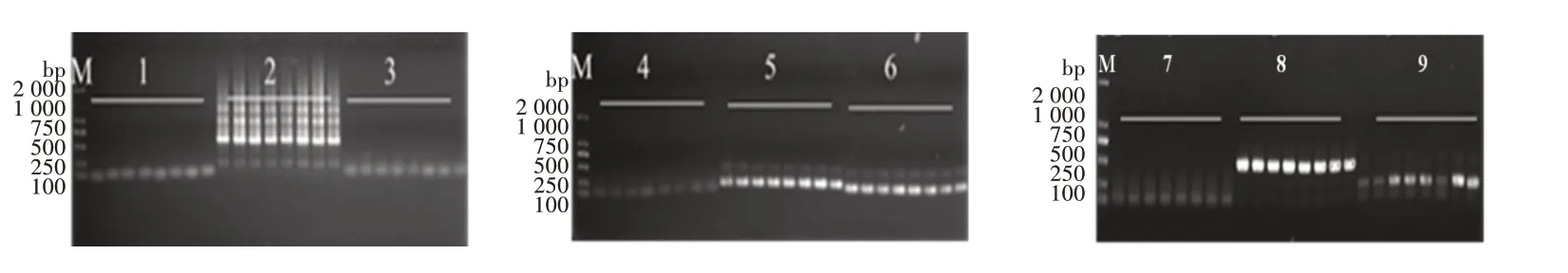
图3 梯度PCR 检测引物的最佳复性温度
用这5 对引物扩增转sm-Ngt1基因水稻不同株系基因组DNA,结果显示有3 对引物(NOS-F1/NOSR1、T35S-F1/T35S-R1、NPTF68/NPTR356)在转基因水稻T5 代和T6 代中都能扩增出特异性条带(图4)。2 对引物(35S-F1/35S-R1、HPTF226/HPTF69)在编号2、4、6、10 这4 个株系(T5 和T6)中无条带,编号8的株系中,3 株T6 中有1 株无条带,其余株系都有条带(图5)。

图4 PCR 分子标记检测

图5 PCR 分子标记检测
3 小结与讨论
外源基因在转基因受体中的遗传稳定性受进入受体植株基因组位置的影响,其在转基因后代中的表达可能受到特异性抑制而出现转基因沉默。Singh 等[14]和张小红等[15]对玉米和转Xa23 基因水稻进行研究发现,外源基因插入受体植物基因组位置不同,其表达水平有明显的差异。此外,外界环境因素对转基因植物遗传稳定性也有影响。蒋佳宏等[16]研究tak基因表达时发现,用光诱导tak基因促进了tak2 基因转录,抑制了tak1 基因转录。本研究根据sm-Ngt1基因序列设计2 对引物,对连续种植2年的15 个转sm-Ngt1基因水稻两代家系的基因组DNA 进行PCR 扩增,结果发现在15 个株系中,编号2、4、6、10 的4 个转基因家系中无sm-Ngt1基因,编号为8 的家系中含有sm-Ngt1基因但遗传不稳定,在其余株系中sm-Ngt1基因均能稳定遗传。
将转基因用的pCAMBIAI1305.1:35S∷sm-Ngt1载体质粒DNA 作为模板对农业部要求的9 对引物的可扩增性进行检测,有5 对引物(35S-F1/35S-R1、NOS-F1/NOS-R1、 T35S-F1/T35S-R1、 NPTF68/NPTR356、HPTF226/HPTF6975)能扩增出特异条带,与pCAMBIAI1305.1 质粒载体各原件相符合。用这5 对引物鉴定15 个转sm-Ngt1基因株系的转基因标记 物,有3 对 引 物(NOS-F1/NOS-R1、T35S-F1/T35S-R1、NPTF68/NPTR356)在所有转基因水稻株系的后代中(T5 代和T6 代)都能扩增出特异性条带,可能是因为pCAMBIAI1305.1:35S∷sm-Ngt1整合进入受体YTB 基因组时,其T-DNA 未被酶完全切开,导致pCAMBIAI1305.1 载体的NOS基因和NPT基因进入水稻YTB 基因组DNA 中。2 对引物(35SF1/35S-R1、HPTF226/HPTF69)检测结果与sm-Ngt1检测结果相同。初步实验结果得出编号1、3、5、7-9、11-15 的11 个转基因株系含35S 启动子和HPT基因,编号8 株系35S 启动子和HPT基因的遗传不稳定,其余的10 个株系中的35S 启动子和HPT基因在后代中均能稳定遗传。
