基于UHPLC-QTOF-MS/MS技术的骆驼蓬化学成分分析及其神经保护活性
2022-03-21王宁宁魏冠华张智军房建国MohammadUmarFarooqImtiazAhmadQamar刘映前杨志刚
王宁宁,魏冠华,张智军,房建国,Mohammad Umar Farooq,Imtiaz Ahmad Qamar,刘映前,杨志刚*
基于UHPLC-QTOF-MS/MS技术的骆驼蓬化学成分分析及其神经保护活性
王宁宁1,魏冠华1,张智军1,房建国2,Mohammad Umar Farooq3,Imtiaz Ahmad Qamar3,刘映前1,杨志刚1*
1. 兰州大学药学院,甘肃 兰州 730000 2. 兰州大学化学化工学院,甘肃 兰州 730000 3. 巴基斯坦农业研究中心,巴基斯坦 伊斯兰堡
基于UHPLC-QTOF-MS/MS技术对骆驼蓬化学成分进行分析,并探讨其神经保护活性。色谱柱为ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.6 μm),流动相为0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B),梯度洗脱;体积流量0.3 mL/min;进样体积2 μL;柱温35 ℃。质谱系统采用电喷雾离子源(ESI),正离子模式下检测。利用过氧化氢(H2O2)和6-羟基多巴胺(6-hydroxydopamine,6-OHDA)诱导的PC12细胞氧化损伤模型和脂多糖(lipopolysaccharide,LPS)诱导的BV2细胞神经炎症模型,探讨骆驼蓬全草和种子的甲醇提取物以及去氢骆驼蓬碱、骆驼蓬碱、哈尔满和去甲哈尔满4种骆驼蓬中主要生物碱的神经保护活性。从骆驼蓬中共鉴别32个化学成分,全草中主要含有脱氧鸭嘴花碱、鸭嘴花醇等喹唑酮类生物碱,而种子中主要含有去氢骆驼蓬碱、骆驼蓬碱等β-咔啉类生物碱。骆驼蓬全草、种子甲醇提取物和4种生物碱对LPS刺激诱导BV2细胞一氧化氮(NO)生成具有一定的抑制活性,并对H2O2和6-OHDA诱导的PC12细胞损伤均具有明显的保护作用(<0.01)。骆驼蓬全草和种子中的生物碱成分存在差异,而且其所含的生物碱类化合物具有一定的神经保护作用,为骆驼蓬的质量控制及药效物质基础研究提供了参考。
骆驼蓬;UHPLC-QTOF-MS/MS;生物碱;神经保护活性;去氢骆驼蓬碱;骆驼蓬碱;哈尔满;去甲哈尔满
骆驼蓬L.为蒺藜科骆驼蓬属多年生草本植物,其味苦、性温、有毒,在我国西北干旱地区广泛分布[1]。骆驼蓬全草和种子在维吾尔族、哈萨克族、蒙古族、藏族的传统医药中均可入药,具有祛风止痛、镇咳平喘、温身通窍的功效,临床主治关节骨痛、筋脉软弱、偏瘫健忘、神昏头痛、月经不调等症[2]。骆驼蓬在巴基斯坦民间传统医药中也有应用,主要用于血液净化、止痛麻醉、促进伤口愈合、糖尿病等[3]。《中国民族药志》中记载,骆驼蓬能解郁补脑,用于精神郁闷、瘫痪、健忘、癫痫,对神经系统相关疾病具有一定的治疗作用[4]。骆驼蓬全草和种子中主要含有β-咔啉和喹唑酮类生物碱成分,且总生物碱是骆驼蓬子改善小鼠学习记忆的有效部位[5]。张晓双等[6]研究表明骆驼蓬总碱通过下调促凋亡蛋白Bax的表达,上调抑凋亡蛋白B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)的表达,抑制海马神经细胞凋亡,从而改善血管性痴呆性大鼠的学习记忆能力。此外,诸多研究表明骆驼蓬属及其活性生物碱成分对神经系统具有广泛药理作用,包括镇痛作用、幻觉作用、兴奋作用、神经保护作用[7],以及对胆碱酯酶和单胺氧化酶具有较强的抑制作用[8]。
LC-MS具有分离性能强、选择性好、灵敏度高的优势,且QTOF获得的高分辨质谱信息有助于快速检索以鉴定代谢物,对药用植物中复杂的微量成分分离分析具有重要的意义[9]。为深入分析骆驼蓬不同部位的生物碱成分和活性差异,本研究首先通过UHPLC- QTOF-MS/MS技术对骆驼蓬全草及种子中的化学成分进行鉴别分析,并通过建立过氧化氢(H2O2)和6-羟基多巴胺(6-hydroxydopamine,6-OHDA)诱导的大鼠肾上腺嗜铬瘤PC12细胞氧化损伤模型和脂多糖(lipopolysaccharide,LPS)诱导的小胶质BV2细胞神经炎症模型,用骆驼蓬全草和种子的甲醇提取物,及其去氢骆驼蓬碱、骆驼蓬碱、哈尔满、去甲哈尔满4种生物碱干预,探讨其神经保护活性。
1 材料与方法
1.1 材料与试剂
Agilent 1290超高效液相色谱仪(美国Agilent公司);Agilent 6560离子淌度飞行时间质谱仪(美国Agilent公司);无水甲醇(分析纯),天津市富宇精细化工有限公司,甲酸(质谱级)和乙腈(质谱级),德国Merck公司;去离子水,屈臣氏。UHPLC-QTOF-MS分析对照品:去氢骆驼蓬碱、骆驼蓬碱、哈尔满、去甲哈尔满(质量分数≥98%),由兰州大学药学院刘映前教授提供。
本实验所用骆驼蓬全草样品采集于巴基斯坦和中国甘肃,种子样品采集于中国新疆,经兰州大学药学院杨志刚副教授鉴定为蒺藜科骆驼蓬L.的种子及全草,样品标本(202010001)保存于兰州大学药学院。
1.2 骆驼蓬的成分分析
1.2.1 对照品溶液的制备 精密称取对照品去氢骆驼蓬碱、骆驼蓬碱、哈尔满、去甲哈尔满各1.00 mg,甲醇溶解后配成10 μg/mL的溶液,用0.22 μm滤膜过滤,取续滤液,作为对照品溶液。
1.2.2 供试品溶液的制备 将骆驼蓬全草和种子粉碎后过50目筛,得到粉末样品;精密称取各样品粉末0.20 g,置100 mL具塞锥形瓶中,加入50 mL甲醇,称定质量;超声处理30 min(功率600 W,频率40 kHz),放冷,再称定质量,用甲醇补足质量;静置30 min后取上清液1.5 mL,13 000 r/min离心2 min后,用0.22 μm滤膜滤过,取续滤液,即得供试品溶液。剩余样品溶液滤过,浓缩至干,用DMSO配制成相应的浓度,用于活性测试样品。
1.2.3 UHPLC-QTOF-MS/MS条件 色谱柱为ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.6 μm),流动相由0.1%甲酸水溶液(A)和0.1%甲酸乙腈溶液(B)组成。梯度洗脱:0~1 min,3%~5% B;1~3 min,5%~7% B;3~7 min,7%~20% B;7~15 min,20%~40% B;15~22 min,40%~100% B;22~25 min,100% B;25.1~30 min,100% B;体积流量0.3 mL/min;进样体积2 μL;柱温35 ℃。
质谱系统采用电喷雾离子源(ESI),QTOF操作模式为Auto MS/MS,扫描范围/50~1700。ESI源参数:干燥气(N2)体积流量10 mL/min;干燥气温度225 ℃;雾化气压力172 kPa;毛细管电压3500 V;喷嘴电压500 V;毛细管出口电压400 V;碰撞能10、20、40 eV;正离子模式下检测。
1.2.4 数据采集与处理 液质数据采集及处理软件为Agilent MassHunter(B.08.00,美国安捷伦公司),Profinder(B.08.00,美国安捷伦公司),Mass Profiler Professional(B.14.9,美国安捷伦公司)。
1.2.5 化合物的鉴定 将Agilent MassHunter软件采集的数据导入Profinder软件进行数据预处理,然后用Mass Profiler Professional软件进行MS数据统计分析,对每组样品化合物出现频率过滤。根据精确的相对分子质量,计算化合物可能的元素组成;根据各成分的相对保留时间、二级特征碎片离子信息、质谱裂解规律,并结合对照品指认和文献数据及Metlin、MassBank、PubChem等数据库比对二级质谱数据,对化合物进行鉴定。
1.3 细胞实验
1.3.1 细胞培养 BV2细胞和PC12细胞的培养基为含10%胎牛血清和1%抗生素(青霉素和链霉素)的DMEM高糖培养液,在含5% CO2和95%空气的饱和水培养箱中37 ℃恒温培养24 h。
1.3.2 MTT实验 采用MTT法评估细胞生存率。分别取对数期生长的PC12、BV2细胞混悬液100 μL接种于96孔板中进行细胞培养。待细胞贴壁后,每孔中加入10、20 μg/mL浓度的药物样品(骆驼蓬全草及种子甲醇提取物浸膏及其4种主要的生物碱:去氢骆驼蓬碱、骆驼蓬碱、哈尔满、去甲哈尔满)培养24 h,再加入MTT 20 μL培养4 h,加入提取缓冲液(由10%十二烷基硫酸钠、5%异丁醇、0.1% HCl水溶液组成),孵育过夜。甲瓒结晶充分溶解后,用酶标仪在570 nm下测定吸光度()。
1.3.3 BV2细胞抗炎活性 通过抑制NO生成实验评价抗炎活性。待BV2细胞贴壁后,每孔加入LPS(1 μg/mL)诱导神经炎症模型,同时加入不同浓度的药物样品培养24 h。取各孔细胞上清培养液50 μL置于96孔板中,加入Griess试剂,混匀后静置。室温下避光反应10 min,用酶标仪在570 nm波长处测定。
1.3.4 PC12细胞氧化损伤保护活性 通过检测细胞活力变化评价药物对H2O2、6-OHDA诱导的PC12细胞氧化损伤模型的保护作用。PC12细胞贴壁后,每孔加入不同浓度的药物样品培养24 h。更换细胞培养液,每孔加入H2O2(终浓度500 μmol/L)、6-OHDA(终浓度200 μmol/L)建立PC12细胞氧化损伤模型。加入MTT继续培养4 h,每孔再加入100 μL提取缓冲液,甲瓒结晶充分溶解后于570 nm波长处测定。
2 结果与讨论
2.1 化学成分鉴定
骆驼蓬样品正离子模式下的总离子色谱图如图1,所鉴别的化合物见表1。此外,将Agilent Mass Hunter软件采集一级质谱数据导入Profinder软件,进行数据预处理后以cef格式文件导入MPP软件进行分子特征提取(molecular feature extraction,MFE),得出巴基斯坦、中国甘肃和新疆的骆驼蓬样品中化学成分数量,结果见图2。
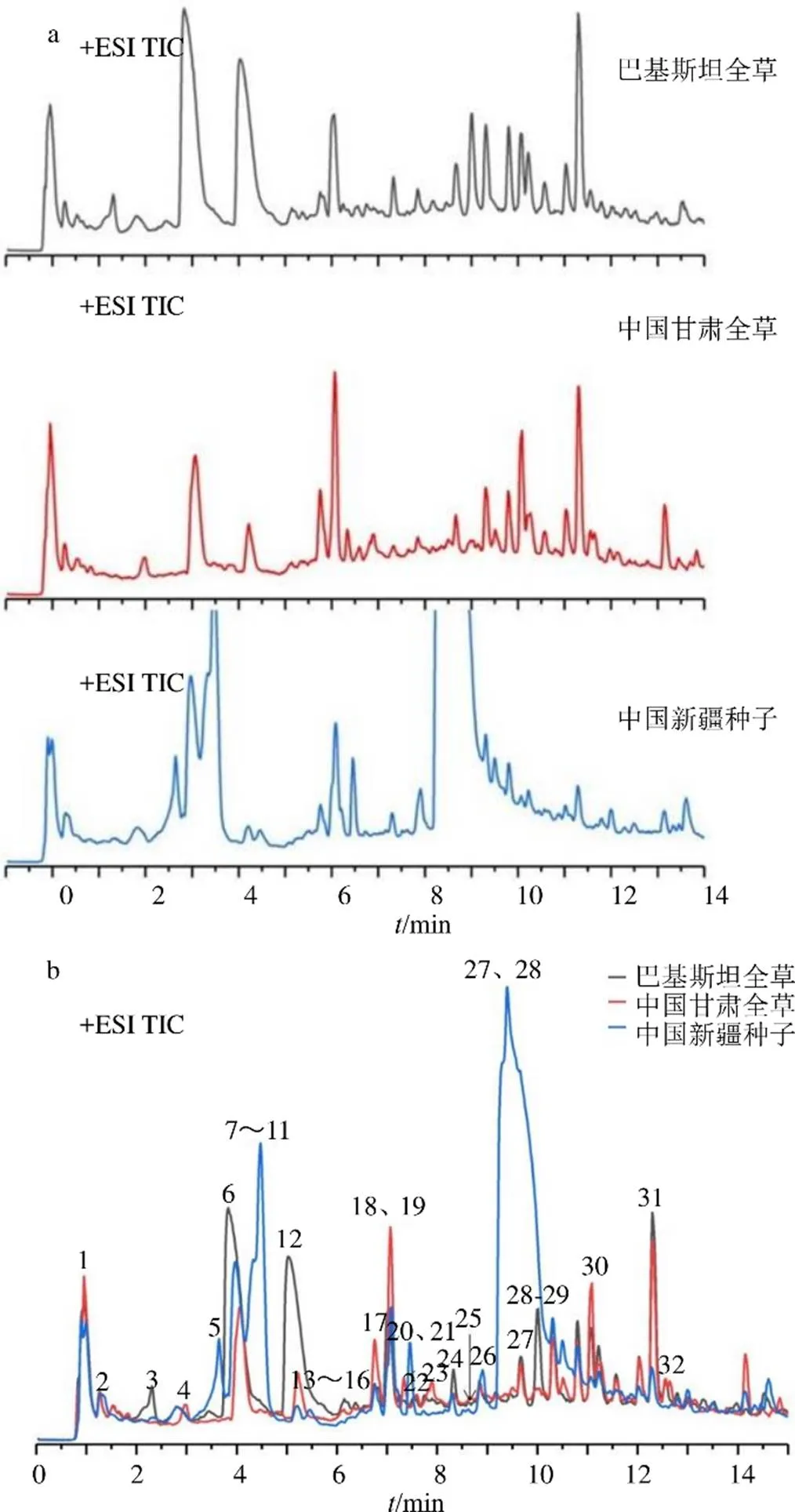
a-巴基斯坦和中国甘肃骆驼蓬全草、中国新疆骆驼蓬种子样品的总离子流图 b-3个样品的总离子流图对比分析图
表1 骆驼蓬中鉴别的主要化学成分
Table 1 Main compounds in P. harmala
编号化合物名称分子式tR/min主要二级碎片离子(m/z)[M+H]+(m/z)检测归属理论值实测值S1S2S3 1骆驼蓬酸C6H11NO30.953128.071 3, 100.076 3, 82.066 2146.081 2146.082 5√√√ 2L-pipecolateC6H11NO21.25084.071 0130.086 3130.086 7√√√ 3indole-3-acetaldehydeC10H9NO2.309132.081 3, 117.057 9160.075 7160.076 0√√√ 4vasicinolC11H12N2O22.838187.087 3, 169.077 7205.097 2205.098 1√√√ 5鸭嘴花碱C11H12N2O3.495161.106 5, 120.044 6, 70.065 9189.102 2189.102 6√√√ 6鸭嘴花醇C11H12N2O3.981171.092 9, 154.066 3, 144.081 3, 118.066 2, 91.055 2189.102 2189.102 6√√√ 7鸭嘴花碱二糖苷C23H32N2O114.491351.154 3, 189.101 5, 171.091 8513.207 9513.208 1√√√ 8鸭嘴花碱糖苷C17H22N2O64.591189.094 3, 171.084 0351.155 1351.157 1√√√ 9pegaharmine IC13H14N2O24.722215.119 5, 188.094 2, 172.097 7, 160.065 1, 144.069 1231.112 6231.112 7√√√ 10luotonin EC19H13N3O24.840301.119 0, 283.104 5, 261.983 4, 231.112 3, 188.090 9316.108 1316.108 5——√ 112-carboxyl-3,4-dihydroquinazolineC9H8N2O24.923149.912 5, 131.060 1, 106.034 6177.065 9177.065 8√√√ 12脱氧鸭嘴花碱C11H12N25.221144.069 7, 118.058 1, 106.067 3, 91.055 1173.107 3173.107 4√√√ 13glycosides vasicinolC18H18N2O36.226205.098 3, 188.073 5, 171.092 1367.151 3367.151√√√ 14脱氧鸭嘴花酮碱C11H10N2O6.301171.090 5, 144.081 0, 118.064 2187.086 6187.086√√√ 15peganumalineFC14H16N2O36.590231.112 1, 188.089 0, 170.079 0261.123 4261.125√√√ 16tetrahydroharmaneC12H14N26.603171.090 3, 144.077 5187.123 0187.124 3√√√ 17鸭嘴花酮碱葡萄糖苷C17H21N2O77.069203.048 3, 185.035 9365.134 3365.134 6√√√ 18鸭嘴花酮碱C11H10N2O27.003185.072 6, 130.066 2203.081 5203.081 8√√√ 19去甲骆驼蓬碱C12H12N2O7.135185.072 6, 160.076 7201.102 2201.103 8√√√ 20二氢路因碱C19H24N2O77.204231.113 7, 215.079 3393.165 6393.166 1√√√ 21路因碱C19H22N2O77.235229.093 3, 214.057 2391.150 0 391.150 6√√√ 22哈尔醇C12H10N2O7.499184.065 9, 181.076 6199.086 6199.087 2√√√ 23去甲哈尔满C11H8N28.163142.066 1, 115.054 3169.076 0169.075 8√√√ 24去氢骆驼蓬碱氮氧化物C13H12N2O28.342214.074 4, 187.082 6229.097 2229.099 2√√√ 25哈尔满C12H10N28.824168.078 1, 144.081 4, 115.055 3183.091 7183.092 8√√√ 26dihydroharmaneC12H12N28.874170.084 4, 144.081 5, 130.066 2185.107 3185.108 8——√ 27骆驼蓬碱C13H14N2O9.929200.095 8, 174.092 6215.117 9215.119 4√√√ 28去氢骆驼蓬碱C13H12N2O10.012198.080 2, 170.084 9, 144.080 6213.102 2213.103 6√√√ 293-hydroxylated harmineC13H12N2O210.510215.076 9229.097 2229.098 8√√√ 30脱乙酰基骆驼蓬苷C40H52O2411.072447.133 8, 285.074 8917.292 1917.290 7√√√ 31骆驼蓬苷C42H54O2512.310651.203 5, 447.130 1, 285.076 5959.302 7959.301 9√√√ 32harmalacidineC12H12N2O212.792189.102 2, 162.091 7, 146.063 8, 128.999 5217.097 2217.097 0——√
S1-巴基斯坦全草 S2-中国甘肃全草 S3-中国新疆种子;√表示检测到该成分 —表示未检测到该成分
S1-the herbs from Pakistan S2-the herbs from Gansu of China S3-seeds from Xinjiang of China; √detected —not detected
2.1.1 β-咔啉类生物碱结构鉴定 β-咔啉类生物碱是骆驼蓬中最主要的生物碱,包括去氢骆驼蓬碱、骆驼蓬碱、去甲骆驼蓬碱、哈尔满、去甲哈尔满、哈尔醇等[2]。此类结构母核为吡啶并吲哚类,正离子模式下易发生母核侧链CH3(-15)和CO(-28)等中性碎片丢失,母核裂解丢失HCN(-27),丢失C2H4(-28)、丢失NH3(-18)、丢失C2H3N(-41)等[10,16]。

图2 骆驼蓬全草和种子的化学成分数量韦恩图
化合物23、25、27、28的保留时间分别为8.163、8.824、9.929、10.012 min,正离子模式下分别产生/为169.075 8、183.092 8、215.119 4、213.102 2 [M+H]+的准分子离子峰,和对照品的保留时间、碎片信息及特征峰一致,分别确定为去甲哈尔满、哈尔满、骆驼蓬碱和去氢骆驼蓬碱。
化合物19、20、21、22和文献报道[11-12]的准分子离子峰、二级特征质谱数据一致,分别推测为去甲骆驼蓬碱、二氢路因碱、路因碱、哈尔醇。
化合物9的保留时间为4.722 min,根据准分子离子峰/231.112 7 [M+H]+,推测其分子式为C13H14N2O2,在进一步的质谱裂解中,可以看到有/为198.925 4(-31,-OCH3)、214.119 5(-17,-OH)、188.098 2(-26,-CN)、172.097 7(-16,-NH2)、144.069 1(-28,-C2H4)等二级碎片离子,结合文献报道[13],推测其为pegaharmine I。
化合物15的保留时间为6.590 min,根据准分子离子峰/261.123 7 [M+H]+,推测其分子式为C14H16N2O3,进一步的质谱裂解中产生/为231.112 1(-30,-CH2O)、188.089 0(-43,-CH3CO)、170.0790(-18,-NH3)等,结合文献献报道[14],推测其为peganumaline F。
化合物16的保留时间为6.603 min,根据准分子离子峰/187.123 1 [M+H]+,推测其分子式为C12H14N2,进一步的质谱裂解中产生/为171.090 3(-16,-NH2)、144.077 5(-27,-CH2CH),118.065 8(-26,C8H8N+)、106.064 4(C7H8N+)等二级碎片离子,结合文献报道[15],推测其为tetrahydro norharmane。
化合物24保留时间为8.342 min,根据准分子离子峰/229.098 8 [M+H]+,推测其分子式为C13H12N2O2。进一步的质谱裂解中产生/为214.074 4(-15,-CH3)、187.082 6(-42,-COCH3)等二级碎片离子,结合文献报道[16],推测为去氢骆驼蓬碱氮氧化物。
化合物26的保留时间为8.874 min,根据准分子离子峰/185.108 8 [M+H]+,推测其分子式为C12H12N2,进一步的质谱裂解中产生/为170.084 4(-15,-CH3)、143.073 3(-27,-HCN)等二级碎片离子,结合文献报道[11],推测其为dihydroharmane。
化合物32的保留时间为12.792 min,根据准分子离子峰/217.097 0 [M+H]+,推测其分子式为C12H12N2O2,进一步的质谱裂解中产生/为189.102 2(-28,-CO)、162.091 7(-27,-HCN)、146.063 8(-16,-NH2)、128.999 5(-18,-H2O)等二级碎片离子,结合文献报道[17],推测其为harmalacidine。
2.1.2 喹唑酮类生物碱结构鉴定 喹唑酮类生物碱是骆驼蓬全草及种子中另一类重要的生物碱,如鸭嘴花碱(vasicine)、去氧鸭嘴花碱(deoxypeganine)、鸭嘴花碱酮(vasicinone)、去氧鸭嘴花碱酮(deoxyvasicinone)、骆驼宁碱等[2]。
化合物4的保留时间为2.838 min,根据准分子离子峰/205.098 1 [M+H]+,推测其分子式为C11H12N2O2,进一步的质谱裂解中产生/为187.084 3(-18,-H2O)等二级碎片离子,结合文献报道[13],推测其为vasicinol。
化合物5和6保留时间为3.945 min和3.981 min,正离子模式下首先产生/189.103 0 [M+H]+准分子离子峰,推测其分子式为C11H12N2O,对母离子进行碰撞诱导解离产生/为171.092 9(-18,-H2O),144.081 2(C10H10N+),118.066 2(C8H8N+),91.055 2(C7H7+)等二级碎片离子,化合物5与文献报道数据一致[18],推测其可能为鸭嘴花碱,而6为鸭嘴花醇。
化合物7的保留时间为4.491 min,根据准分子离子峰/513.208 1 [M+H]+,推测其分子式为C29H42N2O16,进一步的质谱裂解中产生丢失1分子葡萄糖/为351.154 3(-162,-Glu)的离子碎片,再丢失1分子葡萄糖/为189.101 5(-162,-Glu)的二级碎片离子,结合文献报道[19],推测其为二糖苷鸭嘴花碱,但糖具体的连接位置通过质谱尚无法确定。
化合物8的保留时间为4.591 min,根据准分子离子峰/351.147 1 [M+H]+,推测其分子式为C17H22N2O6,进一步的质谱裂解中产生/为189.094 3(-162,-Glu),[M+H-Glu-H2O]+171.084 0(-18,-H2O)等二级碎片离子,结合文献报道[19],推测其为鸭嘴花碱糖苷。
化合物10的保留时间为4.840 min,根据准分子离子峰/316.128 5 [M+H]+,推测其分子式为C19H13N3O2,进一步的质谱裂解中产生/为301.119 0(-15,-CH3),283.104 5(-18,-H2O),261.983 4(-55,-C4H7),231.112 3(-30,-NH2CH2),188.090 9(-128,-C8H2NO)等二级碎片离子,结合文献报道[19],推测其为luotonin E。
化合物11的保留时间为4.923 min,根据准分子离子峰/177.065 8 [M+H]+,推测其分子式为C9H8N2O2,进一步的质谱裂解中产生/为149.912 5(-28,-CO),131.060 1(-18,-H2O),106.034 6(-43,-CH3CO)等二级碎片离子,结合文献报道[21],推测其为2-carboxyl-3,4-dihydroquinazoline。
化合物17的保留时间为7.069 min,根据准分子离子峰/365.111 4 [M+H]+,推测其分子式C17H21N2O7,进一步的质谱裂解中产生/为203.048 3(-162,-Glu),185.035 9(-18,-H2O)等二级碎片离子,结合文献[19,21],推测其为鸭嘴花酮碱葡萄糖苷。
化合物12、14、18和文献报道[10]的准分子离子峰、二级特征质谱数据一致,推测为脱氧鸭嘴花碱、脱氧鸭嘴花酮碱、鸭嘴花酮碱。
2.1.3 其他 化合物1和文献报道[16]准分子离子峰、二级特征质谱数据一致,推测其为骆驼蓬酸。
化合物2的保留时间为1.400 min,根据准分子离子峰/130.086 7 [M+H]+,推测其分子式为C6H11NO2,进一步的质谱裂解中产生/为112.063 7(-18,-H2O)二级碎片离子,通过比对MassBank数据库,推测其为-pipecolate。
化合物3的保留时间为2.181 min,根据准分子离子峰/160.076 0 [M+H]+, 推测其分子式为C10H9NO,进一步的质谱裂解中产生/为132.081 3(-28,-CO),117.057 9(-15,-CH3)等二级碎片离子,通过比对MassBank数据库,推测其为indole-3-acetaldehyde。
化合物13的保留时间为6.226 min,根据准分子离子峰/367.151 0 [M+H]+,推测其分子式为C18H18N6O3,进一步的质谱裂解中产生/为205.098 3(-162,-Glu)碎片离子,结合文献报道[21],推测其为glycosides vasicinol。
化合物30的保留时间为11.072 min,根据准分子离子峰/917.295 9 [M+H]+,推测其分子式为C40H52O24,进一步的质谱裂解中产生/为447.133 8,285.074 8二级碎片离子,结合文献报道[16,20],推测其可能为脱乙酰基骆驼蓬苷。
化合物31的保留时间为12.312 min,根据准分子离子峰/959.307 7 [M+H]+,推测其分子式为C42H54O25,进一步的质谱裂解中产生/为651.203 5,447.130 1,285.076 5等二级碎片离子,结合文献报道[16],推测其可能为骆驼蓬苷。
从表1和图1中可以看出,-pipecolate、indole-3-acetaldehyde首次在骆驼蓬中检测发现,luotonin E、dihydroharmane、harmalacidine仅在种子中发现,巴基斯坦和中国产骆驼蓬全草,以及全草和种子间的成分差异较大,鸭嘴花碱、鸭嘴花醇、脱氧鸭嘴花碱、鸭嘴花酮碱、骆驼蓬碱、去氢骆驼蓬碱、脱乙酰基骆驼蓬苷、骆驼蓬苷等生物碱的含量差异较大。此外,从骆驼蓬全草和种子的化学成分韦恩图(图2)中可以看出,巴基斯坦产地和中国甘肃产骆驼蓬全草,以及中国新疆产骆驼蓬种子中的特有的代谢产物数量分别为183、171和229,而3者共有的代谢物数量是70,进一步说明不同部位、不同产地骆驼蓬成分差异较大。根据二级质谱数据对3个产地样品的化学成分进行鉴别,已鉴别出的32个化合物的详细信息见表1。中国和巴基斯坦在骆驼蓬全草传统药效的应用上有差异,不同部位的应用也有差异[21],可能和这些生物碱类有效成分的种类和含量相关,但仍需要扩大样本量深入探讨其药效物质成分-生物活性-作用机制之间的关联。
2.2 细胞活性实验结果
2.2.1 BV2细胞活性结果 BV2细胞是中枢神经系统最主要的免疫细胞,炎症反应在神经退行性疾病进程中发挥重要作用[22-23]。BV2细胞存活率结果显示(图3-a),与空白组相比,骆驼蓬碱、去氢骆驼蓬碱、去甲哈尔满、种子总浸膏在10、20 μg/mL时,对BV2细胞均无明显的损伤作用;哈尔满和全草总浸膏在20 μg/mL时,BV2细胞存活率下降,有明显的损伤作用。LPS作用于BV2细胞后NO的释放量会增加,所有样品对LPS诱导的BV2细胞表现出一定的浓度依赖性抑制炎症相关因子NO释放(图-3b)。
2.2.2 PC12细胞活性结果 PC12细胞常用于研究多巴胺能神经元病理和药理作用,神经毒素6-OHDA和H2O2可诱导PC12细胞氧化应激凋亡,可用于模拟诱导帕金森病[24]。PC12细胞MTT活性结果如图4-a所示,与空白组相比,骆驼蓬碱、去氢骆驼蓬碱、去甲哈尔满、种子总浸膏和全草总浸膏在10、20 μg/mL时,对PC12细胞均无明显的损伤作用,哈尔满则对PC12细胞有较为明显的损伤作用。不同样品对H2O2诱导的PC12细胞氧化损伤结果如图4-b所示,与H2O2诱导组相比,骆驼蓬碱、去氢骆驼蓬碱、去甲哈尔满、种子总浸膏和全草总浸膏在20 μg/mL质量浓度下,对H2O2诱导的PC12细胞均具有明显保护作用(<0.01)。不同样品对6-OHDA诱导的PC12细胞氧化损伤结果如图4-c所示,与6-OHDA模型组相比,去氢骆驼蓬碱、种子总浸膏和全草总浸膏在20 μg/mL下,对6-OHDA诱导的氧化损伤的PC12细胞均具有明显的保护作用(<0.01)。
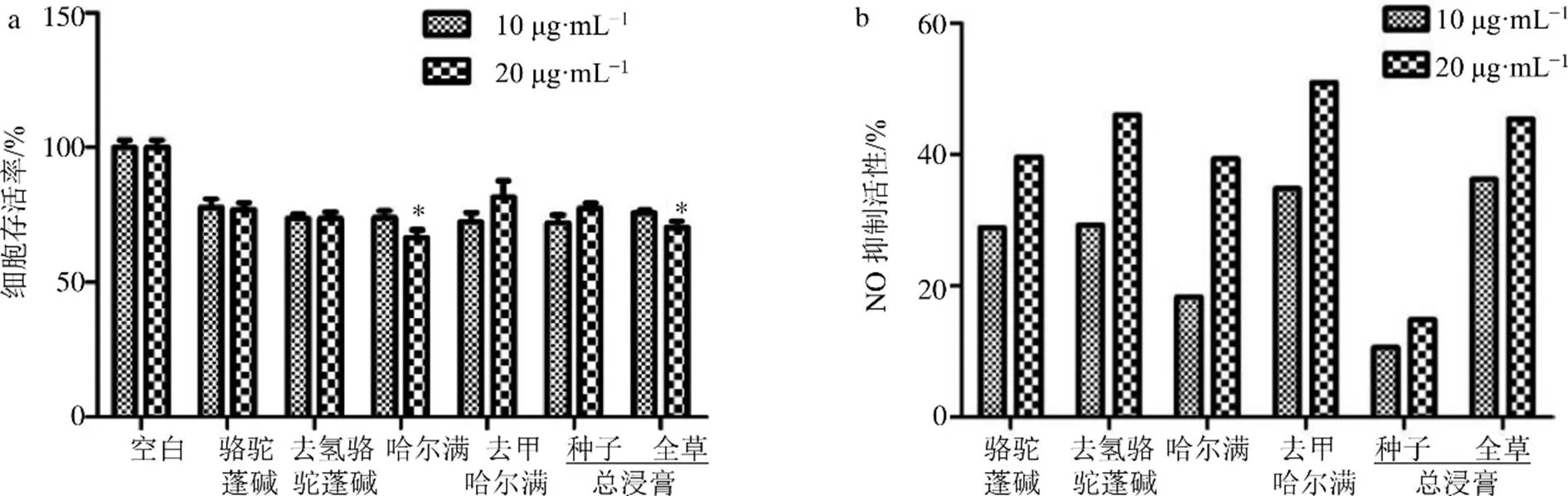
与空白组比较:*P<0.05

与空白组比较:*P<0.05 **P<0.01;与H2O2或6-OHDA诱导组比较:ΔΔP<0.01
3 讨论
本研究采用UHPLC-QTOF-MS/MS技术,对骆驼蓬不同部位全草、种子的甲醇提取物分别进行了正、负离子模式的质谱扫描,结果发现,其中主要的生物碱类化学成分在正离子模式下的响应优于负离子模式,筛选的化合物数量更多,故主要对正离子模式下采集的二级质谱数据中化合物成分进行了分析。从骆驼蓬样品中共鉴别出32个化学成分,巴基斯坦和中国产骆驼蓬全草,以及骆驼蓬全草和种子间的成分存在差异。全草中主要含鸭嘴花醇、脱氧鸭嘴花碱等喹唑酮类生物碱,而种子中主要含有去氢骆驼蓬碱、骆驼蓬碱等β-咔啉类生物碱,这与文献报道一致[25]。结果证实骆驼蓬提取物及部分β-咔啉类化合物在细胞水平上具有一定的神经保护活性。但也有研究表明β-咔啉类生物碱对PC12细胞能够产生细胞毒作用,且其细胞毒性作用机制与2、9位的甲基化具有一定的相关性[26]。骆驼蓬种子提取物、骆驼蓬碱、去氢骆驼蓬碱及去甲哈尔满对LPS诱导的BV2细胞炎症因子NO的生成具有抑制作用,但是哈尔满和全草总浸膏在20 μg/mL有一定的细胞毒性。张晓双等[27]研究表明骆驼蓬总生物碱可通过上调海马突触素(synaptophysin,syn)、微管相关蛋白-2(microtubule-associated protein-2,MAP-2)蛋白表达,并且抑制一氧化氮合酶活性,改善血管痴呆性大鼠的学习记忆能力。
本研究建立的骆驼蓬化学成分分析的液质方法,有助于了解骆驼蓬不同药用部位生物活性成分及其神经保护活性。然而,由于种子中2种主要的生物碱骆驼蓬碱和去氢骆驼蓬碱的含量较高且结构相近, 通过优化梯度条件、改变柱温等而未能将其分开。此外,骆驼蓬具有神经保护活性和神经毒性更深层次的机制仍需通过更多的实验进一步论证。综上所述,本研究为骆驼蓬的质量控制及药效物质基础研究提供了一定的参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国科学院中国植物志编辑委员会. 中国植物志 (第43卷) [M]. 北京:科学出版社, 1997: 123.
[2] 赵婷, 王长虹, 王峥涛. 骆驼蓬属植物中生物碱类化学成分及其药理活性研究进展 [J]. 国际药学研究杂志, 2010, 37(5): 333-339.
[3] 张凯雪, 包芳, 杨志刚. 巴基斯坦药用植物资源 [J]. 亚太传统医药, 2019, 15(2): 1-8.
[4] 刘勇民. 中国民族药志(第1卷) [M]. 北京: 人民卫生出版社, 1984: 369-373.
[5] 何丹丹, 张磊, 刘力, 等. 骆驼蓬子总生物碱改善小鼠学习记忆能力 [J]. 中成药, 2015, 37(3): 478-482.
[6] 张晓双, 孙建宁, 于慧灵. 骆驼蓬总碱对血管性痴呆大鼠学习记忆的影响 [J]. 中药材, 2015, 38(11): 2353-2357.
[7] Yang Y D, Cheng X M, Liu W,. Potent AChE and BChE inhibitors isolated from seeds ofLinn by a bioassay-guided fractionation [J]., 2015, 168: 279-286.
[8] Herraiz T, González D, Ancín-Azpilicueta C,. Β-Carboline alkaloids inand inhibition of human monoamine oxidase (MAO) [J]., 2010, 48(3): 839-845.
[9] 徐天润, 刘心昱, 许国旺. 基于液相色谱-质谱联用技术的代谢组学分析方法研究进展 [J]. 分析测试学报, 2020, 39(1): 10-18.
[10] 李娜, 李圣坤, 张前亮, 等. 骆驼蓬中主要生物碱的电喷雾多级质谱裂解行为研究 [J]. 西北大学学报: 自然科学版, 2013, 43(6): 909-911.
[11] 高简, 张亚丽, 苗祥贞, 等. 基于LTQ-orbitrap高分辨质谱的骆驼蓬子中生物碱类成分鉴定及裂解途径分析 [J]. 质谱学报, 2017, 38(1): 89-96.
[12] Wang Z Y, Kang D, Jia X,. Analysis of alkaloids fromL. sequential extracts by liquid chromatography coupled to ion mobility spectrometry [J]., 2018, 1096: 73-79.
[13] Wang K B, Li D H, Bao Y,. Structurally diverse alkaloids from the seeds of[J]., 2017, 80(2): 551-559.
[14] Wang K B, Hu X, Li S G,. Racemic indole alkaloids from the seeds of[J]., 2018, 125: 155-160.
[15] 樊峥嵘, 姚新生. 骆驼蓬属()植物成分及药理作用 [J]. 沈阳药学院学报, 1992, 9(2): 144-151.
[16] 环斅涵, 李曼琳, 邢建国, 等. 基于色谱-质谱联用技术的复方木尼孜其颗粒化学成分分析与鉴定 [J]. 中成药, 2021, 43(5): 1366-1375.
[17] Lamchouri F, Toufik H, Elmalki Z,. Quantitative structure-activity relationship of antitumor and neurotoxic β-carbolines alkaloids: Nine harmine derivatives [J]., 2013, 39(5): 2219-2236.
[18] Deng G, Liu W, Ma C,.andmetabolism and pharmacokinetics of cholinesterase inhibitor deoxyvasicine from aerial parts ofLinn in rats via UPLC-ESI-QTOF-MS and UPLC-ESI-MS/MS [J]., 2019, 236: 288-301.
[19] Zhu Y P, Fei Z, Liu M C,. Direct one-pot synthesis of luotonin F and analogues via rational logical design [J]., 2013, 15(2): 378-381.
[20] 李越鲲. 骆驼蓬地上部分化学成分的研究 [D]. 杨凌: 西北农林科技大学, 2005.
[21] Li S, Cheng X, Wang C. A review on traditional uses, phytochemistry, pharmacology, pharmacokinetics and toxicology of the genus[J]., 2017, 203: 127-162.
[22] Orihuela R, McPherson C A, Harry G J. Microglial M1/M2 polarization and metabolic states [J]., 2016, 173(4): 649-665.
[23] 王蕾, 李鹏飞, 李帆, 等. 失笑散降低氧糖剥夺再灌注BV2细胞损伤及NLRP3的表达[J]. 世界中医药, 2021, 16(24): 3601-3605.
[24] Deumens R, Blokland A, Prickaerts J. Modeling Parkinson’s disease in rats: An evaluation of 6-OHDA lesions of the nigrostriatal pathway [J]., 2002, 175(2): 303-317.
[25] 王长虹, 刘军, 郑立明, 等. 不同产地骆驼蓬不同药用部位中生物碱的含量分析 [J]. 中国药学杂志, 2002, 37(3): 211-215.
[26] Cobuzzi R J Jr, Neafsey E J, Collins M A. Differential cytotoxicities of-methyl-beta-carbolinium analogues of MPP+ in PC12 cells: Insights into potential neurotoxicants in Parkinson’s disease [J]., 1994, 62(4): 1503-1510.
[27] 张晓双, 孙建宁, 郭洁, 等. 骆驼蓬总碱对血管性痴呆大鼠学习记忆的研究 [J]. 中药药理与临床, 2015, 31(4): 75-78.
Chemical constituents inbased on UHPLC-QTOF-MS/MS and its neuroprotective activities
WANG Ning-ning1, WEI Guan-hua1, ZHANG Zhi-jun1, FANG Jian-guo2, Mohammad Umar Farooq3, Imtiaz Ahmad Qamar3, LIU Ying-qian1, YANG Zhi-gang1
1. School of Pharmacy, Lanzhou University, Lanzhou 730000, China 2. School of Chemistry and Chemical Engineering, Lanzhou University, Lanzhou 730000, China 3. Pakistan National Agricultural Research Center, Islamabad , Pakistan
To analyze the chemical constituents ofbased on UHPLC-QTOF-MS/MS and explore its possible neuroprotective activities.The chromatographic column was ACQUITY UPLC BEH C18(100 mm×2.1mm, 1.6 μm). The mobile phase consisted of 0.1% formic acid aqueous solution (A) and 0.1% formic acid acetonitrile solution (B), followed by gradient elution. Volume flow was 0.3 mL/min; The injection volume was 2 μL. Column temperature was 35 ℃. The mass spectrometry system used electrospray ion source (ESI), which was detected in positive ion mode. Then, the oxidative damage model induced by H2O2and 6-OHDA in PC12 cells and the BV2 neuroinflammation model induced by LPS were established. The extracts of the aerial parts and seeds of, and the four main alkaloids of harmine, harmaline, harman and norharman, were investigated on their neuroprotective activities.A total of 32 chemical constituents were identified from. The aerial parts mainly contained quinazolone alkaloids, such as peganol and deoxypeganine, while the seeds mainly contained β-carboline alkiods, such as harmine and harmaline. The methanol extracts from the aerial parts, seeds and four main alkaloids showed certain inhibitory activity on NO production in BV2 cells stimulated by LPS. They also had obvious protective effects on PC12 cells induced by H2O2and 6-OHDA (< 0.01).The alkaloid components in the aerial parts and the seeds are quite different, and the alkaloid compounds have certain neuroprotective effects. This study provides some reference for the quality control and the basic research of pharmacological substances of.
L.; UHPLC-QTOF-MS/MS; alkaloids; neuroprotective activity; harmine; harmaline; harman; norharman
R284.1
A
0253 - 2670(2022)06 - 1688 - 09
10.7501/j.issn.0253-2670.2022.06.011
2021-11-23
国家重点研发计划政府间国际科技创新合作重点专项(2016YFE0129000);甘肃省重点研发计划(18YF1WA115);甘肃省自然科学基金项目(20JR5RA311)
王宁宁(1996—),女,硕士研究生,主要从事中药药效物质基础及代谢组学研究。Tel:18095859563 E-mail: wangnn19@lzu.edu.cn
杨志刚,副教授,主要从事中药药效物质基础及代谢组学研究。Tel: (0931)8915202 E-mail: yangzg@lzu.edu.cn
[责任编辑 王文倩]
