精神分裂症共病代谢综合征的相关因素研究进展*
2022-03-20刘彦丽张伟波何思源
刘彦丽 张伟波 何思源 蔡 军
精神分裂症(Schizophrenia)是一种以妄想、幻觉、精神活动与环境的不协调等为特征的严重精神障碍[1]。该病病程迁延、致残率高,研究显示,精神分裂症导致的潜在寿命损失年数平均为14.5年[2],患者的首要死亡原因是心血管疾病[3],而代谢综合征(Metabolic Syndrome,MS)与精神分裂症患者心血管疾病的高患病率密切相关。因此,了解精神分裂症共病MS的相关因素有助于识别MS高危人群,开展早期干预,对减少精神分裂症患者MS的患病率、降低其死亡率具有重要意义。下面就精神分裂症患者共病MS的患病率以及相关因素的研究进展进行综述。
1 精神分裂症共病MS
1.1 MS概述 MS是一组以肥胖、糖尿病或糖调节受损、血脂异常以及血压升高等多种危险因素聚集为特征的临床症候群[4]。自世界卫生组织(WHO)于1999年制定了MS的诊断标准后[5],国际上各个学术组织先后发布了一系列不同的定义和诊断标准,研究中应用较多的包括美国国家胆固醇教育纲要-成人教育组第3次报告(NCEP-ATPⅢ)于2001年提出的诊断标准[6]以及国际糖尿病联盟(IDF)于2005年提出的诊断标准等[7]。对于中国人群,中华医学会糖尿病学分会(CDS)根据国内调查结果于2004年提出了CDS标准[8],并于2013年进行修订[9]。目前各个地区对MS的诊断标准存在着同一性,即均以肥胖、血脂紊乱、高血压、高血糖等作为测定指标,但各个学术组织对肥胖的定义并不相同,血压、血糖、血脂等指标的诊断切点也有所差异。其中,WHO对MS的工作定义对各国家、各种族人群都具有指导作用,但该标准所需投入较大。NCEP-ATPⅢ是根据美国实际情况制定,在其他人群中MS检出率则较低[10]。IDF标准是基于WHO和ATPⅢ标准、经国际专家充分讨论得出的全球共识,该标准强调了中心性肥胖在MS诊断中的重要性[11],并建议采取人种特异性的腰围标准。随后,CDS(2013)也基于中国人群肥胖程度轻、肥胖类型多为中心性肥胖的临床特征,将中心性肥胖的诊断切点由CDS(2004)的身体质量指数(BMI)调整为腰围参数,更适合于中国人群。见表1。
共病(Comorbidity)是指两种疾病同时存在,并且均符合各自相应的诊断标准。研究显示,MS已经成为精神分裂症患者面临的主要挑战,它不仅会损害精神分裂症患者的躯体健康,增加其罹患心血管疾病的风险,进而导致精神分裂症患者死亡率的增加,也对其精神健康带来负面影响。众多研究表明,MS可能加重精神分裂症患者的精神病性症状[12],还可能增加其疾病复发的风险[13]。此外,MS还影响着精神分裂症患者的预后,不仅体现在较差的社会功能和生活质量方面[14,15],MS还可能对其认知功能造成损害[16,17]。
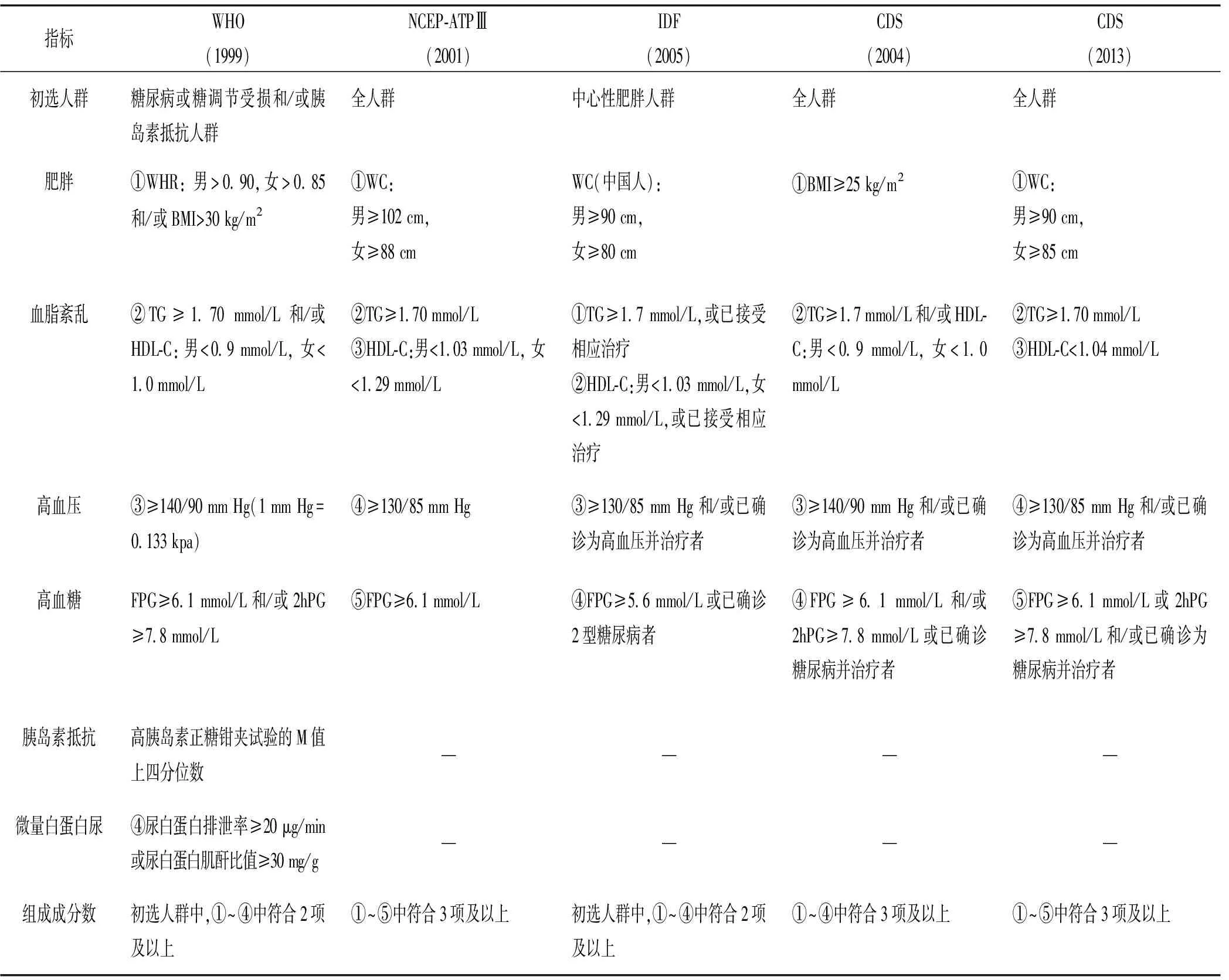
表1 MS诊断标准比较
1.2 精神分裂症患者MS的患病率 既往研究显示,不同地区的精神分裂症患者的MS患病率各不相同,这可能是由于各研究采用的MS诊断标准不同、研究对象处于不同的疾病阶段或者接受不同抗精神病药物治疗等。国外一项荟萃分析表明,精神分裂症患者MS的总患病率约为32%[18],是普通人群的2~3倍[19]。马来西亚一项关于首发精神分裂症患者的十年回顾性队列研究显示,36.2%的研究对象在被诊断为精神分裂症10年后患有代谢综合征[20]。法国的一项队列研究(FACE-SZ)显示法国社区精神分裂症患者的MS检出率则处于较低水平,在为期1年的随访中,精神分裂症患者MS的患病率从21.0%上升到了26.6%[21]。我国目前关于精神分裂症患者MS的研究相对零散,多为单中心、横断面调查,尚缺乏针对精神分裂症患者MS的流行病学调查。叶飞英等[22]通过调查广东省惠州市683例住院精神分裂症患者发现,MS的患病率为28.1%。安徽省六安市一项针对773例住院精神分裂症患者的研究显示的患病率则相对较高,有40.8%的患者共病MS[23]。杨杰等[24]针对河北省唐山市某医院门诊和住院患者的调查结果显示出的MS患病率处于中间水平,为35.8%。在排除服用抗精神病药物的影响后,精神分裂症患者MS的患病率相对较低,但仍高于一般人群,Lang XE等[25]通过在山西某医院和北京某医院招募首发未服药精神分裂症患者(n=430),并设置健康对照(n=543),结果显示,首发未服药精神分裂症患者的MS患病率(19.1%)高于对照组(6.6%)。
2 精神分裂症共病MS的相关因素
目前关于精神分裂症患者MS发生发展的潜在机制尚不清楚。国内外学者仍在广泛探究精神分裂症患者MS的相关因素,主要包括遗传因素、社会人口学因素、疾病因素和生活行为方式等方面。
2.1 遗传因素 精神分裂症和MS都具有疾病本身的复杂性,病因与发病机制都尚不完全清楚,二者共病的遗传因素研究也更为复杂。最近的研究表明,精神分裂症和MS可能存在共同的遗传倾向和遗传途径[25]。精神分裂症共病MS至少可以部分归因于共同的遗传变异,精神分裂症通路的功能障碍可能对机体代谢产生影响,进而导致MS[26]。Malan-Müller S等[27]在2016年发表的一篇系统综述纳入2007~2015年的34项研究,结果显示亚甲基四氢叶酸还原酶(Methylenetetrahydrofolate Reductase, MTHFR)基因、脂肪量和肥胖相关(Fat Mass and Obesity-Associated, FTO)基因、5-羟色胺2C受体(Serotonin Receptor 2C, HTR2C)基因、瘦素(Leptin, LEP)及其受体(Leptin Receptor Genes, LEPR)基因都与精神分裂症患者共病MS相关。国内张理强等[28]的研究结果也发现,血浆纤溶酶原激活物抑制物-1(PAI-1)基因在-675位点处的4G/4G基因型是精神分裂症患者伴发MS的危险因素。Enez DA等[29]的一项病例对照研究通过纳入精神分裂症患者(n=102)及患者同胞(n=64)、年龄匹配的健康对照(n=70),发现精神分裂症患者及其同胞都是MS的高危人群,而不依赖抗精神病药物的影响,这进一步证实了MS的发生与遗传因素有关。
2.2 社会人口学因素 许多学者试图研究精神分裂症患者共病MS的社会人口学因素,主要包括性别、年龄、婚姻状况、受教育程度等方面。然而,目前仍未有确切的社会人口统计学变量成为MS的一致预测因子。
2.2.1 性别 在性别方面,目前研究关于性别的探讨结论尚不一致。大部分研究认为,与男性相比,女性精神分裂症患者MS的患病率更高[23,30~35]。也有少部分研究得出了相反的结论,Chen S等[36]针对北京回龙观医院住院部精神分裂症患者的初步调查显示,男性可能与首发精神分裂症患者较高的代谢风险相关,这与Pillinger T等[37]的研究结果一致。但也有不少研究结果显示,患MS与不患MS组的精神分裂症患者之间并无性别差异[18,38~42]。
2.2.2 年龄 在普通人群中,学者们发现MS与年龄的关系几乎已成为事实,其患病率随着年龄的增长而增加。然而,与普通人群相比,精神分裂症患者的MS患病率随着年龄的增长而升高的风险更大[43]。国内外大多数研究表明,年龄较大是精神分裂症患者共病MS的危险因素[34,35,44,45]。国内一项研究[23]结果显示,精神分裂症患者中MS的患病率较一般人群要高,尤其是年龄大的患者,>50岁的患者的患病率(54.5%)高于<30岁(37.4%)和30~50岁(40.1%)的患者。Vancampfort D等[39]也发现,与一般人群和早期精神分裂症患者的研究数据一致,年龄的增长是MS的关键预测因素,当年龄和病程进入同一模型时,年龄是更重要的决定因素。然而,这也可能是由于与年龄数据相比,病程的可用数据有限。也有少部分研究认为MS与年龄无关[40,41]。
2.2.3 婚姻状况及受教育程度 目前针对婚姻状况、受教育程度等其他社会人口学因素的研究相对于性别和年龄较少,结论也尚不一致。此前有研究报道,MS的患病率在已婚精神分裂症患者人群中更为常见[35],但也有研究发现,精神分裂症共病MS与婚姻状况无关[45]。在受教育程度方面,土耳其的一项研究显示,与不伴MS的精神分裂症患者相比,共病MS的患者受教育程度更低[44]。部分研究则认为,精神分裂症患者的MS患病率与更高的受教育水平相关[46]或与受教育程度无关[45]。
2.3 疾病因素
2.3.1 精神分裂症患者的临床特征 不同亚型的精神分裂症患者MS患病率存在差异,Lang XE等[47]通过对早发型(n=116)和晚发型(n=373)精神分裂症患者进行调查,发现早发型患者的MS发生率(9.5%)低于晚发型患者(13.9%)。未治疗期(Duration of Untreated Psychosis,DUP)是指从精神病症状发作到首次服用足够的抗精神病药物的时间。研究发现,共病MS的精神分裂症患者可能存在更长的DUP[44]。病程长短也是精神分裂症患者共病MS的重要影响因素[18,44,48]。一项纵向研究显示,对首发精神疾病患者而言,最初几个月的治疗是体质量增加和MS发生的关键期,精神分裂症患者通常在接受治疗的第一年体质量和腰围迅速增加,随后逐渐稳定[49]。首发精神分裂症患者MS的发病率较低,病程较长的患者则更易罹患MS[28,31,35,41,50],病程>10年的患者的患病率(47.2%)高于病程<5年(36.0%)和5~10年的患者(37.9%)[23]。但此时疾病严重程度及多种精神药物的使用可能是其中的混杂因素,因此也有研究认为病程长短并非精神分裂症共病MS的影响因素[35,40,45]。
2.3.2 抗精神病药物的使用 尽管目前已经有许多研究表示,精神分裂症本身对MS的影响并不依赖于抗精神病药物的暴露[25],但抗精神病药物的使用对精神分裂症患者的代谢不良反应几乎已经成为共识。Jaberi N等[51]的研究表明,精神分裂症患者在接受抗精神病药物治疗6个月后,MS的患病率从一开始的5%增加到了27%。国内外许多研究也都显示,服用抗精神病药物的患者MS的发生率比首发精神病患者或未服药患者更高[39,52]。这可能是因为抗精神病药物在缓解精神病性症状的同时,也会产生包括胰岛素抵抗、糖耐量受损[53]、血脂异常和体质量增加等在内的一系列代谢不良反应[51],增加了精神分裂症患者罹患MS的风险。抗精神病药物的不良反应越大,精神分裂症患者越容易罹患MS[40]。而不同抗精神病药物的代谢不良反应存在着差异,研究显示,第二代抗精神病药比第一代抗精神病药更易引起MS[54~56]。接受第二代抗精神病药物治疗的患者(40%)MS的发生率约为接受第一代抗精神病药物(18%)治疗的患者的两倍[57]。Scaini G等[58]的研究发现,第二代抗精神病药物可诱导线粒体功能障碍和细胞损伤。因此,线粒体功能的异常可能是部分精神分裂症患者中MS患病率高于普通人群的潜在原因。具体来看,在第一代抗精神病药物中,以氯丙嗪的代谢不良反应最为突出;在第二代抗精神病药物中,则以氯氮平和奥氮平的不良反应最为严重[18,35,37,56],使用氯氮平的患者MS患病率约为51.9%[18],而长期使用奥氮平治疗的精神分裂症共病MS发生率约为44.0%[59]。喹硫平、利培酮、阿塞那平和氨磺必利的不良反应程度适中,而包括齐拉西酮、鲁拉西酮在内的新药代谢不良反应则相对较小,但与氯氮平相比,它们的整体临床疗效则较差[56]。
2.4 生活行为方式 由于精神疾病本身的影响、个体心理社会因素以及社会的歧视与偏见,精神分裂症患者的健康促进行为水平普遍不高[60],而相对于普通人群更容易选择不健康的生活行为方式,包括久坐、吸烟、不良的饮食结构等,这会增加其罹患MS的风险。
2.4.1 久坐行为(Sedentary Behavior,SB)与体力活动 与一般人群相比,精神分裂症患者由于阴性症状、疼痛和药物不良反应等因素,更倾向于久坐不动[61]。SB是指人在清醒状态下保持坐姿或躺姿等身体状态时,其能量消耗不超过1.5 METs(Metablic Equivalent,代谢当量)的身体活动,包括睡觉、坐下、躺下、看电视和其他形式的屏幕娱乐等[62]。Vancampfort D等[61]的研究显示,精神分裂症患者平均每天静坐8.5 h(健康对照组为6.21 h),静坐时间每增加1 h,其罹患MS的风险就增加2.33倍(95%CI=1.37~3.96,P=0.002)。在体力活动(Physical Activity, PA)方面,研究发现精神分裂症患者的中高强度体力活动(Moderate to Vigorous Physical Activity,MVPA)明显减少[63],而缺乏体力活动是MS的重要相关因素[20]。但也有研究显示二者并不相关,Yoca G等[40]将147例可计算体力活动的精神分裂症患者分为3组,分别为非活动组(n=47)、中等活动组(n=82)和健康增强体力活动(Health Enhancing Physical Activity,HEPA)组(n=20),最终结果显示体力活动水平与MS无关,这可能是由各组患者分布情况不同等因素造成的影响,有待更进一步的研究。
2.4.2 吸烟 吸烟在精神分裂症患者中很常见,与普通人群(33%)相比,严重精神障碍患者的吸烟率(约61%)更高,且其戒烟率更低[64]。部分研究显示,在精神分裂症患者中,吸烟者罹患MS的风险更大[25,32,35,65]。一项基于中国汉族人群的大样本研究显示[66],首发未服药精神分裂症患者的吸烟率(23.8%)高于对照组的吸烟率(14.0%),在校正混杂变量后,吸烟患者的MS患病率高于非吸烟患者。但也有许多研究表示,精神分裂症患者中,吸烟组与非吸烟组MS的患病率比较差异并无统计学意义[28,40]。
2.4.3 饮食结构 大部分研究认为不良的饮食结构是精神疾病患者MS风险增加的主要原因,精神分裂症患者个人饮食习惯呈现出饱和脂肪、糖、钠摄入量高,纤维和水果消耗量低的特点,而这种饮食可能增加代谢异常的发生风险,并可能使其他因素(如抗精神病药物治疗、低体力活动、吸烟等)引起的代谢异常进一步恶化[67]。Yoca G等[40]通过获取24 h食物消耗记录确定精神分裂症患者的能量和营养摄入,发现每日添加糖摄入(Daily Added Sugar Intake)与MS的增加有关。Malhotra N等[14]研究发现,精神分裂症患者的MS与平均热量摄入量无关,但MS患者在健康促进生活方式量表(HPLP-Ⅱ)的营养习惯领域得分较低,因此,限制卡路里的数量并非是预防精神分裂症患者MS的唯一重点,还应强调适当的营养和均衡的饮食。
3 小结与展望
目前国内外已经开展了大量有关精神分裂症共病MS的研究,各个地区对MS的定义与诊断标准虽有不同,但一致结论是精神分裂症患者罹患MS风险较普通人群更高。通过了解与精神分裂症共病MS相关的因素,有助于识别高风险人群,对MS的各个组成成分进行积极干预与治疗,进而预防精神分裂症患者心血管疾病以及2型糖尿病的发生。在精神分裂症共病MS的相关因素上,国内外学者在遗传机制、性别、年龄、病程等方面尚未达成共识。目前研究表明,接受抗精神病药物治疗的精神分裂症患者MS的患病率更高,其中以第二代抗精神病药物的代谢不良反应更为明显。对临床工作者而言,未来应注意衡量抗精神病药物潜在的治疗效果与代谢不良反应之间的权重,综合考虑患者的精神疾病病情和躯体健康情况,制定个性化治疗方案。此外,包括久坐、吸烟、不良饮食结构等在内的不健康生活行为方式对精神分裂症患者共病MS的影响也是值得关注的主题,由于精神分裂症患者健康促进行为水平相对较低,针对该群体进行MS管理仍是重大的挑战。
鉴于上述研究现状,亟需明确精神分裂症与MS共病的分子遗传机制和病理生理过程。此外,未来的研究建议扩大样本量、纳入健康对照,在控制混杂变量的基础上通过长期随访研究进一步评估社会人口学因素、疾病因素、生活行为方式因素等对精神分裂症共病MS的影响,从而尽早筛查和发现MS的高危人群,早期针对患者积极开展个性化干预,最大限度降低精神分裂症患者心血管疾病相关的发病率和死亡率。
