艾滋病相关伯基特淋巴瘤10例患者临床特征分析
2022-03-19周奇文陶鹏飞杨翠先王丹青樊珊珊杨开林闵海燕
周奇文,陶鹏飞,钱 川,林 森,杨翠先,王丹青,樊珊珊,杨开林,闵海燕
HIV主要侵犯人体的免疫系统,主要表现为CD4+T细胞数量不断减少,还包括 CD4+T细胞、B细胞、单核巨噬细胞、NK细胞和树突状细胞的功能障碍和异常免疫激活,最终导致人体细胞免疫功能缺陷,引起各种机会性感染和肿瘤的发生[1]。我国推行高效联合抗反转录病毒治疗(highly active antiretroviral therapy, HAART)已经约20年,随着相关HAART药物更迭以及综合、强化的干预措施深入基层,HAART已较为成熟。同时随着我国“三个90%策略”的推进,以及国际、国内“发现即治疗”行动的推行,越来越多的HIV新发感染者成为早发现和早治疗人群,使得AIDS相关机会性感染发生率逐渐下降,HIV感染者长期生存成为可能。未来一段时间内,由于免疫功能紊乱、异常免疫激活导致的以肿瘤为代表疾病将成为影响HIV感染者长期存活的重大威胁。感染科医生对恶性肿瘤特别是血液系统恶性肿瘤认知有限,伯基特淋巴瘤(Burkitt lymphoma, BL)是AIDS相关淋巴瘤中B细胞恶性突变的血液系统恶性肿瘤之一,是恶性程度极高的一种,其临床表现复杂多样,可累及多系统、多部位,但缺乏特异性症状体征,确诊完全依赖于病理检查,使得HIV感染合并该病在早期发现和早诊断方面存在较大困难。提高感染科特别是AIDS诊治的临床医生对BL的认识有重要意义。本文回顾性总结了云南省传染病医院感染二科2004年1月—2020年12月收治住院的10例AIDS相关BL患者的临床资料,分析并总结其临床特征、实验室检查、治疗方案和临床转归。
1 对象与方法
1.1 研究对象 研究对象为云南省传染病医院感染二科2004年1月—2020年12月期间收治住院的10例AIDS相关BL患者。
1.2 诊断及分期 所有患者的AIDS诊断标准及分期均符合《中国艾滋病诊疗指南(2018版)》[1],并经病变部位病理活检或骨髓病理检查诊断为BL。所有确诊AIDS相关BL患者分期参照2014年Lugano分期标准[2],以美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分标准进行体能状况评分,淋巴瘤的类型区分和诊断标准主要依据2017年WHO制定的造血和淋巴组织肿瘤分类标准[3],病情的分组按照患者有无发热、盗汗、体质量下降等症状分为A、B组。
1.3 研究方法 回顾性分析AIDS相关BL患者的临床症状及体征、首发部位、BL确诊时HIV感染情况及HAART情况、治疗方案和临床转归等。
1.4 检测指标 患者外周血CD4+T细胞绝对值计数、乳酸脱氢酶、乙型肝炎和丙型肝炎病毒学检测结果及梅毒抗体、EBV DNA、血β2微球蛋白、骨髓细胞学、骨髓流式细胞免疫荧光分析、骨髓染色体、骨髓活检等。
1.5 评价方法 全部患者均按照2007年修订后的包含正电子发射计算机断层扫描的淋巴瘤疗效标准[4],以末次化疗或放疗结束后行18F-脱氧葡萄糖正电子发射断层显像、MRI、CT等影像学检查评价治疗效果。
2 结 果
2.1 一般情况 10例AIDS相关BL患者中,男女比为9:1;患者年龄21~55岁,平均36.4岁;病程0.5~4.0月,中位病程2.0月。就诊时10例患者CD4+T细胞计数为107~308个/μl,平均225.2个/μl。6例患者接受HAART后0.2~14月BL明确诊断后开始化疗,1例化疗2周后行HAART,仅3例接受HAART与化疗同步。10例患者中6例EBV DNA 阳 性(9.33×103~ 5.85×105copies/ml),3例阴性(<4.00×102copies/ml),1例未做检测。10例患者中有1例合并梅毒,无HBV、HCV混合感染者(表1)。
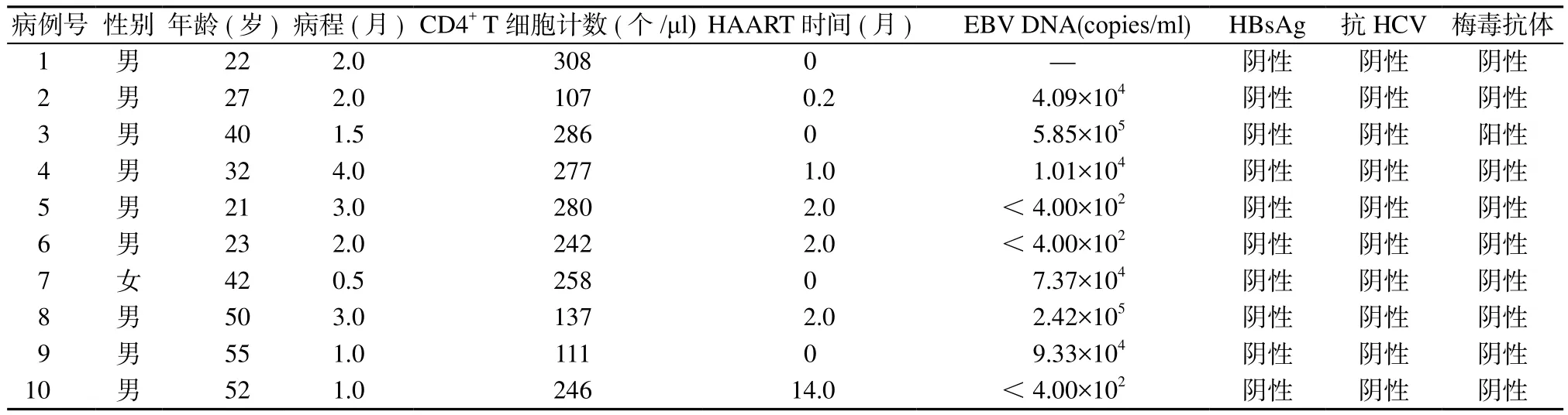
表1 10例AIDS相关BL患者一般资料Table 1 General information of ten patients with AIDS related Burkitt lymphoma
2.2 临床特点 10例患者中,9例因BL相关症状就诊过程中发现HIV-1感染,1例在确诊HIV-1感染并HAART约14月后出现BL相关症状体征。就诊时7例患者以局部肿块为首发症状,1例以血小板减少、阴道大量出血为首发症状,1例以右侧牙龈肿胀为首发症状,1例以乏力、腹泻起病。8例患者出现淋巴瘤相关B组症状,2例合并中枢神经系统侵犯。10例患者ECOG体能状况评分均≥2分。1例患者病情Lugano分期为II期,9例为Ⅳ期;10例危险分层均为高危组。1例患者存在化疗前合并感染,9例乳酸脱氢酶异常(514~5282 U/L),平均为1984.6 U/L,5例化疗前骨髓检查提示有肿瘤细胞骨髓侵犯,3例行病理组织淋巴瘤基因3项检查均检出c-myc/IgH基因融合,未检出Bcl-2和Bcl-6基因易位。8例患者行β2微球蛋白检测,结果均异常(2102 ~ 22 965.95 μg/ml),平均为 5875.12 μg/ml。
2.3 治疗方案和临床转归 3例患者接受化疗联合抗病毒治疗获得完全缓解(complete remission,CR),1例接受化疗联合抗病毒治疗序贯造血干细胞移植(hematopoietic stem cell transplantation,HSCT)后获得CR;1例化疗后骨髓抑制继发大肠埃希菌败血症、感染性休克死亡;1例合并中枢侵犯,第1周期化疗尚未完成即死亡;2例难治性病例在初治时未使用类似R-Hyper-CVAD为主的强化疗方案,后期因疾病进展使用高强度方案化疗效果不佳,即使进行异基因HSCT仍死于HSCT相关并发症;2例化疗效果不佳,病情进展,自动出院后分别在1周、1月后死亡(电话随访)。化疗期间10例患者中9例出现骨髓抑制IV度,1例第1周期化疗尚未结束即死亡,未监测到骨髓抑制发生;5例在骨髓抑制期间出现一种或多种病原菌继发感染。10例患者生存时间为0.2~82月,中位生存时间为9.0月。见表2。

表2 10例AIDS相关BL患者的治疗方案和临床转归Table 2 Treatment regimens and clinical outcomes of ten patients with AIDS related Burkitt lymphoma
3 讨 论
HIV感染人体后,因病毒复制和病毒感染后造成机体长期慢性炎性损伤、异常免疫激活,以及引起细胞免疫功能低下和机体免疫系统功能紊乱,导致免疫识别和免疫监视功能异常,对各种肿瘤相关病毒如EBV或人类8型疱疹病毒易感性增加,是易患各种恶性肿瘤,特别是血液系统恶性肿瘤高发的主要原因之一。BL是一种高度恶性的B细胞淋巴瘤,作为免疫细胞恶性突变的血液系统恶性肿瘤中的一类,被WHO定义为7个AIDS相关性淋巴瘤(AIDS related lymphoma,ARL)之一[5]。Polesel等[6]对 1991—2002 年 57 350例AIDS患者研究发现,AIDS 患者并发非霍奇金淋巴瘤风险明显高于普通人群,其中BL为普通人的15 倍。2001—2007年,因开展HAART治疗,发病率较前有所改变,但BL仍最常见,达每10万人年32例[7],提示有效HAART能降低ARL患病率,但AIDS相关BL发病率仍较高。本研究中仅有1例患者为诊断AIDS并接受HAART后14月出现BL症状体征,其余患者均为出现BL相关症状体征就诊过程中发现HIV感染,以上特点提示未接受HAART人群出现BL情况比HAART患者更多见。
本研究10例AIDS相关BL患者中,男性多于女性,患者年龄跨度大,但以22~42岁人群为主,病程2~16周,有高乳酸脱氢酶和β2微球蛋白水平及高EBV感染率。该组患者临床症状以局部肿块为主,并存在牙龈肿大、阴道出血、腹泻等多系统病变症状,极易与AIDS患者常见机会性感染如结核病、真菌感染等混淆,提示其临床表现特异性不强;且大部份患者诊断时为BL IV期高危组伴体能状况差,常伴随有B组症状,提示诊断时多为BL病程晚期。其中2例患者合并中枢神经系统侵犯,5例化疗前骨髓检查提示有肿瘤细胞骨髓侵犯,3例行病理组织淋巴瘤基因三项检查时均检出c-myc/IgH基因融合,表现出更强侵袭性。有2例患者存在化疗前合并细菌性脓毒血症和梅毒,且10例CD4+T细胞计数均低达350个/μl以下,存在中重度免疫缺陷,提示该组人群均为HIV感染病程中晚期,病情较为复杂。6例死亡患者中,5例死于淋巴瘤疾病进展晚期(难治),1例死于化疗后骨髓抑制大肠埃希菌败血症,该结果与闵海燕等[8-9]报道的ARL患者死亡原因依次为难治(70.6%)、感染(17.6%),且治疗过程中合并细菌性败血症以大肠埃希菌为主等情况基本一致。
BL分为3种不同的流行病学亚型,即地方性、散发性和免疫缺陷相关性,免疫缺陷相关性BL主要患者群为HIV感染者,少数为其他免疫缺陷患者(包括器官移植患者)[10]。EBV感染被认为是参与了多种淋巴瘤的发病过程,特别是在ARL人群中[11]。对于BL,地方性BL 100%与EBV相关,散发性BL及免疫缺陷相关性BL有25%~40%与EBV感染相关[10]。研究发现,在大多数EBV阳性的BL患者中,EBV编码核心抗原-1(EBV-encodednuclear antigens-1, EBNA-1)和膜蛋白类脂-1均高表达,由于EBNA-1结构中具有重复甘-丙氨酸序列,可阻止受染细胞与抗原加工相关转运物结合,影响抗原提呈,抑制了细胞毒性T细胞杀伤靶细胞的作用,从而引起BL[12]。除此之外,免疫缺陷相关性BL的发病机制也包括HIV-1对MYC基因表达的抑制解除和MYC基因和IgH基因组的易位及TP53和MYC基因的点突变[12]。目前研究认为c-MYC原癌基因易位于强启动子附近,导致该原癌基因过度表达,发生克隆性扩增,致使肿瘤细胞的倍增时间缩短为数小时,若不采取治疗病情会迅速进展且致命,虽然BL对强化联合化疗高度敏感,但若肿瘤复发,则几乎全部患者都将死亡,这就更加说明初始强化治疗的重要性[13]。本研究中10例患者均为HIV-1感染者,均为免疫缺陷相关性BL人群,检测9例中有6例EBV阳性,EBV阳性率达66.67%,与相关报道25%~40%不一致,考虑与本研究样本均为HIV感染和数量较少相关。该组10例患者,3例行c-myc检测均为阳性,且均为该组复发难治和死亡人群。
《中国艾滋病诊疗指南(218版)》[1]指出,HIV/AIDS相关肿瘤诊治不应因感染HIV而降低要求,应提倡多学科合作诊治模式的应用,包括血液/肿瘤学、传染病学、医学影像学、外科、药学、介入科等专家一同制定最优个体化综合治疗方案。《AIDS相关性淋巴瘤诊治专家共识》[14]也提出AIDS相关BL化疗推荐方案为R-DA-EPOCH和R-Hyper-CVAD,如果患者CD4+T细胞计数<50个/μl,使用利妥昔单抗可能会增加感染并发症的风险,故不推荐使用。本研究中患者CD4+T细胞计数水平均>100 个/μl,且均为CD20阳性并使用了利妥昔单抗,同时均按照当时国际、国内指南给予标准化治疗方案(除1例较早期患者使用CHOP/R-CHOP/EPOCH外,其余9例均使用以R-Hyper-CVAD为主的化疗治疗),期间均未观察到利妥昔单抗增加患者死亡风险,支持利妥昔单抗对AIDS相关BL人群CD4+T细胞计数>50个/μl者使用的安全性和有效性。在难治性死亡的6例患者中,2例难治性病例在初治时未使用类似R-Hyper-CVAD为主的强化疗方案,后期因疾病进展使用高强度方案化疗效果不佳,即使进行异基因HSCT仍死亡,提示该病恶性程度较高,治疗较困难。有研究显示,成人BL患者接受化疗后2年和5年总生存率为50%~65%,合并骨髓或中枢神经系统受累后下降至约30%[15]。本研究中10例患者中存在骨髓侵犯5例,且经积极综合治疗后达到CR为4例,其中生存期大于5年者2例,在该组中骨髓侵犯1人,占该组病例1/2,与总病例数骨髓侵犯比例一致。另2例达CR患者现生存期分别为10月、14月,且存在骨髓侵犯1人,占比与总病例数骨髓侵犯比例一致。该研究统计10例患者总CR情况为4/10,且存在骨髓侵犯和无骨髓侵犯CR患者均为2/5与总体情况一致。该组患者CR情况与相关报道存在一定差异,考虑与病例数少以及存在骨髓侵犯比例高相关。
综上所述,AIDS相关BL临床表现复杂多样且缺乏特异性,病情进展迅速,易出现多部位侵犯,且所有患者在确诊时均已处于AIDS及BL晚期,治疗预后均较差。故AIDS或HIV感染者出现肿块、血液系统病变和发热、乏力、盗汗、体质量下降等情况时,除考虑机会性感染外,应及时完善乳酸脱氢酶、EBV DNA、血β2微球蛋白、骨髓细胞学等检查,及早明确诊断。诊断明确后应及时启动类似R-Hyper-CVAD为主的高强度初始强化治疗,并积极同步抗病毒治疗,高危组患者有条件者应行HSCT等联合多学科制定最优个体化综合治疗方案,这可能对提高患者生存期有帮助。血液/肿瘤学专科医生和HIV/AIDS感染管理专科医生对AIDS相关BL需提高认识和警惕,而AIDS相关BL的早诊断尤为重要。
