硬脂酰辅酶A去饱和酶1基因表达对草原安格斯牛血液脂肪酸组成的影响
2022-03-19王圆圆李新淼HESHUOTEMailisi白玉廷包音都古荣·金花呼格吉勒图侯荣伦薛强敖日格勒
王圆圆 李新淼 HESHUOTE Mailisi 白玉廷 包音都古荣·金花 呼格吉勒图 侯荣伦 薛强 敖日格勒

摘 要:研究硬脂酰輔酶A去饱和酶1(stearoyl-coenzyme A desaturase 1,SCD1)基因表达对草原安格斯牛血液脂肪酸组成的影响,采集38 头平均体质量(698±34) kg、48 月龄草原安格斯牛血液样品,测定其脂肪酸组成与含量,采用实时荧光定量聚合酶链式反应测定SCD1基因表达量,一代测序技术检测SCD1基因在C878T位点的突变对实验牛血液脂肪酸组成的影响,分析SCD1基因表达与脂肪酸组成间的相关性。结果表明:血液样品中共测得36 种主要脂肪酸,饱和脂肪酸(saturated fatty acids,SFA)以棕榈酸(C16:0)和硬脂酸(C18:0)为主,含量分别达22.53%和26.95%,单不饱和脂肪酸(monounsaturated fatty acids,MUFA)中油酸(C18:1 n-9c)含量最高(15.09%);由SCD1基因表达与脂肪酸组成的显著性分析结果可知,SCD1基因表达对肉豆蔻酸(C14:0)、肉豆蔻油酸(C14:1)、C16:0、棕榈油酸(C16:1)、C18:0、C18:1 n-9c、亚油酸(C18:2 n-6c)、MUFA和MUFA/SFA以及C14指数、C18指数、脂肪酸总不饱和指数和伸长指数均影响显著;相关性分析结果显示,SCD1基因表达量与C16:0、C16:1、C18:0、C18:1 n-9c和MUFA含量均呈正相关;SCD1基因在878位点处出现了C/T突变,有CC、TT和CT 3 种基因型,不同基因型与脂肪酸组成之间均无显著相关性。综上所述,草原安格斯牛血液中的SCD1基因表达对其脂肪酸组成具有调控作用,可作为遗传标记参考基因。
关键词:草原安格斯牛;血液脂肪酸组成;硬脂酰辅酶A去饱和酶1基因表达量;相关性;硬脂酰辅酶A去饱和酶1基因分型
Effects of Stearoyl-Coenzyme A Desaturease 1 Gene Expression on Blood Fatty Acid Composition of Pastured Angus Cattle
WANG Yuanyuan1,2, LI Xinmiao1,2, HESHUOTE Mailisi3, BAI Yuting4, BAOYINDUGURONG·Jinhua1,2,*,
HUGEJILETU5, HOU Ronglun5, XUE Qiang5, AORIGELE5
(1.College of Food Science and Engineering, Inner Mongolia Agricultural University, Hohhot 010018, China; 2.Inner Mongolia Key Laboratory of Biomanufacturing, Hohhot 010018, China; 3.College of Engineering and Applied Sciences, University of Columbia, New York 10027, USA; 4.College of Veterinary, Inner Mongolia Agricultural University, Hohhot 010018, China; 5.Inner Mongolia Hesige Green Industry Import and Export Co. Ltd., Xilingol 026321, China)
Abstract: The purpose of this study was to investigate the effect of stearoyl-coenzyme desaturase 1 (SCD1) gene expression on blood fatty acid composition of Angus cattle raised on pasture. Blood samples of 38 pastured Angus cattle with average body mass of (698 ± 34) kg and at the age of 48 months were collected for fatty acid composition and content determination. The expression of the SCD1 gene was detected by real-time fluorescence quantitative polymerase chain reaction, and the influence of SCD1 gene mutation at C878T on fatty acid composition of blood samples of cattle was detected by first-generation sequencing technology. The correlation between SCD1 gene expression and fatty acid composition was further analyzed. The results showed the presence of 36 main fatty acids in blood samples, with the major saturated fatty acids (SFA) being palmitic acid (C16:0, 22.53%) and stearic acid (C18:0, 26.95%). Oleic acid (C18:1 n-9c) was identified as the most abundant monounsaturated fatty acid (MUFA) (15.09%). The significance analysis indicated that SCD1 gene expression had significant effects on myristic acid (C14:0), myristic acid (C14:1), C16:0, C16:1, C18:0, C18:1 n-9c, linoleic acid (C18:2 n-6c), MUFA and MUFA/SFA ratio as well as C14 index, C18 index, total unsaturation index and elongation index of fatty acids. Additionally, the correlation analysis results suggested that SCD1 gene expression was positively correlated with C16:0, palmitoleic acid (C16:1), C18:0, C18:1 n-9c and MUFA. SCD1 gene exhibited C/T mutation at the 878 site, yielding three genotypes: CC, TT and CT. No significant difference between different genotypes and fatty acid composition was found. Overall, the expression of SCD1 gene in the blood of pastured Angus cattle can regulate its fatty acid composition and thus can be used as a reference gene for genetic markers.
Keywords: pastured Angus cattle; blood fatty acid composition; stearoyl-coenzyme A desaturase 1 gene expression level; correlation; stearoyl-coenzyme A desaturase 1 genotype
DOI:10.7506/rlyj1001-8123-20210603-168
中图分类号:Q786 文献标志码:A 文章编号:1001-8123(2022)02-0009-06
引文格式:
王圆圆, 李新淼, HESHUOTE Mailisi, 等. 硬脂酰辅酶A去饱和酶1基因表达对草原安格斯牛血液脂肪酸组成的影响[J]. 肉类研究, 2022, 36(2): 9-14. DOI:10.7506/rlyj1001-8123-20210603-168. http://www.rlyj.net.cn
WANG Yuanyuan, LI Xinmiao, HESHUOTE Mailisi, et al. Effects of stearoyl-coenzyme a desaturease 1 gene expression on blood fatty acid composition of pastured angus cattle[J]. Meat Research, 2022, 36(2): 9-14. DOI:10.7506/rlyj1001-8123-20210603-168. http://www.rlyj.net.cn
脂肪酸是动物新陈代谢、生长发育和繁殖等生命活动所必需的营养素和限制性因素,脂肪酸含量与人类健康和疾病密切相关[1]。硬脂酰辅酶A去饱和酶1(stearoyl-coenzyme A desaturase 1,SCD1)是脂肪代谢中的关键酶,催化硬脂酰辅酶A和棕榈酰辅酶A第9、10位碳原子间形成一个顺式双键,将饱和脂肪酸转化为单不饱和脂肪酸(monounsaturated fatty acids,MUFA)[2]。SCD1作为脂肪酸去饱和化的限速酶,其主要底物为棕榈酰辅酶A和硬脂酰辅酶A,分别将它们转换为棕榈油酰辅酶A和油酰基辅酶A[3]。MUFA的主要组成部分包括膜磷脂、甘油三酯、胆固醇脂和酯蜡,上述脂类中饱和脂肪酸(saturated fatty acids,SFA)与MUFA的比例影响脂蛋白代谢、生物膜流动性和信号传导,进而影响糖尿病、动脉粥样硬化、癌症、肥胖症等多种疾病[4]。研究表明,SCD1基因也是骨骼肌代谢调节的重要组成部分,它影响胰岛素敏感性、线粒体脂肪酸氧化和肌纤维中氧化的神经酰胺再生[5-6]。随着分子生物学的发展,学者们关注高端肉牛繁育中与脂肪代谢相关的候选基因的研究[7-9],主要以牛的肝脏、脂肪及肌肉组织中与肉质相关SCD1基因多态性和基因测序及表达量为研究焦点。有关SCD1基因对牛血液脂肪酸的影响研究不多,草原安格斯牛SCD1基因表达对血液脂肪酸的影响研究鲜有报道。本研究通过测定草原安格斯牛SCD1基因表达对血液中脂肪酸组成的影响,分析SCD1基因表达与脂肪酸之间的相关性,了解SCD1基因表达对血液脂肪酸的调控作用,為今后草原安格斯牛优良遗传基因的选育及优质草原安格斯牛数据库的建立提供基础数据。
1 材料与方法
1.1 材料与试剂
采集平均体质量(698±34) kg、48 月龄未妊娠的新西兰进口纯种黑安格斯繁殖母牛血液样品。实验牛采用6—9月期间草原放牧,10月至翌年5月期间饲喂青贮加干草和全价料,采用自由运动的草原饲养模式。清晨4时放牧前,从500 头安格斯牛中随机抽取38 头牛的血液样品,从颈静脉采血5 mL,放置于含有乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)抗凝剂的采血管充分摇匀,先提取血液中总RNA,其余全血分装至无菌无酶冻存管中,标记,-80 ℃冷冻保存。
三氟化硼-甲醇溶液(三氟化硼含量50%~65%) 美国Sigma公司;三氯甲烷、氢氧化钠、氯化钠、甲醇、无水乙醇、EDTA、无水乙酸钠、硫氰酸钠、异硫氰酸胍、丙三醇、冰醋酸(均为分析纯)、正己烷(色谱纯) 国药集团化学试剂有限公司;琼脂糖 美国英杰生命技术有限公司;DNA提取试剂盒、6×DNA Loading Buffer 天根生化科技(北京)有限公司;TB GreenTM Premix EX TaqTM Ⅱ(Tli RNaseH plus)、PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit、Premix TaqTM(TaKaRa TaqTM Version 2.0 plus dye) 宝生物(大连)工程有限公司;高度去离子甲酰胺、BigDye Terminator试剂盒 美国应用生物系统公司;胶回收柱式聚合酶链式反应(polymerase chain reaction,PCR)产物纯化试剂盒 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
2720 PCR仪 德国Thermal Fisher公司;LIGHT CYCLER 480Ⅱ荧光定量PCR仪 瑞士Roche公司;G:BOX EF2全自动凝胶成像系统 美国Syngene公司;NanoDrop? One超微量核酸蛋白测定仪 美国Thermo公司;7890A-5975C气相色谱-质谱联用仪 美国Agilent公司;YG-96梯度PCR仪 杭州博赛科技有限公司;DYY-8C双稳定时电泳仪 北京六一仪器厂;BIOSENS-SC-BO5紫外分析仪 苏州BIO TOP生物技术服务有限公司;3730xl DNA Analyzer测序仪 美国应用生物系统公司。
1.3 方法
1.3.1 脂肪酸组成与含量测定
参照简路洋等[10]方法进行血液样品的脂肪酸前处理与含量测定。使用气相色谱-质谱联用仪及Supelco SPTM-2560气相毛细管柱(100 m×0.25 mm,0.2 μm)分析脂肪酸组成与含量。
1.3.2 SCD1基因表达水平测定
采用TRIzol法提取血液中的总RNA,经微量分光光度计和琼脂糖凝胶电泳检测纯度和完整性,符合要求后,立即使用反转录试剂盒进行cDNA合成。
1.3.2.1 总RNA的提取和反转录成cDNA
反转录第1步反应体系(10 ?L):1 ?L 50 μmol/L Oligo dT Primer、1 ?L 10 mmol/L dNTP Mixture、2 ?L模板RNA、6 ?L RNase Free dH2O。在PCR仪中65 ℃反应5 min后,冰上迅速冷却。
反转录第2步反应体系(20 ?L):取上述变性后反应液10 ?L,加入4 ?L 5×PrimeScript Ⅱ Buffer、0.5 ?L 40 U/μL RNase Inhibitor、1 ?L 200 U/μL PrimeScript Ⅱ RTase、4.5 ?L RNase Free dH2O;42 ℃、60 min;95 ℃、5 min;使用超微量核酸蛋白测定仪测定cDNA样品A260 nm/A280 nm判断cDNA纯度和浓度,置于-20 ℃冰箱备用。
1.3.2.2 实时荧光定量PCR
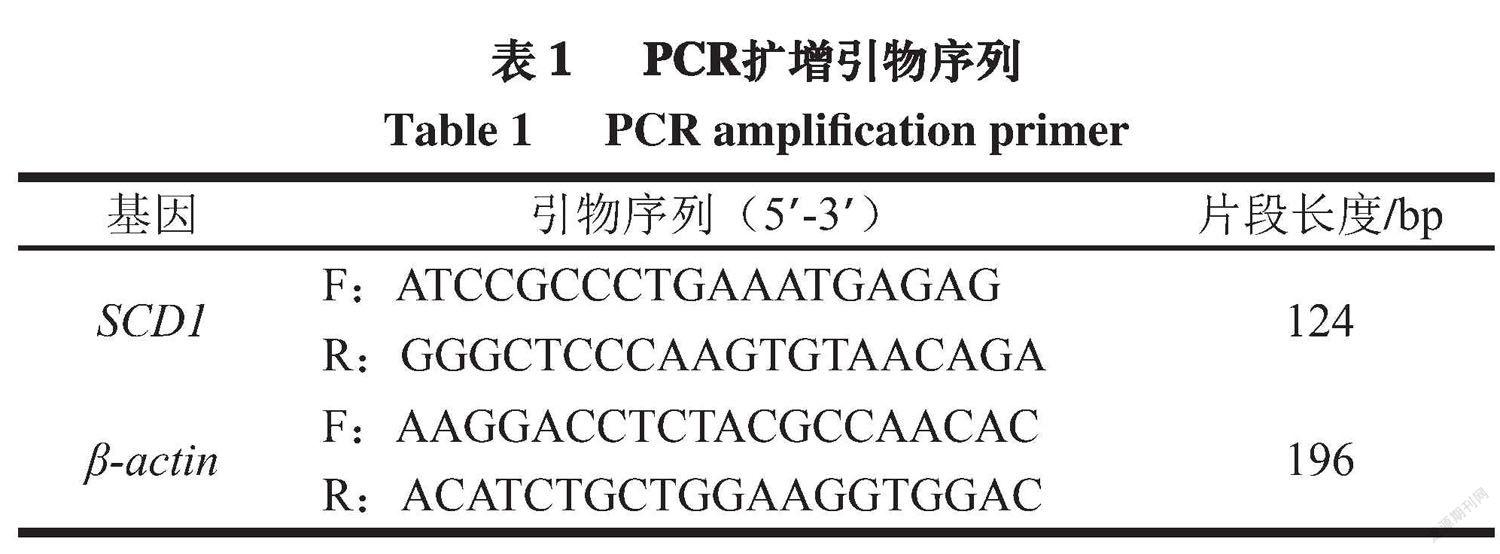
SCD1基因和内参基因引物序列均参考唐慧等[11]设计(表1),由生工生物工程(上海)股份有限公司合成,无菌无酶水溶解,-20 ℃保存备用。
以cDNA为模板,利用实时荧光定量PCR对管家基因和目的基因进行扩增。每个样品重复3 次, SCD1基因在样品中的相对表达量以2-ΔΔCt表示,并按下式计算。2-ΔΔCt=(Ct值目的-Ct值内参)处理-(Ct值目的-Ct值内参)对照实时荧光定量PCR反应程序:预变性95 ℃、30 s,95 ℃、5 s,58 ℃、30 s,循环40 次; 95 ℃、5 s,60 ℃、1 min,95 ℃、5 s,50 ℃、30 s。
1.3.3 全基因组DNA提取與基因型检测
采用DNA提取试剂盒提取血液全基因组DNA,经微量分光光度计和琼脂糖凝胶电泳检测纯度和完整性。符合要求后,进行PCR扩增。反应体系:12.5 ?L Premix TaqTM(TaKaRa TaqTM Version 2.0 plus dye)、1 ?L DNA模板、20 ?mol/L上、下游引物各5 ?L,加19.5 ?L灭菌蒸馏水补至25 ?L。PCR反应程序:94 ℃变性5 min后进行30 个循环,包括94 ℃变性30 s、56 ℃变性30 s、72 ℃变性1 min、72 ℃变性7 min。参考施雪奎[12]的方法设计SCD1基因引物序列(表2),由生工生物工程(上海)股份有限公司合成。
1.3.4 SCD1基因型检测
使用1.5%琼脂糖凝胶电泳,取5 ?L PCR扩增产物直接点样,120 V电泳20 min,在凝胶成像仪上观察扩增产物电泳结果,选择条带清晰、明亮的样品,纯化后,使用测序仪进行一代测序。
1.4 数据处理
结果用平均值±标准差表示。数据采用Excel软件进行初步整理,利用IBM SPSS Statistics 20.0软件进行LSD方差分析,以P<0.05为显著性检验标准。
2 结果与分析
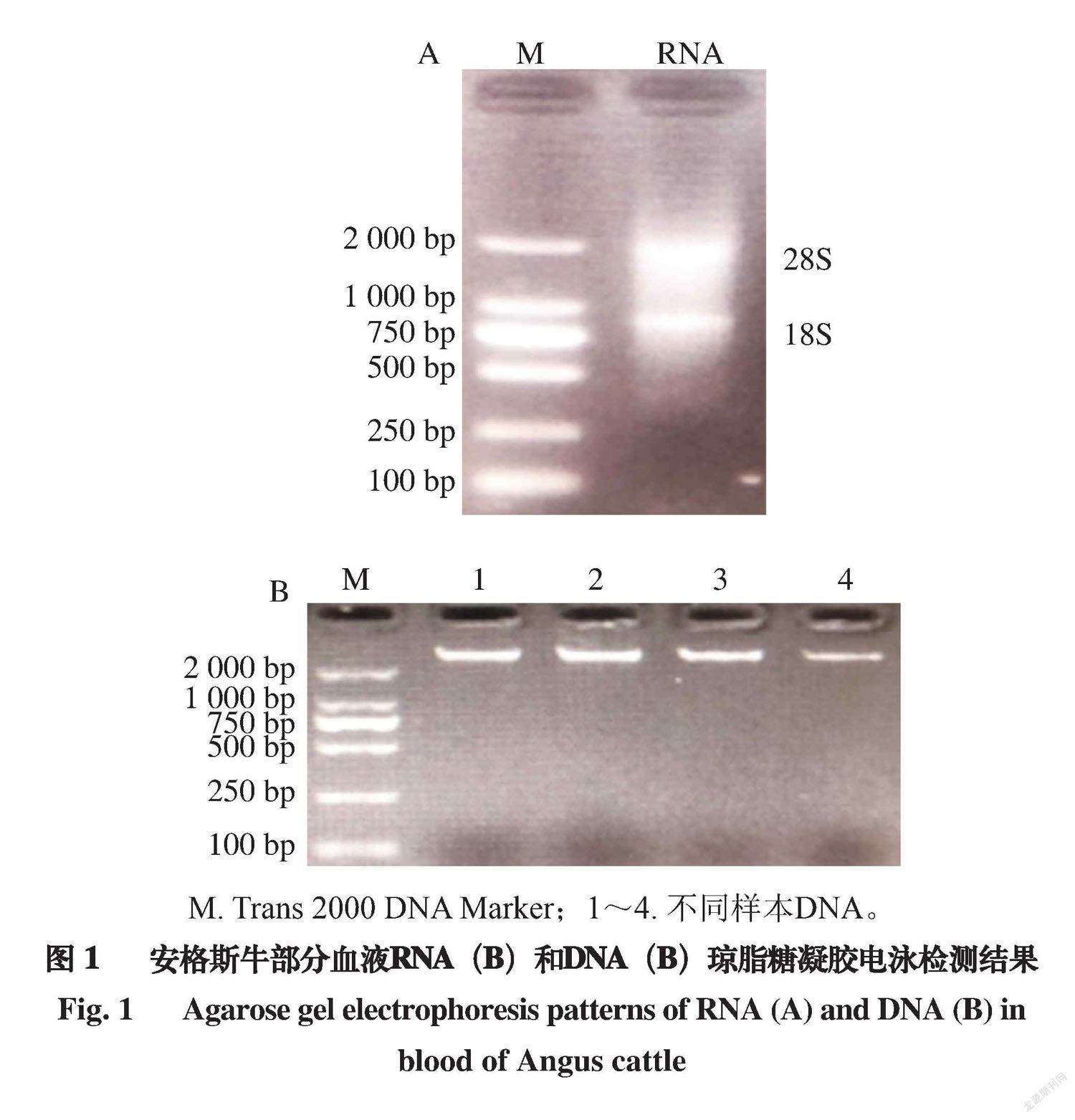
2.1 总RNA和全基因组DNA琼脂糖凝胶电泳结果
所用RNA和DNA的提取分别采用TRIzol法和试剂盒方法,以1.5%琼脂糖凝胶电泳检测其降解度。由图1可知,RNA和DNA无降解。利用微量分光光度计测定38 头牛血液样品中RNA和DNA纯度和浓度,结果显示,A260 nm/A280 nm均为1.7~1.9,质量浓度大于50 ng/?L,证明RNA和DNA可直接用于后续实验。
2.2 草原安格斯牛血液SCD1基因表达量对血液脂肪酸组成的影响
由表3可知:SFA中以棕榈酸(C16:0)和硬脂酸(C18:0)为主,含量分别为22.53%和26.95%;MUFA和多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)中分别以油酸和亚油酸含量为最高,含量分别达15.09%和17.88%;MUFA/SFA为0.31;SCD1基因表达量对MUFA含量影响显著(P<0.05),对C14:0、C14:1和C16:1含量影响均极显著(P<0.01),对C16:0、C18:0、C18:1 n-9c、C18:2 n-6c含量和MUFA/SFA及C14指数(C14:0向C14:1转化的指数)、C18指数(C18:0向C18:1转化的指数)、脂肪酸总不饱和指数和伸长指数影响均高度显著(P<0.001),但对SFA含量和C16指数(C16:0向C16:1转化的指数)影响不显著。
2.3 草原安格斯牛血液SCD1基因表达量与血液脂肪酸组成的相关性
SCD是动物体内调控SFA向MUFA转化的关键酶,主要在以C16:0和C18:0为底物合成C16:1和C18:1的过程中起重要作用[13-14]。由表7可知:SFA中C16:0和C18:0含量与SCD1基因表达量之间的相关系数分别为0.153和0.178;转化为MUFA的C16:1和C18:1(C18:1 n-9c)含量与SCD1基因表达量之间的相关系数分别为0.134和0.167;MUFA与SCD1基因表达量之间的相关系数为0.166。SCD1基因表达量与C16:0、C16:1、C18:0、C18:1 n-9c和MUFA含量均呈正相关,上述结果说明SCD1基因表达对草原安格斯牛血液脂肪酸有正向调控作用。
2.4 草原安格斯牛血液SCD1基因多态性对血液脂肪酸组成的影响
2.4.1 SCD1基因分型结果
利用PCR对草原安格斯牛血液全基因组DNA进行扩增,扩增产物经琼脂糖凝胶电泳检测,没有非特异性条带,纯化后进行一代测序。
检测38 种PCR产物,得到SCD1基因878位点的多态性统计结果。由表5可知,草原安格斯牛血液SCD1基因中检测出的CC、CT和TT 3 种基因型的基因个体数分别为28、9和1,CC型基因个体数最高,TT型基因个体数最少,基因型频率分别为CC 73.7%、CT 23.7%和TT 2.6%,C和T等位基因频率分别为85.5%和14.5%。
2.4.3 SCD1基因多态性对血液脂肪酸组成的影响
由表6可知,含CT型SCD1基因血液的C14:0(0.60%)、C14:1(0.37%)、C18:0(31.16%)含量及伸长指数(0.69)均高于CC型,而CC型的C16:0(22.59%)、C16:1(0.50%)、C18:2 n-6c(18.42%)含量及C14指数(0.39)却高于CT型,CC型个体和CT型个体之间未发现显著差异。由于所选群体中TT基因型个体数较少,导致分析结果中出现较大的误差,因此本统计结果认为TT型没有代表性,不与其他基因型数据作比较。
3 讨 论
3.1 草原安格斯牛血液脂肪酸组成与含量分析
牛肉中含有大量SFA和MUFA,其中MUFA中油酸含量最高,其次为SFA中的硬脂酸和棕榈酸等,而PUFA的含量较少[15]。有研究表明,牛肉中富含的硬脂酸、棕榈酸与油酸能提高高密度脂蛋白胆固醇含量,降低低密度脂蛋白胆固醇含量,从而减少动脉粥样硬化的发生[16]。油酸不仅是牛肉风味的重要来源,也是评价牛肉营养价值的指标之一。肌内脂肪中MUFA的含量和MUFA/SFA比值与牛肉品质成正比,但SFA在血清可转化为胆固醇,可引起动脉粥样硬化,因此,肉中MUFA/SFA比值高,对人体健康有益[17-18]。本研究中,草原安格斯牛血液脂肪酸中棕榈酸、硬脂酸及油酸含量很高,分别达22.53%、26.95%和15.09%,PUFA中亚油酸含量最高,达17.88%,MUFA/SFA比值为0.31,营养价值较高。
3.2 草原安格斯牛SCD1基因表达量对血液脂肪酸的影响
SCD1是SFA生成MUFA过程中的限速酶,MUFA的含量对牛肉的质量至关重要,影响牛肉大理石花纹等级、深加工性能、脂肪柔软度以及肉的风味等[19],SCD1基因被认为是影响牛肉经济性状的重要候选基因[20]。伸长指数表示从C16到C18的转换,伸长指数越高,油酸含量越高,牛肉风味越好[21]。本研究中草原安格斯母牛血液中SCD1基因表达量对MUFA含量影响显著(P<0.05),对C14:0、C14:1和C16:1含量均影响极显著(P<0.01),对C16:0、C18:0、C18:1 n-9c、C18:2 n-6c含量、MUFA/SFA、C14指数、C18指数、脂肪酸总不饱和指数和伸长指数均影响高度显著(P<0.001),但对SFA含量和C16指数无显著影响。因此,SCD1基因对草原安格斯牛血液脂肪酸组成有显著影响,将会对草原安格斯牛肉风味发挥重要作用。
SCD1作为脂肪酸合成路径中催化SFA去饱和化的关键酶,具有催化SFA的脂酰CoA脱氢的作用,可在其首选底物C16:0和C18:0的第9和第10碳原子间导入氢键,分别转化生成MUFA,即C16:1与C18:1,二者是合成膜磷脂、胆固醇酯和三酰甘油的底物,对肌内脂肪沉积、脂肪酸组成等有重要影响[22-23]。唐慧等[11]在不同品种牛(蜀宣花牛、巴山牛和安格斯牛×巴山牛杂交牛)SCD1基因表达与肌肉脂肪酸组成的关系研究中得到SCD1基因表達量分别与MUFA、C16:1和C18:1含量呈正相关的结果。SCD1基因可催化油酸的形成[24]。本研究对草原安格斯母牛SCD1基因表达与血液中脂肪酸组成和含量进行显著性和相关性分析,结果表明,SCD1基因表达量与C16:0、C16:1、C18:0、C18:1和MUFA含量均呈正相关,说明SCD1基因正向调控草原安格斯牛血液中的脂肪酸组成,对其具有遗传效应,与唐慧等[11]研究结果一致。
3.3 草原安格斯牛SCD1基因分型对血液脂肪酸的影响
SCD1基因对肉质性状有重要作用,近年来,国内外对该基因在各种牛群体中开展了研究。李新淼等[25]研究发现,SCD1基因对牛脂肪含量有一定影响。Barton等[26]研究发现,公牛CC和CT基因型个体SFA含量显著低于TT基因型个体,而MUFA含量显著高于TT基因型个体。刘自增等[27]通过对天祝白牦牛的研究发现,SCD1基因C等位基因个体的MUFA含量较高,并且对从SFA到MUFA的去饱和度有不同程度的影响。Jiang等[22]研究发现,SCD1基因与SFA、亚油酸含量显著相关。武秀香等[28]对SCD1基因C878T位点进行检测发现,CC基因型个体肠系膜油质量与肌内脂肪含量均显著高于TT型个体(P<0.05),背膘厚极显著低于TT型个体(P<0.01)。本研究发现,安格斯牛血液中SCD1基因C878T位点表现出不同的多态性,检测出CC、CT和TT 3 种基因型,其基因型频率分别为73.7%、23.7%和2.6%,C和T等位基因频率分别为85.5%和14.5%。草原安格斯母牛中,SCD1基因C878T CC型个体和CT型个体血液脂肪酸之间未发现显著差异,这与Barton[26]、施雪奎[12]等研究结果不一致,但与陈龙[29]的研究一致。TT型SCD1基因有助于提高MUFA含量,本研究结果与Taniguchi等[30]研究的日本黑公牛SCD基因型与脂肪酸组成的相关性结果不一致,本研究在草原安格斯母牛血液样品中表现出较低频率的TT基因型,SCD1基因型对草原安格斯牛血液脂肪酸的影响不明显。
4 结 论
综上所述,草原安格斯牛血液脂肪酸含量丰富,血液SCD1基因表达量与C16:0、C16:1、C18:0、C18:1和MUFA含量均有正相关性,与C14:0、C14:1、C16:0、C16:1、C18:0、C18:1、C18:2、MUFA含量和MUFA/SFA及伸长指数均显著相关;在SCD1基因C878T位点处检测出CC、CT和TT 3 种基因型,不同基因型对血液脂肪酸组成无显著影响。SCD1基因可为品种牛优良遗传基因的選育及优质草原安格斯牛数据库的建立提供科学的理论依据。
参考文献:
[1] 李录明. 蛋氨酸羟基类似物异丙酯对绒山羊生产性能及哺乳羔羊氨基酸转运载体基因表达的影响[D]. 杨凌: 西北农林科技大学, 2018.
[2] 蔡雨, 李苗, 俞沁玮, 等. 硬脂酰辅酶A去饱和酶1及其抑制剂在肝脂肪变性中的作用研究进展[J]. 临床合理用药杂志, 2020, 13(25): 173-175. DOI:10.15887/j.cnki.13-1389/r.2020.25.081.
[3] 姚大为. 奶山羊硬脂酰辅酶A去饱和酶1基因(SCD1)启动子功能及转录调控机理研究[D]. 杨凌: 西北农林科技大学, 2016.
[4] MELE M, CONTE G, CASTIGLIONI B, et al. Stearoyl-coenzyme A desat-urase gene polymorphism and milk fatty acid composition in Italian Holsteins[J]. Journal of Dairy Science, 2007, 90(9): 4458-4465. DOI:10.3168/jds.2006-617.
[5] DOBRZYM A, DOBRZYM P. Stearoyl-CoA desaturase-a new player in skeletal muscle metabolism regulation[J]. Journal of Physiology and Pharmacology, 2006, 57(10): 31-42. DOI:10.1152/jn.00538.2006.
[6] MOIOLI B, CONTARINI G, AVALLI A, et al. Short communication: effect of stearoyl-coenzyme A desaturase polymorphism on fatty acid composition of milk[J]. Journal of Dairy Science, 2007, 90(7): 3553-3558. DOI:10.3168/jds.2006-855.
[7] LEE S H, PARK E W, CHO Y M, et al. Lipogenesis gene expres-sion profiling in Longissimus dorsi on the early and late fattening stage of hanwoo[J]. Animal Science and Technology, 2006, 48(3): 345-352.
[8] 杜学海. 影响肉牛肌内脂肪沉积因素及相关基因的研究进展[J]. 现代畜牧兽医, 2020(12): 54-57.
[9] 杜新, 罗光彬, 王泽英, 等. 肉牛肌内脂肪沉积相关基因的研究[J]. 现代畜牧兽医, 2014(7): 50-53.
[10] 简路洋, 王晗, 梁帅, 等. 氢化大豆油对小鼠肝脏和血液反式脂肪酸含量及脂代谢的影响[J]. 大连工业大学学报, 2019, 38(1): 29-31. DOI:10.19670/j.cnki.dlgydxxb.2019.0107.
[11] 唐慧, 王巍, 方东辉, 等. 不同品种牛SCD1基因表达与肌肉脂肪酸组成的关系研究[J]. 黑龙江畜牧兽医, 2018(1): 1-4. DOI:10.13881/j.cnki.hljxmsy.2017.02.0261.
[12] 施雪奎. 肉牛CAPN1、CAST、GHR、SCD1基因多态性及与胴体、肉质性状的相关性研究[D]. 扬州: 扬州大学, 2011.
[13] KUCHEL H, SIEBERT B D, BOTTEMA C D K, et al. Physical mapping of the stearoyl-CoA desaturase (SCD) locus in sheep[J]. Animal Genetics, 2004, 35: 163. DOI:10.1111/j.1365-2052.2004.01114.x.
[14] 赵伟明, 吴慧光, 吴江鸿, 等. 基于转录组测序分析西门塔尔牛和安格斯牛脂肪沉积相关基因的差异表达[J]. 农业生物技术学报, 2020, 28(4): 693-701.
[15] 郑淑容. 脂肪酸的营养功能[J]. 畜禽业, 2012(9): 55-57. DOI:10.3969/j.issn.1006-9577.2007.08.017.
[16] 板倉弘重. 各种脂肪酸的临床效果比较(硬脂酸、油酸、亚油酸、α-亚麻酸、γ-亚麻酸、花生四烯酸、EPA、DHA、DPA等)[J]. 脂质, 2009, 20(1): 74-79.
[17] 郭同军, 臧长江, 王连群, 等. 去势对西门塔尔牛牛肉品质的影响[J]. 草业科学, 2017, 34(1): 152-160. DOI:10.11829/j.issn.1001-0629.2016-0212.
[18] WOOD J D, ENSER M, FISHER A V, et al. Fat deposition, fatty acid composition and meat quality[J]. Meat Science, 2008, 78: 343-358. DOI:10.1016/j.meatsci.2007.07.019.
[19] 蔡雨, 李苗, 俞沁玮, 等. 硬脂酰辅酶A去饱和酶1及其抑制剂在肝脂肪变性中的作用研究进展[J]. 临床合理用药杂志, 2020(25): 173-175. DOI:10.15887/j.cnki.13-1389/r.2020.25.081.
[20] 王鑫, 李光鹏. 牛肉质性状及其影响因素[J]. 动物营养学报, 2019, 31(11): 4950-4959. DOI:10.3969/j.issn.1006-267x.2019.11.007.
[21] HIDEKI O, ATSUKO T, SHOGO H, et al. Effect of SCD and SREBP genotypes on fatty acid composition in adipose tissue of Japanese Black cattle herds[J]. Animal Science of Journal, 2009, 80(3): 225-232. DOI:10.1111/j.1740-0929.2009.00638.x.
[22] JIANG Z, MICHAL J J, TOBEY D J, et al. Significant associations of stearoyl-CoA desaturase (SCD1) gene with fat deposition and composition in skeletal muscle[J]. Journal of Biological Sciences, 2008, 4(6): 345-351. DOI:10.1016/j.ijbiomac.2007.09.012.
[23] PAQUETTE A, WANG D, JANKOWSKI M, et al. Effects of ovariectomy on PPAR alpha, SREBP-1c, and SCD1 gene expression in the rat liver[J]. Menopause, 2008, 15: 1169-1175. DOI:10.1097/gme.0b013e31817b8159.
[24] 张嘉齐, 罗毅皓, 孙万成. 牦牛乳RNA的完整性及其硬脂酰去饱和酶(SCD1)基因表达分析[J]. 中国乳品工业, 2018, 46(3): 7-28.
[25] 李新淼, 王圆圆, HESHUOTE Mailisi, 等. SCD1基因对高寒草原饲养纯种西门塔尔牛血液脂肪酸组成的影响[J]. 中国畜牧杂志, 2021, 57(11): 1-5.
[26] BARTON L, KOTT T, BURES D, et al. The polymorphisms of stearoyl-CoA desaturase (SCD1) and sterol regulatoryelement binding protein-1 (SREBP-1) genes and their association with the fatty acid profile of muscle and subcutaneous fat in Fleckvieh bulls[J]. Meat Science, 2010, 85(1): 15-20. DOI:10.1016/j.meatsci.2009.11.016.
[27] 刘自增, 阎萍. 天祝白牦牛Leptin和SCD1基因单核苷酸多态性与肌肉脂肪酸含量的关联性分析[J]. 中国畜牧兽医, 2011, 38(4): 154-159.
[28] 武秀香, 施雪奎, 高会江, 等. 牛SCD1基因C878T位点遗传多态性与中国西门塔尔牛部分脂肪相关性状的效应分析[J]. 畜牧兽医学报, 2011, 42(3): 363-368.
[29] 陈龙. 陇东肉牛A-FABP和SCD1基因多态性及其与肉质性状的相关性研究[D]. 兰州: 甘肃农业大学, 2014.
[30] TANIGUCHI M, UTSUGI T, OYAMA, K, et al. Genotype of stearoyl-CoA desaturase is associated with fatty acid composition in Japanese Black cattle[J]. Mammalian Genome, 2004, 14(2): 142-148. DOI:10.1016/S0377-2217(97)00084-2.
收稿日期:2021-06-03
基金项目:内蒙古自然科学基金项目(2017MS0357);内蒙古自治区院士专家工作站建设项目(内科发[2018]88号);
内蒙古自治区科技计划项目(201803055);内蒙古自治区科技重大专项(内财教[2013]2186号);
内蒙古自治区“草原英才”专项(内组通字[2020]7号);内蒙古自治区科技成果转化专項(2020CG0031);
内蒙古自治区财政厅“草原英才”工程专项(内财行[2021]333号)
第一作者简介:王圆圆(1996—)(ORCID: 0000-0002-1039-2162),女,硕士研究生,研究方向为食品机能学。
E-mail: 1692230812@qq.com
通信作者简介:包音都古荣·金花(1965—)(ORCID: 0000-0001-9863-376X),女,副教授,博士,研究方向为食品机能学。
E-mail: huajin25@hotmail.com
