犬源H9N2亚型流感病毒的遗传进化及其致病性分析
2022-03-18何剑桥崔柏杨郭嘉宁郭金凡周华波韦祖樟欧阳康黄伟坚
曾 昊,何剑桥,崔柏杨,郭嘉宁,郭金凡,周华波,韦祖樟,欧阳康,黄伟坚,陈 樱*
(1广西动物疫病预防与控制重点实验室/广西大学动物科学技术学院,广西 南宁 530004;2南宁市华波宠物医院,广西 南宁 530004)
0 引言
【研究意义】流感病毒(Influenza virus)属于正黏病毒科(Orthomyxoviridae)负股单链RNA病毒,依据核蛋白抗原性的不同,可分为A型、B型、C型和D型(Compans et al.,1977;van de Sandt et al.,2015;Asha and Kumar,2019),其中A型流感病毒主要感染野生水禽,并将其作为天然宿主(Webster et al.,1992)。目前已鉴定出18个HA亚型和11个NA亚型的流感病毒(Tong et al.,2013;Zhu et al.,2013),其中H9N2 亚型禽流感病毒(Avian influenza virus,AIV)在我国大部分地区已呈地方性流行,在家禽及一些哺乳动物中以低致病性形式存在,并未引起广泛关注,但可持续在这些宿主中不断衍化以适应新宿主,对家禽和哺乳动物的毒力及传播力也不断增强。除了衍化成为具有结合人源受体特性和可通过气溶胶在雪貂间进行传播外(Wan et al.,2008),H9N2亚型流感病毒还可广泛承受同个亚型或不同亚型间基因片段的重配,从而产生携带不同H9N2亚型谱系片段的新基因型病毒(Su et al.,2015;Li et al.,2017)。犬呼吸道内同时拥有结合人流感和禽流感的受体(Wasik et al.,2017),可作为流感病毒的中间宿主。当2种或多种流感病毒同时存在于犬体内时,不同基因片段的重配会导致新型流感病毒产生。此外,犬作为人类的伴侣动物,在流感病毒的生态循环过程中发挥重要作用,当H9N2亚型流感病毒突破中间宿主屏障时势必会对人类的健康造成潜在威胁。因此,了解犬源H9N2亚型流感病毒的分子变异特征和致病性,可为揭示H9N2亚型流感病毒突破禽—人宿主屏障的分子机制提供科学依据。【前人研究进展】根据流感病毒8个基因片段的不同来源,Gu等(2014)对H9N2亚型流感病毒建立了一种基因型划分方法,以BJ/94类谱系的H9N2亚型为A基因型,基因片段来源不同则定义为其他基因型。按照这种划分方法,我国目前流行的H9N2亚型流感病毒至少可划分为23种基因型(A~W)(Guan et al.,1999;Gu et al.,2014;Liu et al.,2016)。最初,A基因型在我国H9N2亚型流感病毒中占主导到位,但1998年后H基因型(A基因型的PB2、PB1、PA和NP基因片段由F/98类谱系所替代)逐渐取代A基因型,成为优势基因型(Liu et al.,2003)。研究表明,F/98类谱系病毒较BJ/94类谱系病毒在鸡群中拥有更高的复制和传播力(Sun et al.,2010),因此H基因型拥有更强的禽类宿主适应能力。2007年出现的S基因型(在H基因型的基础上替换了G1类谱系的PB2和M基因片段)具有很强的传播性,可在家禽中稳定传播,成为目前我国H9N2亚型流感病毒的主要基因型(Gu et al.,2014)。H9N2亚型流感病毒能感染多种哺乳动物,包括犬、猫、雪貂和猪等(Wan et al.,2008;Yu et al.,2008;Sun et al.,2013;Zhou et al.,2015;孔子荣等,2020),更重要的是H9N2亚型流感病毒能跨越宿主感染人类(Sun and Liu,2015;Song and Qin,2020)。此外,H9N2亚型流感病毒可提供病毒基因,导致H5N1亚型流感病毒出现遗传多样性(Lei and Shi,2011),同时为H7N7、H5N2、H7N9和H10N8亚型流感病毒提供内部基因,产生新的基因型流感病毒(Li et al.,2014;Xu et al.,2015;Yang et al.,2017)。至今,已有不同亚型流感病毒感染犬的研究报道,如H5N1、H5N2和H9N2亚型AIV,其中H5N1亚型AIV甚至可引起犬死亡(Songserm et al.,2006;Chen et al.,2010,2015;Zhao et al.,2012)。2013年在广西地区分离获得犬源H9N2亚型流感病毒,且H9亚型阳性率逐年升高,2012年的检出率甚至高达44.85%(Sun et al.,2013)。杨新艳等(2012)的犬血清学调查结果显示辽宁锦州地区犬血清H9亚型病毒阳性检出率为1.3%;Zhou等(2015)对我国江西、福建、浙江和江苏地区家禽养殖场附近的流浪犬和流浪猫进行血清学调查,结果发现犬血清中H9亚型病毒阳性检出率为3.9%,且4.71%的猫血清能与分离获得的H3N2亚型犬流感病毒(Canine influenza virus,CIV)抗原抗体反应,故推测犬在流感病毒传播中充当中间宿主的角色。Saberi等(2019)对伊朗东南部地区的犬血清学调查显示H9N2病毒阳性检出率为38.23%。此外,Amirsalehy等(2012)在实验室条件下以H9N2亚型AIV感染犬,结果发现接种组和接触组犬均出现打喷嚏、咳嗽和流鼻涕等临床症状,且在犬鼻拭子和粪便中均能检测到病毒存在。Zhang等(2013)进行同样试验,但结果显示仅在肺脏组织中检测到H9N2亚型AIV,在鼻拭子和咽拭子未检测到病毒。【本研究切入点】目前,H9N2亚型流感病毒已在家禽中广泛流行,但国内外有关H9N2亚型流感病毒感染犬后其分子变异特征及致病性的研究鲜见报道。【拟解决的关键问题】通过病毒分离鉴定、全基因组扩增及测序,对比分析犬源H9N2亚型流感病毒与H9N2亚型AIV间的遗传进化关系和关键氨基酸位点变化特点,旨在掌握犬源H9N2亚型流感病毒的分子变异特征及致病性,为今后探究流感病毒的禽—犬跨种传播机制提供科学依据。
1 材料与方法
1.1 试验材料
2017年8月—2019年1月从广西各地采集流浪犬鼻拭子,共393份。犬肾细胞(Madin-darby caine kidney,MDCK)由广西疾病预防控制中心惠赠;6周龄SPF级BALB/c雌性小鼠购自北京维通利华实验动物技术有限公司;反转录酶、dNTP预混剂和DNA Marker购自TaKaRa公司;核酸提取试剂盒购自Axy-Prep公司;RNA酶抑制剂购自北京全式金生物技术股份有限公司;琼脂糖凝胶粉末购自生工生物工程(上海)股份有限公司;EB替代染料购自APPLYGEN公司;DMEM液体培养基购自Corning公司;胎牛血清、0.05%胰酶和TPCK胰酶购自Gibco公司;血清白蛋白购自Solarbio公司;细胞板、细胞瓶及吸管等细胞生物耗材购自NEST公司;RT-PCR扩增引物委托上海杰李生物技术有限公司合成。
1.2 样品检测及病毒分离
按照核酸提取试剂盒说明提取病毒总RNA,使用通用引物Uni12(5'-AGCAAAAGCAGG-3')将其反转录合成cDNA,利用针对A型流感病毒M基因片段的特异性引物(5'-ATGAGYCTTYTAACCGAGGTC GAAACG-3'和5'-TGGACAAANCGTCTACGCTGC AG-3')进行PCR扩增。RT-PCR鉴定呈阳性的样品经0.22 μm除菌滤器过滤后,接种至MDCK细胞,盲传3代后收集细胞上清液进行鉴定。
1.3 病毒全基因组扩增
使用Hoffmann等(2001)设计的特异性引物扩增分离毒株全基因组。其中,PB2、PB1和PA基因分两段进行扩增,其余5个基因片段直接扩增。PCR扩增产物经胶回纯化后送至生工生物工程(上海)股份有限公司测序。
1.4 基因序列分析及其遗传进化分析
使用DNASTAR Lasergene 7.1中的SeqMan对测序结果进行拼接,处理后的全长序列在NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)上进行BLAST同源比对。选用国内外的22株参考毒株,包括主要的H9N2 亚型各谱系代表性毒株BJ/94[A/chicken/Beijing/1/1994(H9N2)]、Y280[A/duck/Hong Kong/Y280/97(H9N2)]、G1[A/quail/Hong Kong/G1/1997(H9N2)]、G9[A/chicken/Hong Kong/G9/1997(H9N2)]、Y439[A/duck/Hong Kong/Y439/1997(H9N2)]、TY/WI/66[A/turkey/Wisconsin/1/1966(H9N2)]、F/98[A/chicken/Shanghai/F/1998(H9N2)]及广西早期犬源分离毒株GX1[A/canine/Guangxi/1/2011(H9N2)],采用MEGA 7.0的邻接法(Neighborjoining)构建系统发育进化树,Bootstrap设为1000次。
1.5 小鼠致病性试验
将小鼠随机平均分为试验组和对照组,每组9只。采取麻醉滴鼻方式,试验组每只小鼠接种50 μL病毒液(含1.0×106PFU),对照组每只接种50 μL PBS。从攻毒当天至攻毒后14 d,观察小鼠临床症状并记录其体质量,体质量下降25%及以上则默认其死亡(Li et al.,2012;Chen et al.,2015;Mitake et al.,2020),给予安乐死处理。攻毒后第3 d和第5 d每组随机剖杀3只小鼠,采集脑、上鼻窦、肺脏、肝脏、心脏、肾脏及脾脏组织,通过空斑试验测定病毒效价。
2 结果与分析
2.1 病毒分离鉴定结果
2017年8月—2019年1月从疑似患流感症状[咳嗽、打喷嚏、流鼻涕,以及发热(体温>39 ℃)]的流浪犬中采集393份犬鼻拭子样品,经RT-PCR检测显示有36份样品呈阳性,阳性率为9.16%。将RT-PCR检测呈阳性的犬鼻拭子样品接种至MDCK细胞,结果仅有1份流浪犬样品接种MDCK细胞后出现皱缩、拉长等明显病变(图1-A),而阴性对照孔无明显变化(图1-B)。对接种第3代后收集到的细胞上清液进行RT-PCR鉴定,结果扩增获得约250 bp的目的片段(图1-C),将该毒株命名为A/canine/Guangxi/LZ11/2018(简写为LZ11)。对分离毒株LZ11全基因组进行分段扩增,结果显示所有扩增片段大小(图1-D)均与理论值相符。
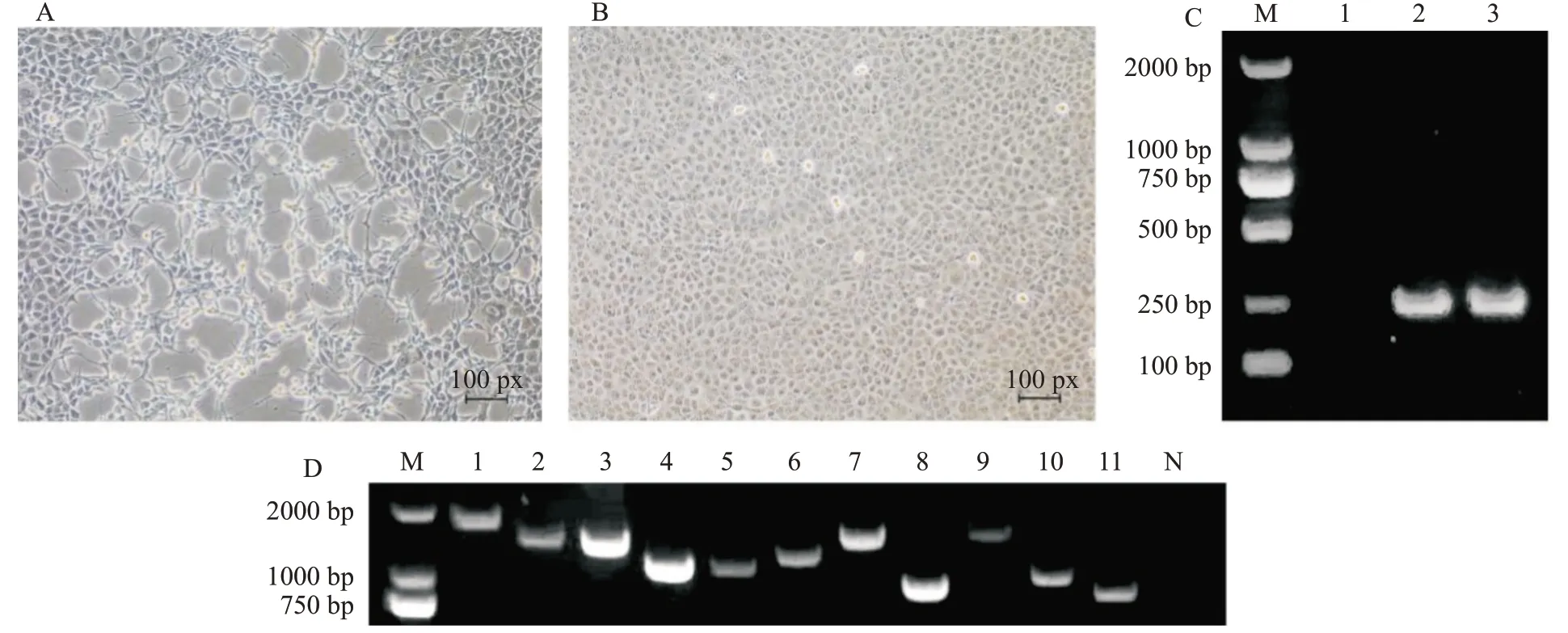
图1 犬源流感病毒分离鉴定及其全基因扩增电泳结果Fig.1 Isolation,identification and amplification electrophoresis of complete genome of canine-origin influenza virus
2.2 同源比对分析结果
BLAST同源比对分析结果(表1)表明,分离毒株LZ11的HA、NA基因分别与A/chicken/Hubei/01/2015(H9N2)和A/chicken/JinShui/JS1002/2018(H9N2)对应基因序列的相似性最高,其相似性分别为99.43%和98.33%;而PB2、PB1、M 和NS 基因与H7N9 亚型AIV对应基因序列的相似性最高,达98.55%~99.51%;PA和NP基因则与A/chicken/Anhui/LH99/2017(H9N2)对应基因序列的相似性最高,分别为99.21%和99.53%。
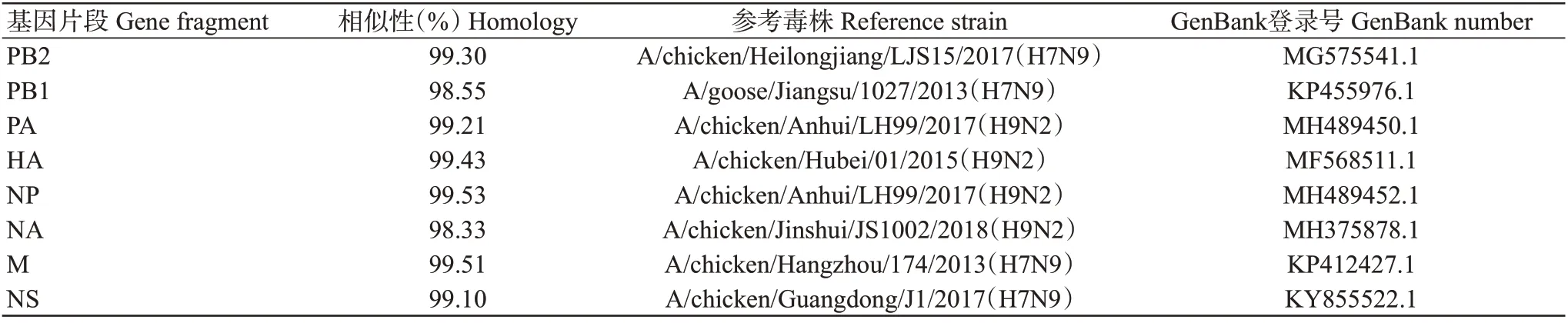
表1 分离毒株LZ11的8个基因片段同源比对分析结果Table 1 Homology comparison of eight gene fragments of LZ11 isolate
2.3 全基因组遗传进化分析结果
将分离毒株LZ11与国内外22株参考毒株进行遗传进化分析,结果表明,分离毒株LZ11的HA、NA和NS基因属于BJ/94类谱系,PB2和M基因属于G1类谱系,PB1、PA和NP基因属于F/98类谱系,其中PB1、PA和NP基因节段组成与近年来我国流行的S基因型H9N2亚型AIV一致。分离毒株LZ11的HA、NS、PB2、M、PB1、PA和NP基因片段来源均与广西早期犬源分离毒株A/canine/Guangxi/1/2011(H9N2)相同(图2),仅NA基因片段来源不同,分离毒株LZ11的NA基因片段来源于BJ/94类谱系,而A/canine/Guangxi/1/2011(H9N2)的来源于G9类谱系。
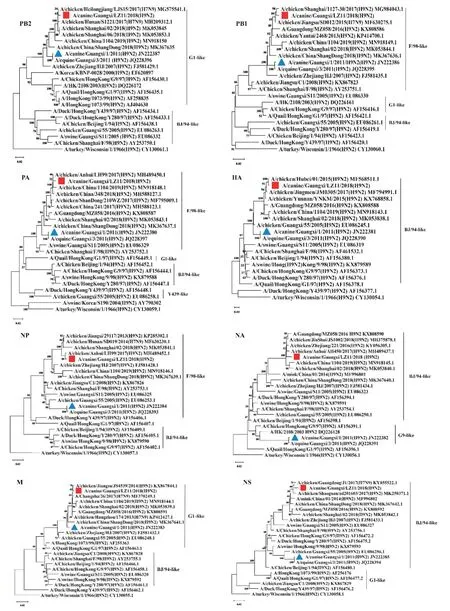
图2 基于H9N2亚型流感病毒8个基因片段相似性构建的系统发育进化树Fig.2 Phylogenetic trees of eight gene fragments based on homology of canine-origin H9N2 subtype influenza virus
2.4 HA、NA和M2蛋白关键氨基酸位点分析结果
对分离毒株LZ11与H9N2亚型各谱系代表毒株和广西早期犬源分离毒株A/canine/Guangxi/1/2011(H9N2)的HA蛋白裂解位点、HA蛋白受体结合位点、NA蛋白耐药位点及M蛋白耐药位点进行比较,结果(表2)发现,分离毒株LZ11的HA蛋白在第324~331位存在1个裂解位点(PSRSSR↓GL),符合低致病性流感病毒的特征。与代表毒株相比,分离毒株LZ11的HA蛋白受体结合位点在第153、194、220和228位较保守,但在第183、190、195和226位的变异程度较大,尤其是第226位为亮氨酸(L),使得分离毒株LZ11具有优先结合人类α-2,6唾液酸受体的能力。此外,分离毒株LZ11 的NA 蛋白耐药位点保持为119E、151D、276E、292R和294N,说明其仍对神经氨酸酶抑制剂敏感;由于分离毒株LZ11的M2蛋白发生31S→N突变,故推测其已对金刚烷胺类药物产生耐药性。
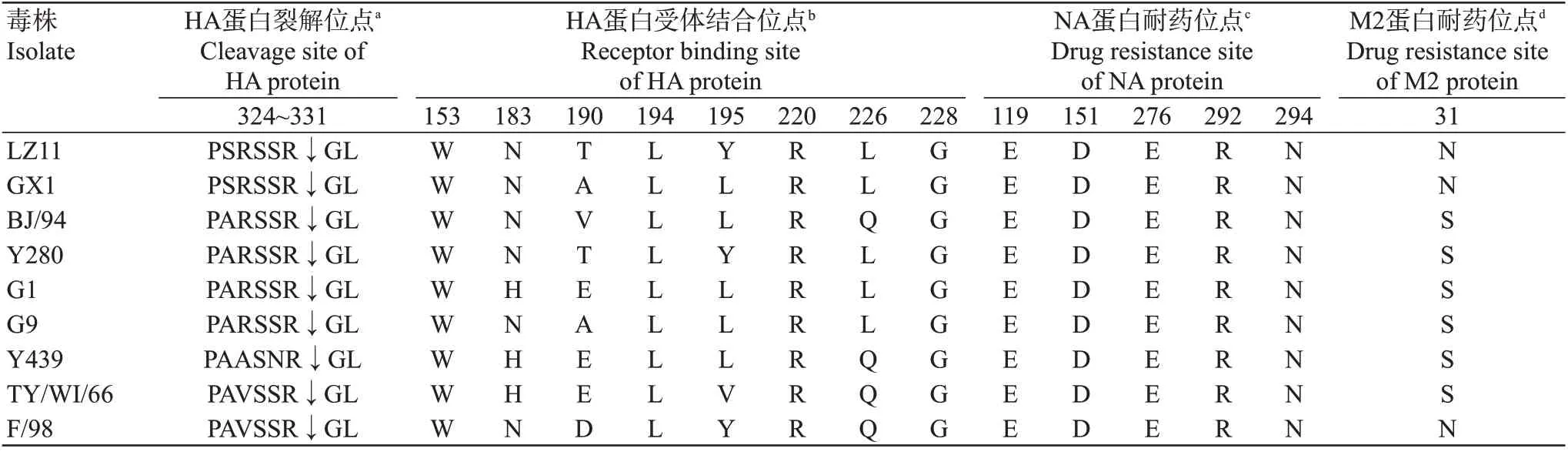
表2 分离毒株LZ11与各参考毒株的HA、NA和M2蛋白关键氨基酸位点比较Table 2 Comparison of key amino acids sites of HA,NA and M2 proteins in LZ11 isolate and reference strains
2.5 PB2、PB1和PA蛋白关键氨基酸位点分析结果
对分离毒株LZ11与H9N2亚型各谱系代表毒株和广西早期犬源分离毒株A/canine/Guangxi/1/2011(H9N2)的PB2、PB1和PA蛋白进行比较,结果(表3)发现,与H9N2亚型AIV代表毒株相比,分离毒株LZ11的PB1蛋白发生588A→F突变和PA蛋白发生356K→R突变,与其他代表毒株完全不同;但与A/canine/Guangxi/1/2011(H9N2)相比,PB2蛋白292V、PB1蛋白368V和PA蛋白409N并未发生突变,说明分离毒株LZ11保留了部分哺乳动物适应性突变位点,同时其他哺乳动物适应性位点出现新的氨基酸位点突变。
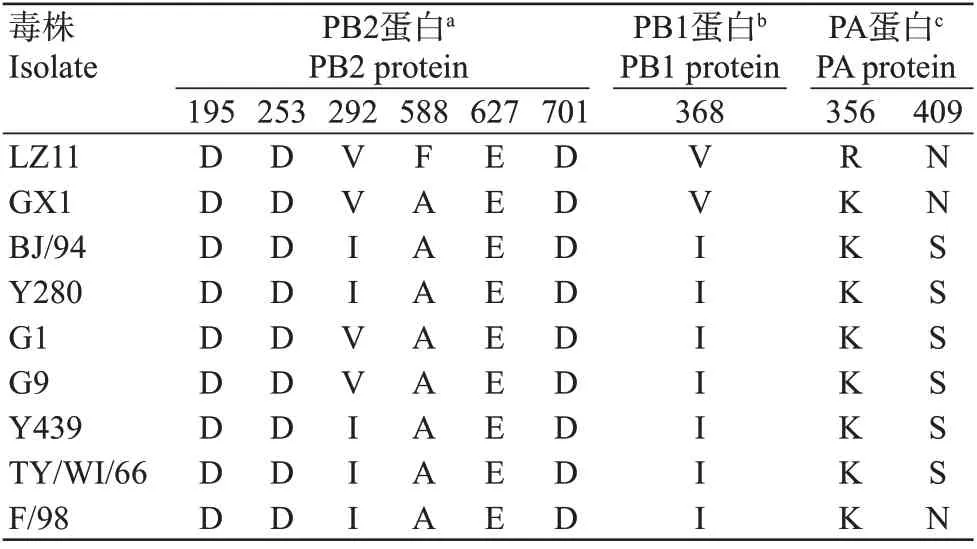
表3 分离毒株LZ11与各参考毒株的PB2、PB1和PA蛋白关键氨基酸位点比较Table 3 Comparison of key amino acids sites of PB2,PB1 and PA proteins in LZ11 isolate and reference strains
2.6 小鼠致病性试验结果
分离毒株LZ11经滴鼻方式接种小鼠后,攻毒组的小鼠未出现死亡现象,也无任何临床症状;仅在攻毒后2 d出现轻微的体质量下降,平均体质量下降4.4%,但至攻毒后3 d小鼠体质量逐渐恢复至正常水平(图3-A),与对照组小鼠一致。对攻毒组和对照组小鼠的所有脏器进行病毒空斑滴定,结果发现分离毒株LZ11能在攻毒组小鼠的肺脏和上鼻窦组织中进行有效复制,其中攻毒后3 d的肺脏滴度较攻毒后5 d的高,滴度高达3.82 lg PFU/mL,上鼻窦的病毒滴度最高为5.98 lg PFU/mL(图3-B)。说明分离毒株LZ11能较好地在哺乳动物呼吸道复制。
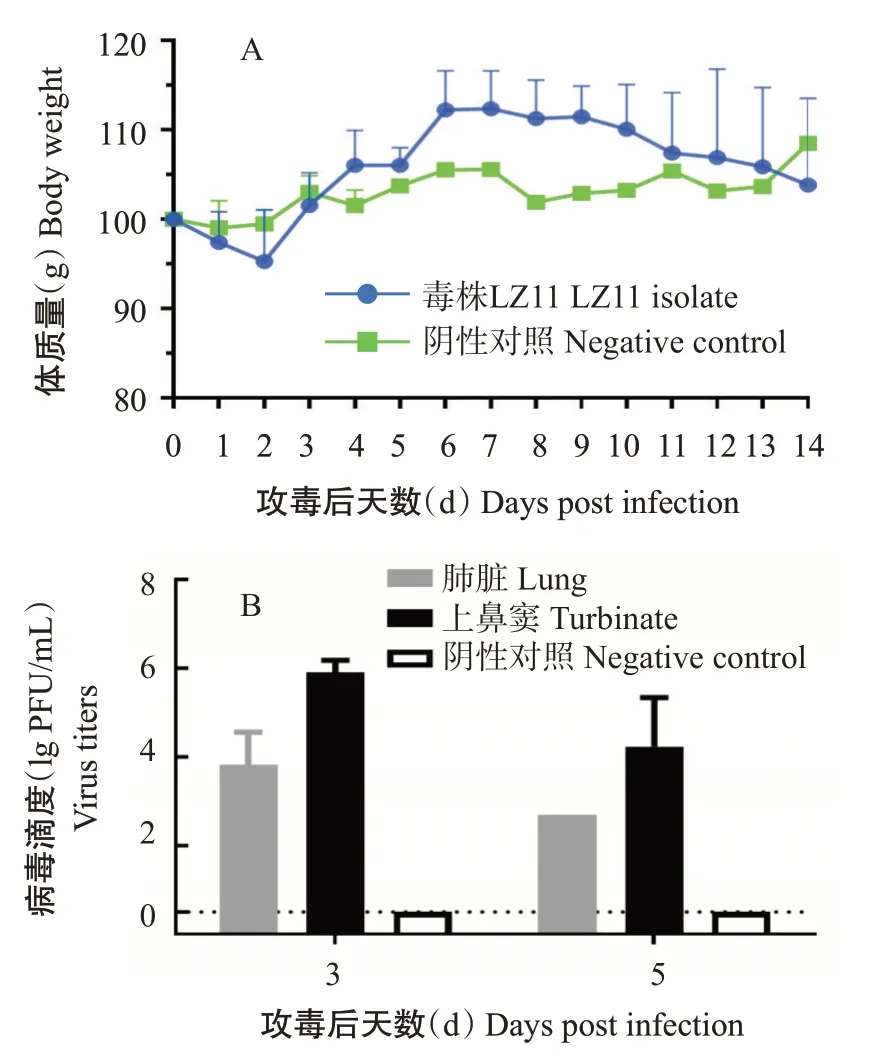
图3 小鼠致病性试验结果Fig.3 Test of pathogenicity in mice
3 讨论
H9N2亚型AIV属于低致病性流感病毒,在家禽中广泛流行。随着流感病毒在禽—犬间的不断传播,H9N2亚型AIV犬阳性血清不断被检出(杨新艳等,2012;Zhou et al.,2015;Saberi et al.,2019),但从犬体内分离获得H9N2亚型流感病毒并进行致病性分析的研究相对较少。本研究从流浪犬中分离获得毒株LZ11(A/canine/Guangxi/LZ11/2018)并进行遗传进化分析,结果表明,分离毒株LZ11的8个基因节段与A/chicken/Anhui/LH99/2017(H9N2)高度同源(99.53%~94.65%),且其基因型是我国当前流行的S基因型(Gu et al.,2014),即分离毒株LZ11为犬源H9N2亚型流感病毒,且属于近年流行的S基因型。研究发现,2013年感染人类的H7N9亚型AIV是由H9N2亚型AIV提供的内部基因所形成,尽管供体的来源多样,但均属于S基因型(Gu et al.,2014;孔子荣等,2020)。值得注意的是,分离毒株LZ11与广西早期犬源分离毒株A/canine/Guangxi/1/2011(H9N2)的基因型并不一致,A/canine/Guangxi/1/2011(H9N2)来自欧亚类禽谱系AIV的重组H9N2亚型流感病毒(Sun et al.,2013),而分离毒株LZ11是来源于3个谱系的三重组毒株。分离毒株LZ11的NA基因来源于BJ/94类谱系,而A/canine/Guangxi/1/2011(H9N2)来源于G9类谱系,但其余7个基因片段(HA、NS、PB2、M、PB1、PA和NP)的来源相同。可见,随着H9N2亚型AIV在家禽中的不断演化,其主要基因型(S型)正试图感染新的宿主。犬不仅是流感病毒生态循环过程中的重要中间宿主,还在AIV从禽类跨种感染哺乳动物的传播过程中发挥重要作用。
为进一步了解分离毒株LZ11的分子变异特征,将其关键氨基酸位点与H9N2亚型各谱系代表毒株及广西早期犬源分离毒株A/canine/Guangxi/1/2011(H9N2)进行比较,结果发现分离毒株LZ11的HA蛋白出现226Q→L突变,具有增强人类SAα2,6Gal受体亲和力的分子特征(Teng et al.,2013;Zhou et al.,2015),即具备与人源受体结合的能力。尽管分离毒株LZ11的PB2蛋白保持了627E和701D,但存在292I→V突变。292I→V突变能使病毒拥有更高的病毒聚合酶活性及更强的抑制IFN-β诱导能力,从而增强H9N2亚型流感病毒在哺乳动物宿主体内的复制能力(Gao et al.,2019)。同时有研究表明,PB2蛋白588A→V突变能增加H9N2亚型流感病毒对小鼠的毒力及其在小鼠体内的复制能力(Xiao et al.,2016),但分离毒株LZ11的PB2蛋白588A→F突变是否起到与PB2蛋白588A→V突变相似的作用还有待进一步探究。此外,2株犬源H9N2亚型流感病毒[分离毒株LZ11和A/canine/Guangxi/1/2011(H9N2)]的PB1蛋白均发生368I→V突变。尽管368I→V突变是H5N1亚型AIV在雪貂上的适应性标记,但研究发现该位点在H9N2亚型AIV中逐年增加,从1999年之前的2.8%增加至1999—2012年期间的21.0%,在2013—2019年期间已高达67.0%(Sun et al.,2020)。分离毒株LZ11的PA蛋白还存在356K→R突变,该位点的突变已被证实可提高病毒对小鼠的毒力及其在人类细胞内的复制能力(Xu et al.,2016)。综上所述,这些哺乳动物适应性位点的突变暗示着犬源H9N2亚型流感病毒可能拥有更强的哺乳动物适应能力。
本研究的小鼠致病性试验再次验证了犬源H9N2亚型流感病毒对小鼠的适应能力,虽然对小鼠的致病性不强,但可在小鼠体内较好地复制。李三木等(2021)对广西早期犬源H9N2亚型流感病毒进行小鼠致病性评估,结果表明犬源H9N2亚型流感病毒对小鼠均未引起死亡,且仅有部分毒株能在小鼠体内有效复制。本研究却发现分离毒株LZ11感染小鼠3 d后,在肺脏和上鼻窦的病毒滴度分别为3.82和5.98 lg PFU/mL,即病毒复制能力强于广西早期的犬源分离毒株。但也有研究发现从猪体内分离获得的H9N2亚型流感病毒可引起小鼠明显的临床症状,甚至造成死亡(Deng et al.,2010;Wei et al.,2012)。说明不同来源和不同宿主适应后的H9N2亚型流感病毒对小鼠的致病性可能存在差异。对于H9N2亚型AIV跨种感染犬,可能会出现无症状感染现象而被忽视,促使其更易获得适应新宿主的机会,因今后有必要进一步加强对犬源H9N2亚型流感病毒的监测,及早切断禽—犬传播,为有效防控流感病毒犬—人跨种传播打下基础。
4 结论
分离获得的犬源H9N2亚型流感病毒属于近年流行的S基因型,其8个基因节段分属于3种谱系(BJ/94类谱系、G1类谱系和F/98类谱系),且存在多个哺乳动物适应性相关氨基酸位点突变,具备感染哺乳动物的分子特征,可在小鼠脏器内有效复制。鉴于人类与犬的密切关系,今后应加强对犬源H9N2亚型流感病毒的监测与防控。
