鸡ANP32家族蛋白亚细胞定位及其在免疫器官中的表达特征分析
2022-03-18邢静如石海英王燕碧赵采芹段志强
邢静如,石海英,王燕碧,赵采芹,唐 宏,段志强
(贵州大学动物科学学院/高原山地动物遗传育种与繁殖教育部重点实验室/贵州省动物遗传育种与繁殖重点实验室,贵州 贵阳 550025)
0 引言
【研究意义】酸性亮氨酸磷酸核蛋白(Acidic leucine nuclear phosphoprotein 32,ANP32)是一类进化高度保守的酸性核磷蛋白家族,其成员包括ANP32A、ANP32B和ANP32E,一般含有220~290个氨基酸,分子量约32 kD。ANP32家族蛋白成员间具有相似的结构特征,N端为富含亮氨酸的重复区域(Leucine-rich repeats,LRR),以LRR串联阵列的形式存在,为蛋白的相互作用提供了框架;C端为低复杂性的酸性区域(Low complexity acidic region,LCAR),约由100个氨基酸组成,其中天冬氨酸和谷氨酸占60%~75%,由于LCAR结构缺乏疏水性氨基酸而影响三级结构的形成,致使该结构是以游离的形式存在,从而具有与带正电荷蛋白发生相互作用的能力(Matilla and Radrizzani,2005;de Chiara et al.,2008;Reilly et al.,2014)。ANP32家族蛋白具有多种生物学功能,如抑制蛋白磷酸化(Habrukowich et al.,2010)、染色体修饰和重构(Tochio et al.,2010;Obri et al.,2014)、细胞凋亡调控(Shen et al.,2010)和病毒复制(Long et al.,2016),以及细胞内物质转运(Fries et al.,2007)等。因此,开展鸡ANP32家族蛋白亚细胞定位及其在免疫器官中的表达特征分析,可为后续探讨鸡ANP32家族蛋白在相关病毒复制中的作用机理提供理论依据。【前人研究进展】ANP32A基因于1994年首次被克隆(Vaesen et al.,1994),随后研究人员基于氨基酸序列相似性、进化保守性和结构相似性定义了ANP32家族其他蛋白成员(Matilla and Radrizzani,2005)。ANP32家族蛋白具有磷酸酶活性,其中ANP32A能有效抑制蛋白磷酸酶2A(Protein phosphatase 2A,PP2A)(Li et al.,1996),可与鞘氨醇相互作用以调节人类内皮细胞中的PP2A活性及环氧合酶-2(COX-2)表达,进而影响细胞内信号传导和炎症反应(Habrukowich et al.,2010)。此外,ANP32A能与突变的人类共济失调蛋白1(Ataxin-1)结合而调节PP2A活性(Sánchez et al.,2013),ANP32E也可抑制PP2A活性(Costanzo et al.,2006),但ANP32B不具备此功能(Sun et al.,2006)。ANP32家族具有调节染色质结构并影响转录过程的功能,其中,ANP32A主要通过电荷作用与组蛋白H3的N末端结合而影响组蛋白H3修饰,进而抑制其乙酰化过程(Schneider et al.,2004);ANP32B与Krüppel样因子5(Krüppel-like factor 5,KLF5)直接相互作用,且被KLF5招募至启动子区域,阻止组蛋白乙酰化,进而抑制转录过程(Munemasa et al.,2008);ANP32E能解离由DNA和组蛋白变体H2A.Z(Histone variant H2A.Z,H2A.Z)形成的非核小体聚集体,因此H2A.Z蛋白可结合在特定的DNA转录位点而调节转录过程(Mao et al.,2014)。ANP32家族蛋白还具有调节细胞内物质转运的功能,ANP32A和ANP32B作为mRNA结合蛋白HuR与核输出受体CRM1间的衔接成分,调节富含腺苷酸元素的mRNA转运(Brennan et al.,2000)。ANP32家族蛋白在病毒的复制中也发挥重要作用。研究发现,ANP32A和ANP32B蛋白是A型流感病毒(Influenza A virus,IAV)复制及其聚合酶活性的决定性宿主因子,ANP32E蛋白不能支持IAV复制,但解析了IAV跨物种传播的分子机制(Zhang et al.,2019,2020);ANP32家族蛋白也是B型流感病毒(Influenza B virus,IBV)聚合酶活性的关键性宿主蛋白,哺乳动物的ANP32A和ANP32B蛋白可单独支持IBV复制,而ANP32E蛋白只起到一定的支持作用,揭示了禽类ANP32家族蛋白无法有效支持IBV聚合酶活性的分子机制(Zhang et al.,2020)。此外,有研究发现ANP32A和ANP32B蛋白对人类艾滋病病毒(Human immunodeficiency virus,HIV)的复制起关键作用,且ANP32A、ANP32B蛋白分别与CRM1和Rev发生相互作用而介导HIV未完全剪切RNA的核输出(Wang et al.,2019)。【本研究切入点】目前,有关ANP32家族蛋白的生物学功能研究主要集中在人类和小鼠上,针对其他物种的研究相对较少。鸡ANP32B蛋白能与新城疫病毒(Newcastle disease virus,NDV)M蛋白发生相互作用,并促进M蛋白在细胞核的聚集(Günther et al.,2020),但鸡ANP32家族蛋白的亚细胞定位、在免疫器官(脾脏、胸腺和法氏囊)中的表达特征及调控NDV复制的作用机制尚不清楚。【拟解决的关键问题】根据GenBank已公布的鸡ANP32家族蛋白基因序列构建其重组真核表达载体,转染细胞后进行融合蛋白表达和亚细胞定位分析,并采用实时荧光定量PCR检测分析ANP32家族蛋白基因在不同月龄鸡免疫器官中的表达特征,为后续研究鸡ANP32家族蛋白与NDV复制及其致病性的关系打下基础。
1 材料与方法
1.1 试验材料
贵州瑶山鸡来自贵州大学种鸡场,在相同条件下进行饲养,随机选取1~6月龄的鸡各3羽,分别采集其免疫器官(脾脏、胸腺和法氏囊)置于-80 ℃冰箱保存备用。真核表达载体pEGFP-C1、大肠杆菌DH5α感受态细胞、鸡胚成纤维细胞(DF-1)、人胚胎肾细胞(HEK-293T)由贵州大学高原山地动物遗传育种与繁殖教育部重点实验室保存提供;2×EsTaqMasterMix(Dye)、抗GFP标签鼠单克隆抗体、山羊抗小鼠IgG(H+L)和HRP购自江苏康为世纪生物科技股份有限公司;Total RNA Kit II R6934试剂盒、Gel Extraction Kit试剂盒及Endo-free Plasmid Mini Kit II试剂盒购自OMEGA公司;T4 DNA连接酶、限制性内切酶(XhoI、KpnI、EcoR I和BamH I)和TurboFect Transfection Reagent 购自Thermo Fisher公司;RIPA细胞裂解液(弱)和增强型ECL显色试剂盒购自碧云天生物技术有限公司;StarScript II反转录试剂和5×SDS-PAGE上样缓冲液购自GenStar公司;2×SYBR Green qPCR Master Mix购自APExBIO公司;PAGE凝胶快速制备试剂盒购自上海雅酶生物医药科技有限公司;胎牛血清及DMEM培养基购自Gibco公司。
1.2 引物设计与合成
根据GenBank已公布的鸡ANP32A基因序列(XM_040680256.1)、ANP32B基因序列(NM_0010 30934.1)、ANP32E基因序列(NM_001006564.2),使用Primer Premier 5.0设计扩增鸡ANP32A、ANP32B和ANP32E基因编码区(CDS)的PCR扩增引物及检测其表达水平的实时荧光定量PCR扩增引物,以β-actin为内参基因。所有引物(表1)均委托重庆擎科兴业生物科技有限公司合成。

表1 PCR扩增和实时荧光定量PCR扩增引物信息Table 1 The primer information of PCR amplification and real-time fluorescence quantitative PCR
1.3 鸡ANP32家族基因重组真核表达载体构建
提取DF-1细胞总RNA并反转录合成cDNA,以cDNA为模板,采用特异性引物分别扩增鸡ANP32家族基因CDS序列。PCR反应体系20.0 μL:2×EsTaqMasterMix(Dye)10.0 μL,上、下游引物各1.0 μL,cDNA模板2.0 μL,ddH2O 6.0 μL。扩增程序:94 ℃预变性2 min;94 ℃30 s,62 ℃30 s,72 ℃30 s,进行30个循环;72 ℃延伸2 min。PCR扩增产物经1%琼脂糖凝胶电泳后,回收目的片段,然后将其与真核表达载体pEGFP-C1分别进行双酶切,再次胶回收后进行连接,并转化DH5α感受态细胞。挑取单菌落扩大培养后进行菌液PCR鉴定,然后提取阳性菌液质粒进行双酶切鉴定,并将鉴定正确的阳性质粒送至重庆擎科兴业生物科技有限公司测序。
1.4 融合蛋白表达检测
将HEK-293T细胞接种于35 mm细胞培养皿中,加入15%胎牛血清培养基,控制细胞初始接种密度为50%,置于5% CO2、37 ℃培养箱中培养,待细胞汇合度达70%~90%时以TurboFect Transfection Reagent将重组真核表达载体和空载体pEGFP-C1分别转染HEK-293T细胞。转染36 h后,采用RIPA细胞裂解液(弱)进行裂解,4 ℃离心收集上清液,加入适量上样缓冲液煮沸后进行SDS-PAGE,然后将蛋白转印至PVDF膜上。使用5%脱脂乳于37 ℃下将PVDF膜封闭2 h,加入1∶1500稀释的抗GFP标签鼠单克隆抗体4 ℃孵育16 h;TBST洗3次,再加入1∶2000稀释的山羊抗小鼠IgG(H+L)37 ℃孵育2 h;TBST洗3次,使用增强型ECL显色剂进行显色。
1.5 融合蛋白亚细胞定位分析
按照1.4的方法,将重组真核表达载体和空载体pEGFP-C1分别转染HEK-293T细胞,转染36 h后以PBS洗涤3次,加入预冷的4%多聚甲醛固定20 min;PBS洗涤3次,加入0.25%TritonX-100室温作用5 min;PBS洗涤3次,再加入DAPI进行细胞核染色;PBS洗涤3次,将细胞置于正置荧光显微镜下采集荧光照片。荧光照片采用Photoshop进行Merge处理,根据融合蛋白荧光与细胞核荧光的重叠情况,判断融合蛋白的亚细胞定位情况。
1.6 实时荧光定量PCR检测鸡ANP32家族基因表达情况
采用实时荧光定量PCR检测ANP32家族基因在1、2、3、4、5和6月龄鸡免疫器官中的表达情况,以β-actin为内参基因。实时荧光定量PCR反应体系20.0 μL:cDNA模板1.0 μL,上、下游引物各0.5 μL,2×SYBR Green qPCR Master Mix 10.0 μL,ROX染料0.4 μL,ddH2O 7.6 μL。扩增程序:95 ℃预变性2 min;95 ℃15 s,退火40 s,72 ℃30 s,进行40个循环。熔解曲线程序为仪器默认设置,每个样品设3个重复。
1.7 统计分析
试验数据采用Excel 2019进行处理,以6月龄脾脏为对照,通过2-ΔΔCt法计算鸡ANP32家族基因相对表达量,并以SPSS 25.0进行单因素方差分析(Oneway ANOVA)。
2 结果与分析
2.1 鸡ANP32家族基因重组真核表达载体鉴定结果
以DF-1细胞总RNA反转录合成的cDNA为模板,采用特异性引物扩增鸡ANP32家族基因CDS序列,电泳检测结果显示扩增获得的目的基因片段大小(图1)与预期结果相符。对构建的重组真核表达载体进行单酶切和双酶切鉴定,结果表明,重组真核表达载体pEGFP-C1-ANP32A、pEGFP-C1-ANP32B和pEGFP-C1-ANP32E经单酶切后均得到约5500 bp的载体条带,而经双酶切后获得4700 bp的载体条带及与预期结果相符的目的基因条带(图2)。测序结果表明,鸡ANP32A、ANP32B和ANP32E基因均正确插入到真核表达载体pEGFP-C1的多克隆位点区域,且未发生基因突变和开放阅读框移码,即重组真核表达载体构建成功。
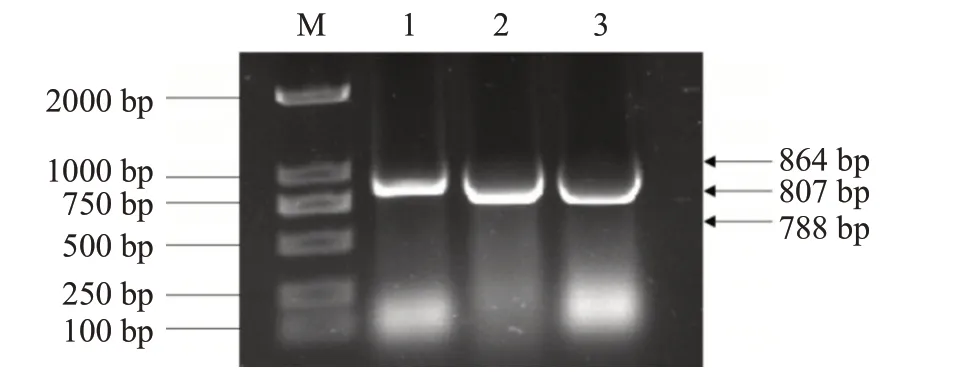
图1 鸡ANP32家族基因CDS序列PCR扩增电泳结果Fig.1 PCR amplification electrophoresis of chicken ANP32 family gene CDS sequence
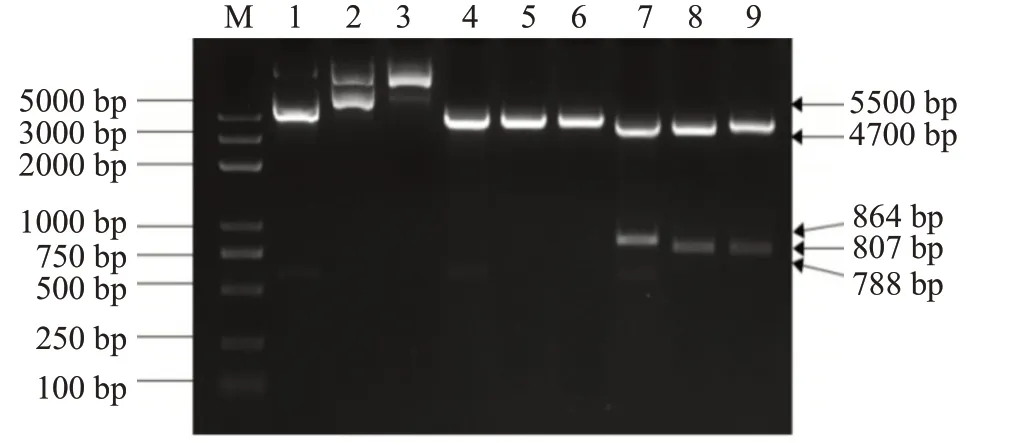
图2 鸡ANP32家族基因重组真核表达载体酶切鉴定结果Fig.2 Enzyme digestion identification of recombinant eukaryotic expression vector of chicken ANP32 family gene
2.2 鸡ANP32家族基因融合蛋白表达分析结果
为检测构建的鸡ANP32家族基因重组真核表达载体在细胞中是否正确表达,将空载体pEGFP-C1和重组真核表达载体(pEGFP-C1-ANP32A、pEGFP-C1-ANP32B和pEGFP-C1-ANP32E)分别转染HEK-293T细胞并进行Western blotting检测。结果显示:在细胞中诱导表达的标签蛋白EGFP及融合蛋白EGFPANP32A、EGFP-ANP32B和EGFP-ANP32E,经Western blotting检测均得到与预期结果相符的蛋白条带(图3),从左到右蛋白大小依次为28.0、60.0、57.9和56.9 kD,对应的融合蛋白ANP32A、ANP32B、ANP32E分子量分别为32.0、29.9和28.9 kD。说明鸡ANP32家族基因融合蛋白在HEK-293T细胞中正确表达。

图3 鸡ANP32家族基因融合蛋白Western blotting检测结果Fig.3 Western blotting results of chicken ANP32 family gene fusion proteins1:标签蛋白EGFP;2:融合蛋白EGFP-ANP32A;3:融合蛋白EGFPANP32B;4:融合蛋白EGFP-ANP32E1:Tag protein EGFP;2:Fusion protein EGFP-ANP32A;3:Fusion protein EGFP-ANP32B;4:Fusion protein EGFP-ANP32E
2.3 鸡ANP32家族基因融合蛋白亚细胞定位分析结果
为确定鸡ANP32家族基因融合蛋白亚细胞定位情况,将空载体pEGFP-C1和重组真核表达载体(pEGFP-C1-ANP32A、pEGFP-C1-ANP32B和pEGFP-C1-ANP32E)分别转染HEK-293T细胞,经细胞固定、破膜及细胞核染色后进行荧光观察。结果(图4)显示:标签蛋白EGFP呈绿色,其细胞核呈蓝色,二者的荧光不完全重合,因此标签蛋白EGFP定位在细胞核和细胞质;而融合蛋白EGFPANP32A、EGFP-ANP32B和EGFP-ANP32E的荧光与细胞核荧光完全重合,即主要定位在细胞核。

图4 鸡ANP32家族基因融合蛋白亚细胞定位分析结果(100×)Fig.4 Subcellular localization analysis of fusion proteins of chicken ANP32 family genes(100×)
2.4 ANP32家族基因在不同月龄鸡免疫器官中的表达特征
2.4.1ANP32A基因在不同月龄鸡免疫器官中的表达特征 如图5所示,ANP32A基因在1~6月龄鸡免疫器官中均有表达,且在不同免疫器官中的表达水平存在差异。ANP32A基因在不同月龄鸡脾脏、胸腺和法氏囊中的相对表达量整体上均呈先上升后下降的变化趋势,且以2月龄鸡免疫器官中的相对表达量最高。其中,2月龄鸡脾脏中的ANP32A基因相对表达量比3月龄极显著提高1.6倍(P<0.01,下同),比4~6月龄极显著提高6.9~10.9 倍;2 月龄鸡胸腺中的ANP32A基因相对表达量比1月龄极显著提高1.6倍,比3月龄极显著提高2.6倍,比4~6月龄极显著提高8.3~18.8倍;2月龄鸡法氏囊中的ANP32A基因相对表达量比1月龄极显著提高3.4倍,比3~6月龄极显著提高5.3~14.5倍。
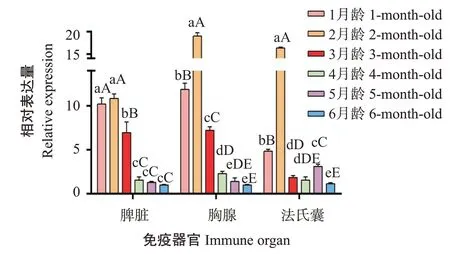
图5 ANP32A基因在1~6月龄鸡免疫器官中的表达特征Fig.5 Expression analysis of ANP32A gene in immune organs of 1-to 6-month-old chicken
2.4.2ANP32B基因在不同月龄鸡免疫器官中的表达特征 如图6所示,ANP32B基因在1~6月龄鸡免疫器官中均有表达,且在不同免疫器官中的表达水平存在差异。ANP32B基因在不同月龄鸡脾脏、胸腺和法氏囊中的相对表达量整体上呈逐渐下降的变化趋势。其中,1月龄鸡脾脏中的ANP32B基因相对表达量比2月龄极显著提高1.7倍,比3~4月龄极显著提高3.5~3.6倍,比5~6月龄极显著提高14.4~16.8倍;1月龄鸡胸腺中的ANP32B基因相对表达量比3月龄极显著提高2.2倍,比4~6月龄极显著提高4.9~31.3倍;1月龄鸡法氏囊中的ANP32B基因相对表达量比2月龄极显著提高2.8倍,比3~6月龄极显著提高9.4~20.1倍。
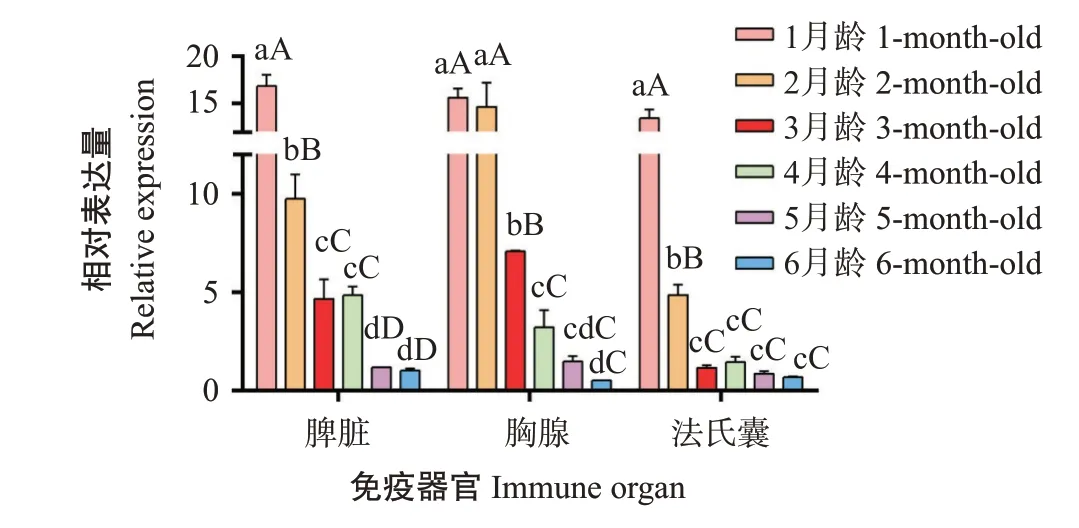
图6 鸡ANP32B基因在1~6月龄免疫器官中的表达特征Fig.6 Expression analysis of ANP32B gene in immune organs of 1-to 6-month-old chicken
2.4.3ANP32E基因在鸡不同月龄免疫器官中的表达特征 如图7所示,ANP32E基因在1~6月龄鸡免疫器官中也均有表达,且在不同免疫器官中的表达水平存在差异。ANP32E基因在不同月龄鸡脾脏和法氏囊中的相对表达量整体上呈先上升后下降的变化趋势,均以2月龄鸡免疫器官中的相对表达量最高,而在不同月龄鸡胸腺中的相对表达量整体上呈逐渐下降趋势。其中,2月龄鸡脾脏中的ANP32E基因相对表达量比4月龄极显著提高3.4倍,比1月龄和3月龄极显著提高5.4和5.6倍,比5~6月龄极显著提高54.7~61.9倍;1月龄鸡胸腺中的ANP32E基因相对表达量比2~4月龄极显著提高2.3~4.8倍,比5~6月龄极显著提高28.8~31.7倍;2月龄鸡法氏囊中的ANP32E基因相对表达量比1月龄极显著提高1.7倍,比3~6月龄极显著提高21.2~132.4倍。
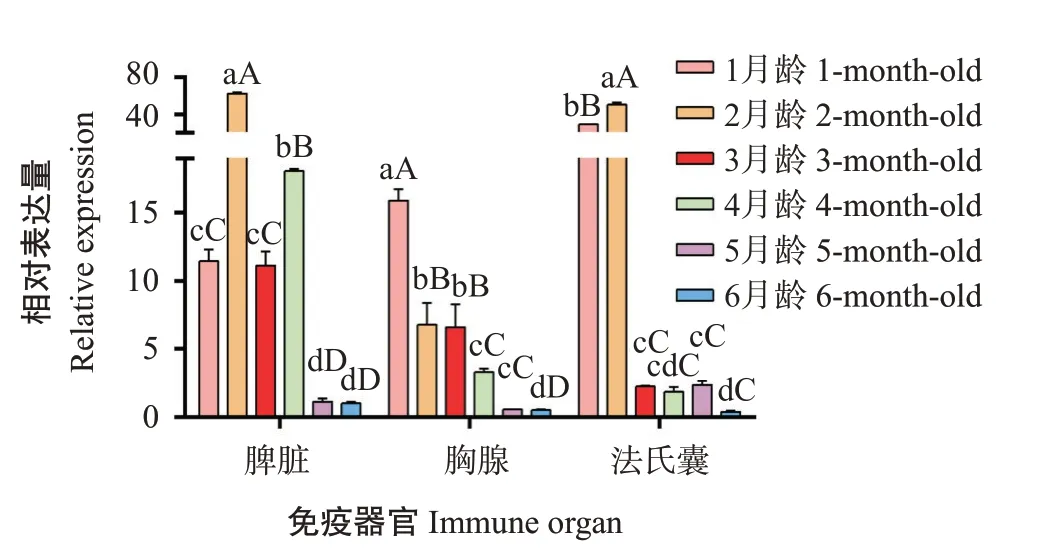
图7 鸡ANP32E基因在1~6月龄免疫器官中的表达特征Fig.7 Expression analysis of ANP32E gene in immune organs of 1-to 6-month-old chicken
3 讨论
ANP32家族蛋白成员共有5个,分别是ANP32A、ANP32B、ANP32C、ANP32D和ANP32E,由于ANP32C和ANP32D是由内含子编码通常被认为是假基因,因此对该家族蛋白的研究主要集中在ANP32A、ANP32B和ANP32E(Matilla and Radrizzani,2005)。ANP32家族蛋白成员间具有相似的结构特征,其C端第246~260位氨基酸间包含特定的核定位信号KRKR,介导其完成入核转运(Matsubae et al.,2000);而N端的LCAR结构与核输出蛋白CRM1相互作用,介导其完成出核转运,即ANP32家族蛋白是一种细胞核—细胞质穿梭蛋白。在ANP32家族蛋白核质穿梭功能研究方面,Opal等(2004)研究发现,ANP32A在神经系统中高度表达且其细胞定位与神经元分化存在一定关联,即在神经元轴突形成过程中ANP32A从细胞核迁移至细胞质,而在未分化的小鼠脑神经母细胞瘤细胞(neuro-2a)中ANP32A主要定位于细胞核,分化后则分布于细胞质和轴突。此外,ANP32A作为细胞凋亡增强因子,可通过刺激凋亡小体而激活Caspase,在细胞凋亡过程中从细胞核转移至细胞质(Pan et al.,2009)。ANP32B在G1期和S期特异性表达,且在S期聚集在细胞核中(Sun et al.,2001)。刘思瑶(2021)研究表明,ANP32B在乳腺癌MCF7细胞分裂间期主要定位于细胞核,在分裂期则弥散性分布于细胞质。关于ANP32E的细胞定位至今未见相关报道。本研究通过构建鸡ANP32家族基因重组真核表达载体并转染HEK-293T细胞,诱导表达获得的融合蛋白ANP32A、ANP32B和ANP32E主要定位于细胞核,该结了为进一步研究鸡ANP32家族蛋白细胞核定位的分子机制及组织内定位功能研究打下了基础。
ANP32家族蛋白在人类和小鼠的生长发育过程中发挥着重要作用。ANP32A在脑组织中的表达最丰富,且在成人脑组织不同区域的分布存在显著差异,在小脑、颞叶和大脑皮层呈高表达,而在脑桥、延髓和脊髓呈低表达;且在成年大脑的表达水平高于幼年(Wang et al.,2015)。因此,ANP32A基因在大脑组织中的分布及表达水平提示着ANP32A可能在哺乳动物大脑发育过程中发挥重要作用。此外,ANP32A基因在小鼠的心脏、肝脏、脾脏和肺脏组织中均有表达,但幼龄小鼠的表达量显著低于成年小鼠,即ANP32A基因在组织中的表达差异与年龄有关(王跃群,2016)。有关ANP32B和ANP32E的组织表达特征研究表明,ANP32B基因在小鼠免疫器官(脾脏、胸腺)中的表达水平高于脑组织(Reilly et al.,2011);ANP32E基因中在小鼠小脑中高表达,且在小鼠出生后第7 d的相对表达量最高,在成熟小鼠小脑中不表达(Radrizzani et al.,2001)。本研究对ANP32家族基因在不同月龄鸡免疫器官(脾脏、胸腺、法氏囊)中的表达水平进行检测,结果发现ANP32家族基因在鸡不同免疫器官中均有表达,但ANP32A和ANP32E基因在1~6月龄鸡免疫器官中呈先上升后下降的表达趋势,且在2月龄免疫器官中的相对表达量达峰值;ANP32B基因的表达则呈下降趋势。可见,ANP32家族基因在鸡免疫器官中具有独特的表达特征,其表达差异与免疫器官发育及免疫功能间的关系有待进一步探究。
近年来,ANP32家族蛋白除了具有在细胞内的已知生物学功能外,大量研究还发现其与病毒复制存在联系(Wang et al.,2019;Zhang et al.,2019,2020)。ANP32A和ANP32B能与流感病毒聚合酶RdRP三亚基聚合体发生相互作用,促进流感病毒感染细胞后的cRNA-vRNA合成(Sugiyama et al.,2015)。此外,ANP32B蛋白能与NDV、尼帕病毒及仙台病毒等副黏病毒M蛋白发生相互作用,促进M蛋白在细胞核中的积累,即在副黏病毒的复制过程中发挥重要作用(Duan et al.,2020;Günther et al.,2020)。鉴于ANP32家族蛋白成员能参与调节病毒复制,其在家禽相关病毒如禽流感病毒和NDV复制中的作用机制值得深入研究。因此,今后应对NDV感染后鸡免疫器官中的ANP32家族基因表达水平进行监测,并从细胞水平深入解析其调控NDV复制的作用机制,为后续开展NDV致病分子机制打下基础。
4 结论
鸡ANP32家族蛋白主要定位于细胞核,且ANP32家族基因在不同月龄鸡免疫器官中均有表达,但这3个基因具有独特的表达特征,其表达差异与免疫器官发育及免疫功能间的关系有待进一步探究。
