高繁殖力和低繁殖力长白公猪的精子DFI差异分析
2022-03-18杨凯琳胡家豪司景磊陈献欣郑启源陆阳清许常龙
杨凯琳,胡家豪,司景磊,陈献欣,郑启源,田 奎,张 浪,陆阳清*,许常龙
(1广西大学动物科学技术学院,广西 南宁 530004;2广西农垦永新畜牧集团有限公司,广西 南宁 530300;3南宁市第二人民医院生殖医疗中心,广西 南宁 530031)
0 引言
【研究意义】目前大部分种猪场采用人工授精(Artificial insemination,AI)进行配种,旨在充分发挥种公猪的使用效率。种公猪精液品质直接影响其繁殖性能及与配母猪的产仔数量和质量,与猪场的经济效益紧密相关(王洋等,2019)。在实际生产中,精液的常规参数(采精量、精子密度和精子活力等)只能对公猪精液品质及其繁殖力进行部分评估(Myromslien et al.,2019),人工授精所用精液品质评估不全面,通常会导致与配母猪的产仔率降低,而畸胎率和死胎率升高。因此,严格筛选优质的公猪精液对提高母猪活产仔数及保障猪场经济效益具有重要意义。【前人研究进展】为全面评估精子质量,精子DNA碎片检测等手段为深度评估种公猪繁殖力提供了技术支撑。精子DNA碎片是由精子DNA损伤引起(Sakkas and Alvarez,2010),通常以精子DNA碎片指数(DNA fragmentation index,DFI)表示精子DNA完整性,高DFI表明染色质结构异常(Evenson and Jost,2000)。据报道,精子DNA完整性降低会对精子质量和胚胎发育产生影响(McQueen et al.,2019;Mateo-Otero et al.,2022)。目前,分析精子DNA完整性最常用的方法有缺口末端标记法(TUNEL)、精子染色质结构分析(SCSA)及精子染色质扩散试验(SCD)(Sakkas and Alvarez,2010)。SCSA可通过流式细胞术评估精子DNA碎片化(Evenson et al.,1994),其原理是利用吖啶橙(AO)染料的异染性,与双链DNA(dsDNA)结合时发出绿色荧光,与单链DNA(ssDNA)结合时发出红色荧光。SCSA已广泛应用于不同物种的精子质量评估,对物种繁育情况具有较高的评估潜力。Love(2005)研究认为,在相同精液储存条件下,低繁殖力种马精子DNA碎片率升高的速度较高繁殖力种马快;Tsakmakidis等(2012)的研究结果表明,青年公猪的精子DNA不稳定性显著高于成年公猪,但与老年公猪无显著差异;Bielas等(2017)研究发现波兰大白公猪的精子DFI与精子活率及活力呈负相关;Morrell等(2018)对肉牛和奶牛的精子进行质量评估,结果发现奶牛精子DNA完整性高于肉牛。【本研究切入点】精子DFI检测作为进一步评估精液品质的补充方法,能有效预测种公猪的繁殖潜力,但至今鲜见针对长白公猪繁殖力与精子DFI相关的研究报道。【拟解决的关键问题】以高繁殖力和低繁殖力的法系长白种公猪为研究对象,统计分析其与配母猪的繁育数据,利用计算机辅助精子分析系统(CASA)对精液品质进行常规参数评估分析,并对精子DNA碎片进行流式细胞仪检测,分析不同产仔数的公猪精子DFI差异,为筛选出高繁殖力种公猪提供参考依据,进而优化猪场人工授精工作及提高种猪场的经济效益。
1 材料与方法
1.1 试验材料
供试的12头种公猪均来自广西南宁种猪场,为具有完整繁育记录的法系长白公猪(23~40月龄)。每头种公猪隔4~6 d采精1次,固定采精时间及采精员。繁育数据分析所选每头种公猪与配母猪的配种分区、配种舍及配种方式保持一致,且保证单一公猪配种,公猪和母猪的健康状况良好。主要仪器设备及试剂耗材:光学显微镜和精子分析仪购自MOFA公司,恒温箱购自北京福意联医疗设备有限公司,流式细胞仪(CytoFLEX)购自美国Beckman Coulter公司,采精袋和一次性精子计数玻片购自德国Minitube公司,全能健猪精液稀释粉购自日本ZENOAQ公司,精子核完整性染色试剂盒购自浙江星博生物科技股份有限公司,活性氧检测试剂盒购自上海碧云天生物技术有限公司。
1.2 试验方法
1.2.1 公猪精液采集与稀释 公猪精液样本通过假母台法采取,并以采精袋收集,让精液自然流过滤网,弃上层过滤袋,然后在精液袋贴上公猪ID及采精员标签,即完成原精液采集。根据采精量、精子密度等计算稀释头份(30亿精子/80 mL),按稀释头份将稀释液沿着盛放精液的杯子内壁缓慢注入,并轻轻搅拌均匀。稀释好的精液降温2 h后,置于17 ℃恒温箱保存备用。
1.2.2 精液品质检测 吸取2.5 μL稀释精液样本加入到精子计数玻片的点样区域,通过CASA对公猪精液品质进行检测分析,包括采精量、精子密度、精子活力、精子畸形率及精子运动参数等。
1.2.3 精子DFI测定 利用SCSA对精子DFI进行测定,首先向稀释好的精液中加入100 μL精子核完整性染色试剂盒中的A液,稀释至1×106精子/mL,然后加入200 μL B液反应30 s,最后加入600 μL C液进行染色处理,孵育5 min后上流式细胞仪检测。采集FITC和PC5.5通道的荧光信号,分别代表dsDNA(绿色)和ssDNA(红色)的荧光强度,DFI以红色/(红色+绿色)的荧光比百分数表示。
1.2.4 精子活性氧(ROS)测定 先取适量稀释好的精液样本进行离心处理(400×g,10 min),弃上清液,保留精子细胞沉淀;然后加入适量PBS,稀释至1×106精子/mL,离心(600×g,5 min)洗涤精子,收集精子细胞沉淀。吸取1 μL DCFH-DA探针加入1 mL PBS进行稀释,37 ℃孵育20 min后以PBS洗涤(600×g离心3 min)3次。精子中的ROS能将无荧光的DCFH氧化成具有绿色荧光的DCF,因此可通过流式细胞仪检测绿色荧光精子细胞比例。
1.3 统计分析
利用GraphPad Prism 7.0进行统计学分析,并通过t检验进行显著性检验。
2 结果与分析
2.1 高繁殖力和低繁殖力长白公猪繁育性能分析结果
为区分高繁殖力和低繁殖力公猪,选取12头法系长白公猪,对与配母猪繁育数据进行统计分析,平均窝产仔数高于13.50头判定为高繁殖力公猪,平均窝产仔数低于13.50头则为低繁殖力公猪,确定高繁殖力组和低繁殖力组公猪各6头。表1为高繁殖力和低繁殖力长白公猪的具体繁育数据。如图1所示,高繁殖力公猪的平均窝产仔数和活产仔数均极显著高于低繁殖力公猪(P<0.01,下同),但二者的畸胎数和死胎数差异不显著(P>0.05,下同)。
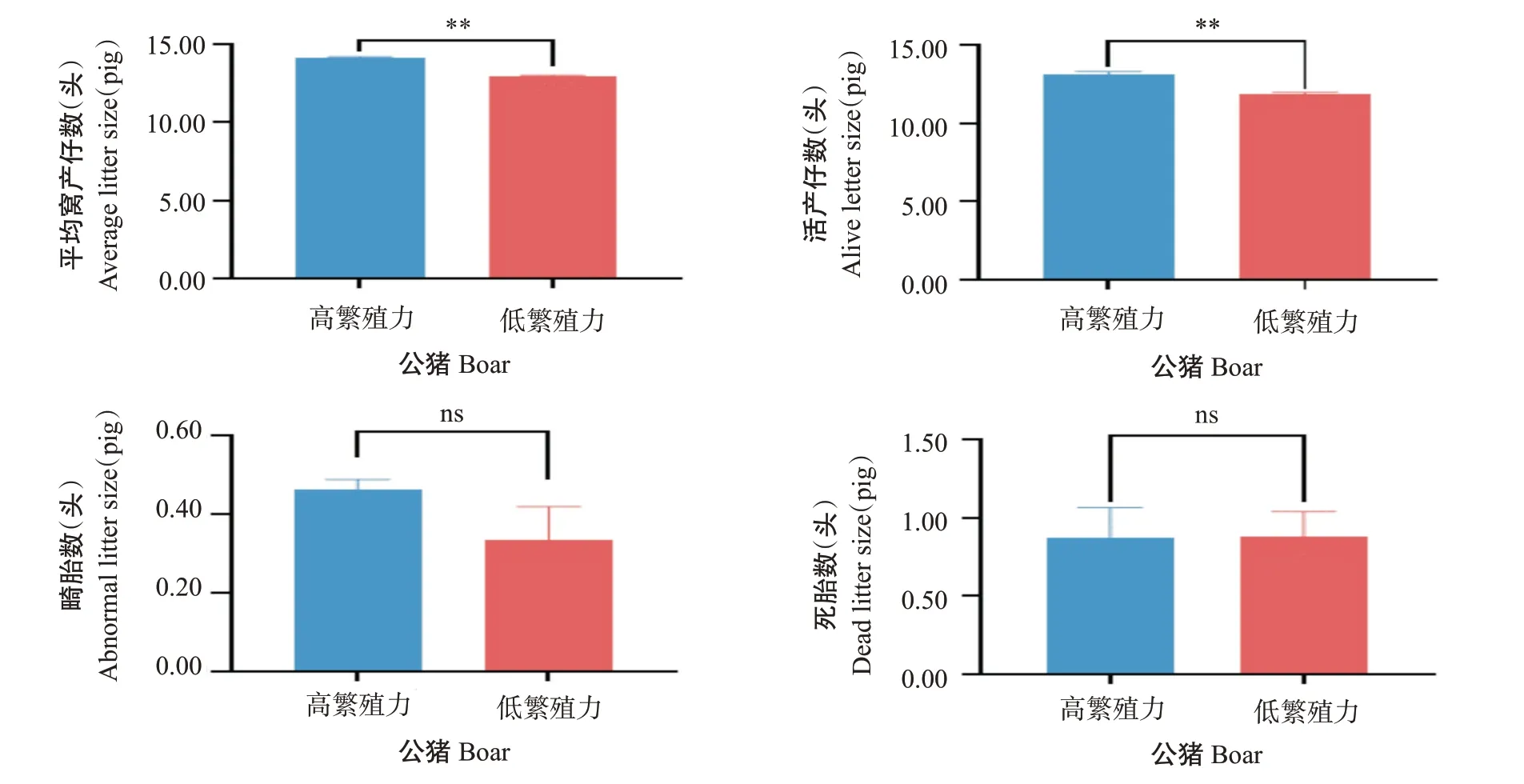
图1 高繁殖力和低繁殖力长白公猪繁育性能的比较Fig.1 Reproductive data analysis and statistics of Landrace boars with high and low reproductive performance
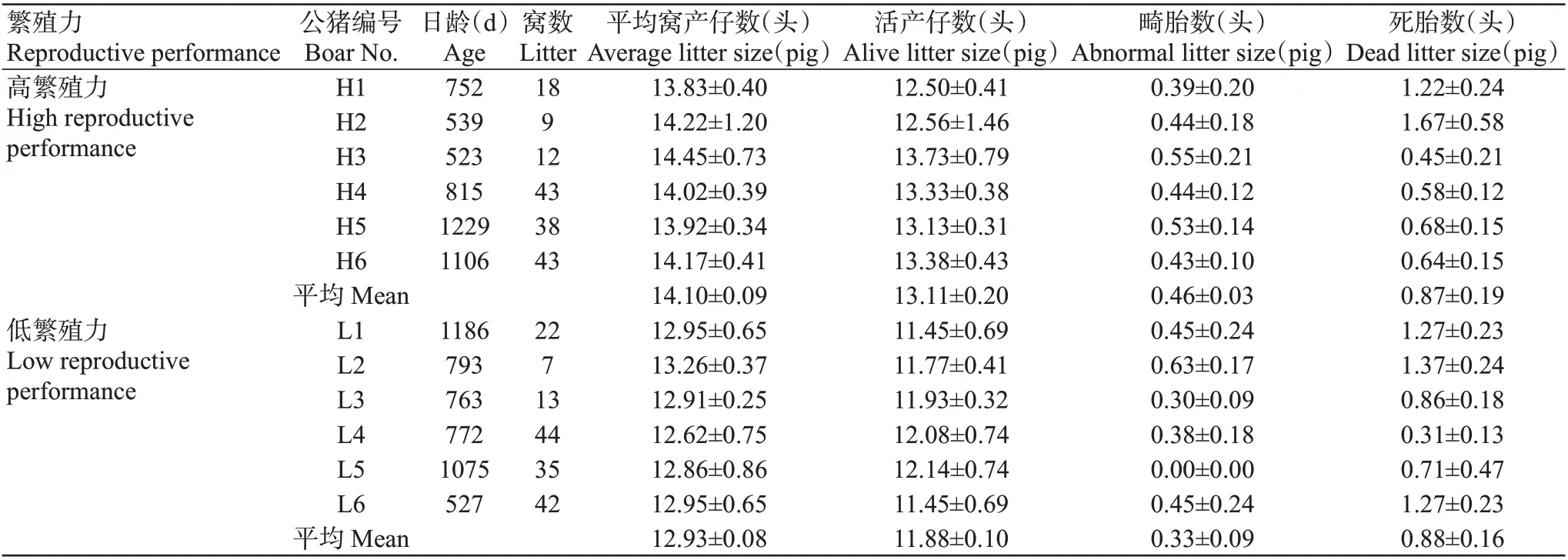
表1 高繁殖力和低繁殖力长白公猪的繁育数据Table 1 Reproductive data of Landrace boars with high and low reproductive performance
2.2 高繁殖力和低繁殖力长白公猪精液品质分析结果
为了比较高繁殖力和低繁殖力公猪的精液品质,对12头供试长白公猪各采精35次,通过CASA对其精液品质进行分析。由图2可看出,高繁殖力公猪的精子运动摆尾幅度较低繁殖力公猪精子的大。在采精量、精子密度和精子活力方面,高繁殖力公猪与低繁殖力公猪间的差异均不显著(表2),但高繁殖力公猪精子的前进运动率显著高于低繁殖力公猪精子(89.86±3.11 vs 78.10±3.85)(P<0.05,下同),且低繁殖力公猪精子畸形率极显著高于高繁殖力公猪(0.12±0.01 vs 0.08±0.01)。
图2 高繁殖力和低繁殖力长白公猪精子的CASA分析图像Fig.2 CASA analysis image of sperm of Landrace boars with high and low reproductive performance
2.3 高繁殖力和低繁殖力长白公猪精子畸形参数分析结果
由表2已知低繁殖力公猪精子畸形率极显著高于高繁殖力公猪,为进一步明确二者间的精子畸形差异,对其畸形参数进行比较分析,但结果(表3)显示高繁殖力和低繁殖力公猪精子在近端原生质滴率、远端原生质滴率及折尾率等方面的差异均不显著。

表2 高繁殖力和低繁殖力长白公猪的精液品质比较Table 2 Semen quality comparison of Landrace boars with high and low reproductive performance
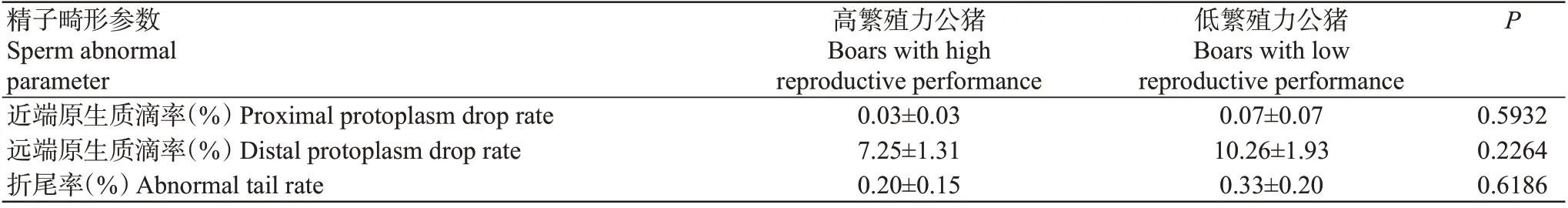
表3 高繁殖力和低繁殖力长白公猪的精子畸形参数比较Table 3 Sperm abnormal parameters comparison of Landrace boars with high and low reproductive performance
2.4 高繁殖力和低繁殖力长白公猪精子运动参数分析结果
通过CASA分析得到高繁殖力和低繁殖力公猪的精子运动参数(表4),除了高繁殖力公猪精子的曲线速率(VCL)显著高于低繁殖力公猪(131.10±3.79 vs 116.10±4.12)外,其他的运动参数均无显著差异。

表4 高繁殖力和低繁殖力长白公猪的精子运动参数比较Table 4 Sperm motility parameters comparison of Landrace boars with high and low reproductive performance
2.5 高繁殖力和低繁殖力长白公猪精子DFI与ROS水平差异分析结果
为了比较高繁殖力和低繁殖力公猪的精子DFI差异,采用染色质结构分析结合流式细胞仪检测长白公猪精子DFI,结果(表5和图3)显示,高繁殖力公猪的精子DFI极显著低于低繁殖力公猪(0.80±0.04 vs 1.65±0.12)。同时通过流式细胞仪对精子细胞进行DCF荧光强度检测,对比分析高繁殖力和低繁殖力公猪精子ROS水平差异,结果(表5和图4)显示,高繁殖力公猪的精子ROS水平也极显著低于低繁殖力公猪(1.00±0.08 vs 2.03±0.19)。
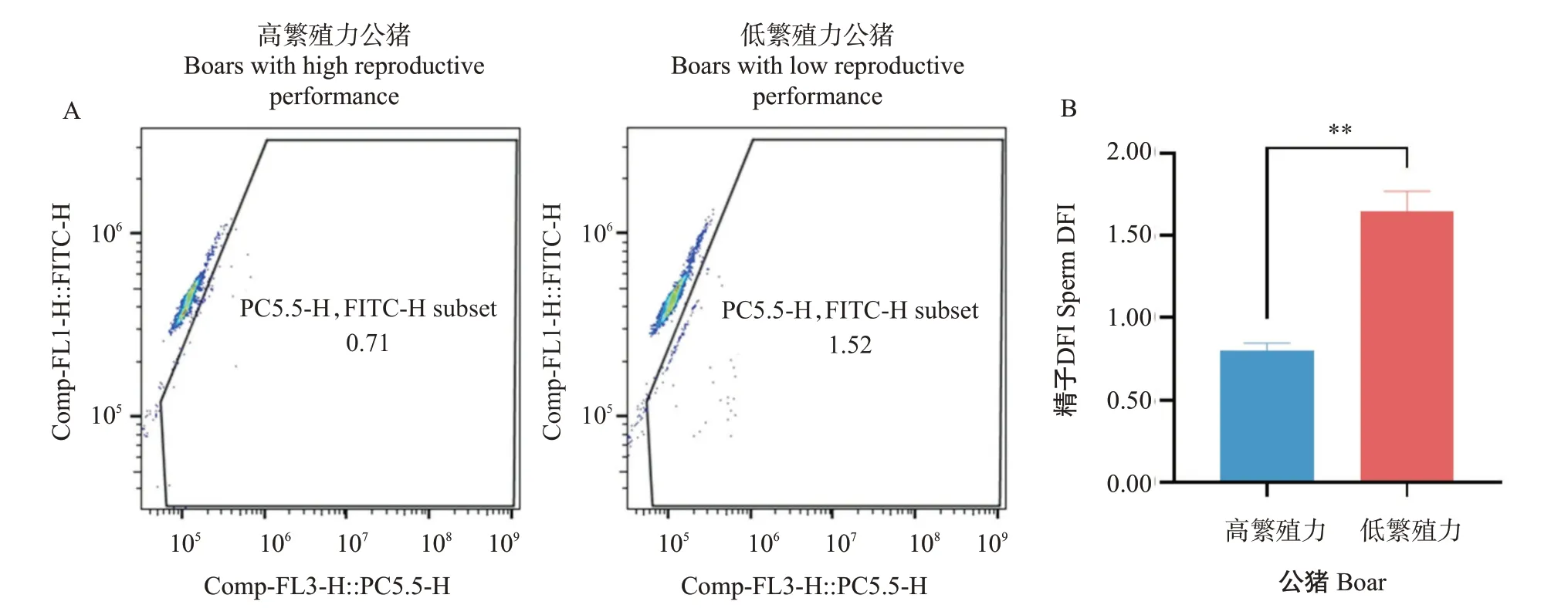
图3 高繁殖力和低繁殖力长白公猪的精子DFI分析结果Fig.3 Sperm DFI data analysis of Landrace boars with high and low reproductive performance

图4 高繁殖力和低繁殖力长白公猪的精子ROS水平分析结果Fig.4 Sperm ROS level analysis of Landrace boars with high and low reproductive performance

表5 高繁殖力和低繁殖力长白公猪的精子DFI与ROS水平比较Table 5 Sperm DFI and ROS level comparison of Landrace boars with high and low reproductive performance
2.6 长白公猪产仔数与各精液质量参数的相关性
长白公猪产仔数与各项精液质量参数的相关分析结果如图5所示。公猪产仔数与精子DFI呈高度负相关(r=-0.85)、与精子畸形率(r=-0.70)和精子ROS水平(r=-0.78)呈中度负相关;公猪精子畸形率与精子DFI(r=0.63)和ROS水平(r=0.62)呈中度正相关;精子DFI与ROS水平呈高度正相关(r=0.93)。公猪日龄与精子DFI、产仔数不存在相关性,且其他精液质量参数与产仔数间的相关性也较弱或不存在相关性。
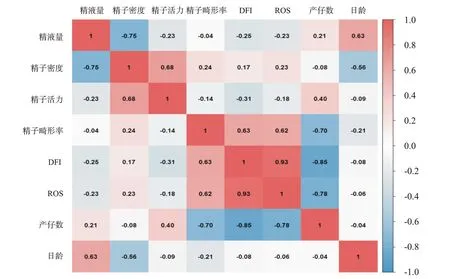
图5 长白公猪产仔数与精液质量参数的相关性Fig.5 Correlation between litter size and semen quality parameters of Landrace boars
3 讨论
评估公猪繁殖效率对于优化种猪生产中的人工授精技术流程具有重要意义,而精液品质决定了公猪的繁殖效率(Foote,2003;陈集成等,2022)。传统的精液品质检测对评估公猪繁育性能存在一定局限性,CASA分析和精子DFI检测能辅助传统检测技术,实现对公猪繁育性能进行更全面、更客观、更科学地评估。人工授精站通常利用CASA分析精子的各种运动特征,以提高精液品质和精子运动力评估的准确性和客观性(Kummer et al.,2013)。其中,VCL和平均路径速率(VAP)等参数能有效反映精子活力,精子的运动速度分级主要由VCL决定。本研究结果显示,高繁殖力长白公猪精子的VCL显著高于低繁殖力长白公猪,二者的精子活力虽然无显著差异,但呈现精子活力越高其产仔数越多的变化趋势,与张军荣等(2015)的研究结果一致,即VCL与精子活力密切相关。
DNA是精子遗传信息的重要载体,主要位于精子头部,部分位于线粒体鞘,若精子DNA受损伤则导致精子功能缺陷。本研究结果表明,高繁殖力和低繁殖力长白公猪的精子DFI均处于较低水平(0.70%~2.22%),平均为1.18%,与Batista等(2016)、Bielas等(2017)的研究结果基本一致,即公猪精子DFI均低于5%。由于现有的研究尚未对公猪精子DFI进行阈值划定,因此本研究仅依据高、低繁殖力公猪的精子DFI数据进行分组,二者间存在显著差异。Bungum等(2007)曾研究报道,精子DNA损伤会改变精子的运动及形态。本研究对长白公猪精子DFI与精液品质参数的相关分析结果表明,公猪精子畸形率与精子DFI呈中度正相关(r=0.63),与黄学锋等(2010)、孙超等(2011)、龚道元等(2012)的研究结果基本一致,即精子DFI与正常形态率呈负相关。
精子DNA受损最终导致受精率下降和雄性不育(谭艳和范立青,2017)。本研究通过分析高繁殖力和低繁殖力长白公猪的繁育性能和精子DFI,以评估精子DFI对公猪繁殖力的影响,结果表明,低精子DFI公猪与配母猪的平均窝产仔数为14.10头、平均活产仔数为13.11头,分别显著高于高精子DFI公猪与配母猪的平均窝产仔数(12.93头)和平均活产仔数(11.88头);相关分析结果也显示长白公猪产仔数与精子DFI呈高度负相关。因此,推测公猪精子DNA损伤会导致与配母猪的产仔数下降,与Mateo-Otero等(2022)的研究结果一致。Boe-Hansen等(2008)对汉普夏猪、丹麦大白猪和长白猪的研究发现,精子DFI<1.5%及1.5%<DFI<3.0%的公猪产仔数明显高于精子DFI>3.0%的公猪,接近于每窝减少1头仔猪的差异,其产仔数差异对猪场经济效益影响显著。
目前,有关精子DNA损伤的产生机制主要有3种:组蛋白—鱼精蛋白转变失败、氧化应激和细胞异常凋亡。其中,氧化应激是导致精子DNA损伤的主要原因,过量的ROS会导致氧化还原失衡,造成DNA单链或双链断裂(Muratori et al.,2015)。Barroso等(2000)研究发现,DNA片段化与ROS的产生呈显著正相关。本研究结果也表明,精子DFI与ROS水平呈高度正相关(r=0.93),且低精子DFI的公猪精子ROS水平显著低于高精子DFI的公猪,即氧化应激导致精子DNA损伤。Ren等(2020)研究发现,在公猪冷冻精液中加入抗氧化剂NR1能减少ROS产生,提高公猪精子质量及产仔率。Rodríguez-Tobón等(2021)评估谷胱甘肽(GSH)作为抗氧化剂对公猪精子及体外受精后胚胎发育的作用,结果表明,低浓度GSH可平衡ROS的产生,防止因过多ROS而降低精子活力和破坏顶体完整性,有效提高囊胚率。本研究也发现,高繁殖力公猪的精子ROS水平极显著低于低繁殖力公猪,结合精子DFI与ROS水平呈正相关的结论,可以确定精子ROS水平过高会导致公猪精子DFI升高,进而降低公猪产仔率。
4 结论
精子DNA碎片化与公猪繁殖力密切相关,即精子DFI可为评估公猪精液品质及繁殖力提供重要参考依据。因此,在筛选种公猪时精子DFI检测可作为公猪精子质量评估的补充手段,以协同人工授精技术提高受精率及猪场经济效益,进而推动养猪业的高质量发展。
