棉花黄萎病相关基因GhMYB6的克隆与功能分析
2022-03-18代培红胡子曜李秀青雷建峰刘晓东
代培红,胡子曜,李秀青,雷建峰,刘 超,刘晓东,李 月*
(1新疆农业大学生命科学学院,新疆 乌鲁木齐 830052;2新疆农业大学农学院/教育部棉花工程研究中心/农业生物技术重点实验室,新疆 乌鲁木齐 830052)
0 引言
【研究意义】棉花(Gossypium hirsutumL)是我国重要的经济作物,易受到病虫害的危害,特别是黄萎病菌,严重影响其正常生长发育、制约纤维品质和产量(Wang et al.,2020)。目前最有效的黄萎病菌防控措施是选育抗病棉花品种,但由于陆地棉资源比较匮乏,采用传统方法选育抗病品种难度较大。因此,越来越多的研究人员借助转录组学、遗传学、基因组学等技术开展相关分子育种工作。转录因子通过调节相关防御相关基因的转录,并与其他调控因子的相互作用,在植物抵御病原体中扮演重要角色。MYB转录因子是植物中最大的一类转录因子家族,可通过调控抗逆相关基因的表达,参与抗病原体攻击的防御(朱英洁等,2021)。因此,开展棉花黄萎病相关的MYB转录因子基因克隆及功能分析,对筛选并培育棉花抗病新品种具有重要意义。【前人研究进展】自Paz-Ares等(1987)从玉米中鉴定出第一个MYB转录因子ZmMYBC1后,大量MYB家族基因从不同植物中相继被克隆出来,研究发现该家族基因在植物的新陈代谢、生长发育及抵御各种逆境胁迫中均发挥重要的调控作用。Ramírez等(2011)研究发现,AtMYB46负调节拟南芥抵抗灰霉病,是灰霉病菌的敏感调节因子。Meng等(2018)研究发现,抑制苹果MdMYB39L基因表达后,雄蕊的发育和花粉管的生长受到显著抑制。Zhao等(2018)研究发现,在拟南芥中过表达小麦TaMYB80基因后降低了转基因植株对高温和干旱胁迫的敏感性。Zhao等(2019)研究发现,在拟南芥中过表达小麦TaMYB31基因后增强了转基因植株的耐旱性。Wu等(2019)研究发现,玉米ZmMYB3R基因通过调控脱落酸(ABA)信号通路介导植株的抗旱及耐盐响应。Geng等(2020)研究发现,拟南芥MYB转录因子MYB20、MYB42、MYB43和MYB85通过调节次生细胞壁形成过程中苯丙氨酸和木质素的生物合成介导植株的生长发育。Zhu等(2020)研究发现,菊花CmMYB8基因通过抑制木质素和类黄酮合成,在菊花的生长发育中发挥负向调节的作用。Zhang等(2020)研究发现,番茄MYB15转录因子通过参与介导CBF途径,正向调节番茄的耐寒性。Yao等(2022)克隆海棠MbMYB108基因,将MbMYB108基因转入拟南芥后,其耐旱性和耐寒性大幅度提高。Hussain等(2021)从番红花中鉴定出一种R2R3-MYB转录因子(CstMYB14),其调节类胡萝卜素的活性氧响应生物合成,进而通过清除活性氧赋予应激耐受性。目前,已从陆地棉中共鉴定出812个MYB转录因子,其中有45个MYB转录因子功能被报道(朱英洁等,2021),其中GbMBY5(Chen et al.,2015)、GhRAX3(丁震乾等,2015)、GaMYB85(Butt et al.,2017)、Gh-MYB44(Hasan et al.,2019)和GhMYBPA1(张安红等,2020)等通过参与不同信号通路的调控,介导棉花抵御非生物胁迫的应激反应。【本研究切入点】目前对于陆地棉MYB转录因子功能研究主要集中在调控棉花的生长发育、纤维伸长、次生壁合成、花青素合成及抗非生物逆境反应等方面(朱英洁等,2021),但对于其参与棉花抵御黄萎病菌侵染的相关报道较少,该类转录因子在棉花抗黄萎病中的生物学功能尚不明确。【拟解决的关键问题】本研究通过前期转录组数据筛选得到1个响应黄萎病菌侵染的MYB家族基因GhMYB6,对其进行克隆鉴定及生物信息学分析,并利用病毒诱导的基因沉默(Virus-Induced gene silencing,VIGS)技术初步验证其生物学功能,为研究MYB转录因子在棉花抗黄萎病反应中的分子机制及棉花黄萎病相关基因的筛选提供参考。
1 材料与方法
1.1 试验材料
供试棉花材料为陆地棉(TM-1),其种子由新疆农业大学生命科学学院实验室保存;VIGS载体中的TRV:RNA1(辅助载体)、TRV:RNA2(阴性对照)、TRV:GhCLA1(阳性对照)和病原菌大丽轮枝菌菌株V991均由新疆农业科学院黄全生研究员惠赠。阳性对照中的GhCLA1基因与叶绿体发育相关,利用VIGS技术干扰了该基因的正常表达后,棉花叶片出现白化现象。DNA测序及各类引物合成均由生工生物工程(上海)股份有限公司完成。pEASY Blunt-Zero克隆载体、FastPfuFly DNA聚合酶等均购于北京全式金生物技术有限公司;限制性内切酶KpnⅠ和EcoRⅠ购于赛默飞世尔科技公司。主要仪器设备:恒温培养振荡器(ZWY-2102C,上海智城分析仪器制造有限公司)、PCR仪(Eppendorf,德国)、5424R高速冷冻低温离心机(Eppendorf,德国)。
1.2 试验方法
1.2.1 棉花培育及种植 陆地棉TM-1种子经硫酸脱绒后,用30%的H2O2溶液浸泡、无菌水冲洗、浸泡露白、28 ℃培养、胚根长至2~3 cm时种入土里,继续培养。待棉花两片真叶平展时进行接菌处理,具体方法参照胡子曜等(2021)文献。
1.2.2 黄萎病菌培养及接菌处理 参照Li 等(2021)方法将大丽轮枝菌V991进行接菌处理,Czapek’s培养基处理作为对照组(CK),分别在不同时间点0、6、12、24、48和72 h取根部组织,3个生物学重复,置于液氮备用。
1.2.3 总RNA提取及cDNA合成 利用植物总RNA提取试剂盒提取棉花根部总RNA,通过1.2%琼脂糖凝胶电泳检测其完整性,反转录成cDNA第一链,备用。
1.2.4GhMYB6基因克隆 通过转录组数据分析,获得GhMYB6基因序列,并在NCBI数据库中进行检索,获得其登录号:XM_016832094。根据该基因的开放阅读框(ORF)序列设计引物,引物序列如表1。参照胡子曜等(2021)的方法,以cDNA为模板进行PCR扩增,反应体系25.0µL:100 ng/µL cDNA 2.0µL,10 mmoL/L dNTPs 2.0 µL,10 µmoL/L正、反向引物 各1.0 µL,FastPfuFlyDNA 聚 合 酶(1.0 U/µL)1.0 µL,5×PCR Buffer 5.0 µL,ddH2O补足至25.0 µL。扩增程序参照胡子曜等(2021)的方法,扩增产物经电泳检测后,回收目的基因片段,并与克隆载体pEASY Blunt-Zero连接,转化大肠杆菌DH5α感受态细胞。挑取阳性单克隆质粒送上海生工生物有限公司进行测序。
1.2.5 生物信息学分析 采用NCBI数据库查找GhMYB6基因的最大ORF,通过在线软件ExPASy分析GhMYB6 蛋白的理化性质;利用PSIPRED 和SWISS-MODEL预测GhMYB6蛋白的二、三级结构;PSORTⅡ预测GhMYB6蛋白的亚细胞定位分析;利用SMART预测GhMYB6蛋白的结构域。查找并下载雷蒙德氏棉、拟南芥、亚洲棉等物种的同源蛋白序列,利用MEGA 11.0构建系统发育进化树。
1.2.6 黄萎病菌侵染下GhMYB6基因的表达模式分析 以cDNA为模板,利用实时荧光定量PCR(qRT-PCR)检测GhMYB6基因在黄萎病菌诱导下的表达模式,每个样本均设3个技术重复。以棉花管家基因GhUBQ7(袁伟等,2012)为内参,根据内参基因Ct值,利用2-ΔΔCt方法计算棉花GhMYB6基因的相对表达量(Kenneth et al.,2001)。GhMYB6基因和GhUBQ7基因的荧光定量引物q-GhMYB6和q-GhUBQ7如表1所示。
1.2.7GhMYB6基因的VIGS载体构建 根据Gh-MYB6基因的ORF序列,设计靶序列258 bp(抑制目的基因表达)及扩增引物CM-GhMYB6(表1),并在其5'端加EcoRⅠ和KpnⅠ的酶切位点,以cDNA为模板进行目标片段克隆及测序,并将上述测序正确的质粒和TRV:RNA2载体分别经EcoRⅠ和KpnⅠ酶切后回收,将目的基因与TRV:RNA2载体连接获得TRV:GhMYB6载体,然后转化大肠杆菌DH5α感受态细胞,经酶切鉴定正确后,转化农杆菌GV3101感受态细胞。
1.2.8 农杆菌介导的VIGS侵染棉花及沉默效率检测 把VIGS载体中的TRV:GhCLA1(阳性对照)、TRV:RNA1(辅助载体)、TRV:RNA2(阴性对照)和重组载体TRV:GhMYB6转化农杆菌后,选取子叶展开,真叶未露,生长情况一致的棉花幼苗,参照Li等(2021)方法进行侵染。侵染2周左右,当阳性对照植株真叶出现显著的白化现象时,分别采集试验组、阴性对照及阳性对照的根部和真叶取样。利用qRT-PCR对基因的沉默效率进行检测。阳性对照GhCLA1基因的荧光定量引物为q-GhCLA1(表1)。
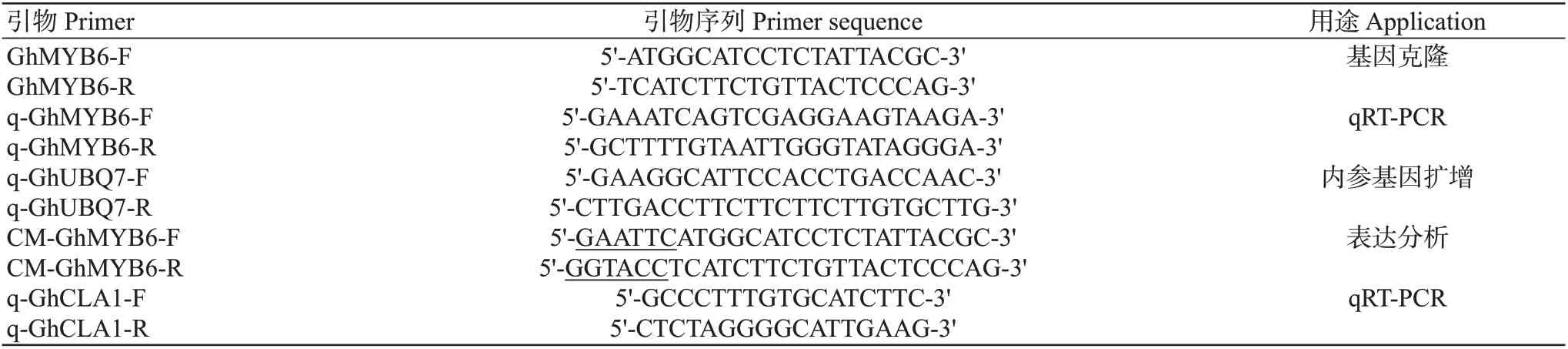
表1 供试引物序列信息Table 1 Primer sequence information used in the experiment
1.2.9 黄萎病菌接种处理及抗性鉴定 参照Li等(2021)的方法,将黄萎病菌接种于生长状况一致的GhMYB6沉默植株和阴性对照植株。在接种黄萎病菌18 d后记录表型差异,并进行病情指数统计、茎段恢复培养及剖杆检测试验(沈吉丽等,2020;Li et al.,2021)。
2 结果与分析
2.1 GhMYB6基因克隆结果
GhMYB6基因PCR产物用1.0%琼脂糖凝胶电泳检测,结果如图1所示。PCR扩增产物大小与预期结果(258 bp)一致,条带单一,其测序结果与参考序列(XM_01683 2094)完全一致,表明成功获得GhMYB6基因。
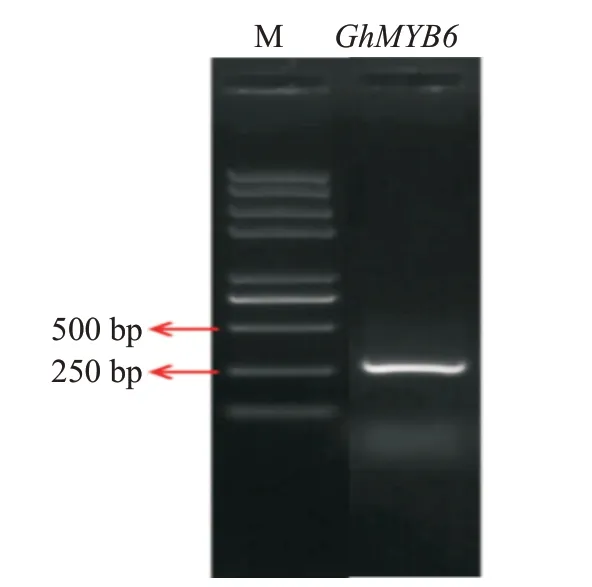
图1 GhMYB6基因ORF的PCR产物电泳检测结果Fig.1 Electrophoretic detection of PCR products of GhMYB6 gene ORF
2.2 生物信息学分析结果
GhMYB6基因ORF编码85个氨基酸残基,理论等电点(pI)为9.34,脂肪系数为73.41,平均疏水性为-0.793,相对分子质量为9.86 kD,不稳定指数为73.41,说明该蛋白为亲水性、碱性的非稳定蛋白;该蛋白无跨膜结构,无信号肽,且定位于细胞核,与转录因子特征相符;该蛋白在第11~63氨基酸处含有1个SANT结构域(图2)。二级结构预测结果(图3-A)显示,GhMYB6蛋白含有42个α-螺旋和43个无规则卷曲,分别占比49.4%和50.6%。利用SWISS-MODEL预测GhMYB6蛋白的三级结构,结果发现GhMYB6蛋白的三级结构与二级结构特征完全符合(图3-B)。
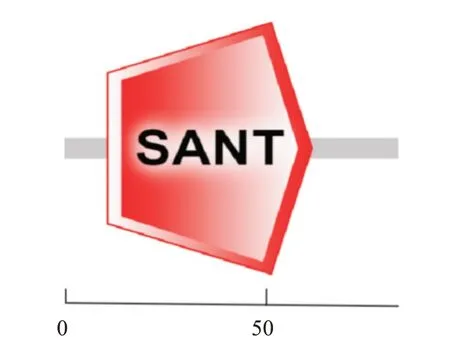
图2 GhMYB6蛋白的结构域预测结果Fig.2 Prediction of GhMYB6 protein domain
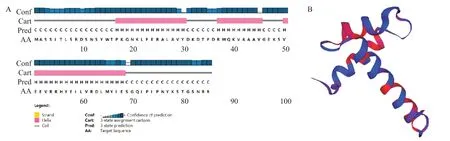
图3 GhMYB6蛋白的二、三级结构预测结果Fig.3 Secondary and tertiary structure prediction of GhMYB6 protein
选取不同植物的同源序列,采用MEGA 11.0构建系统发育进化树,结果显示GhMYB6蛋白与雷蒙德氏棉GrMYB6聚在同一小分支上,说明二者的亲缘关系较近(图4)。
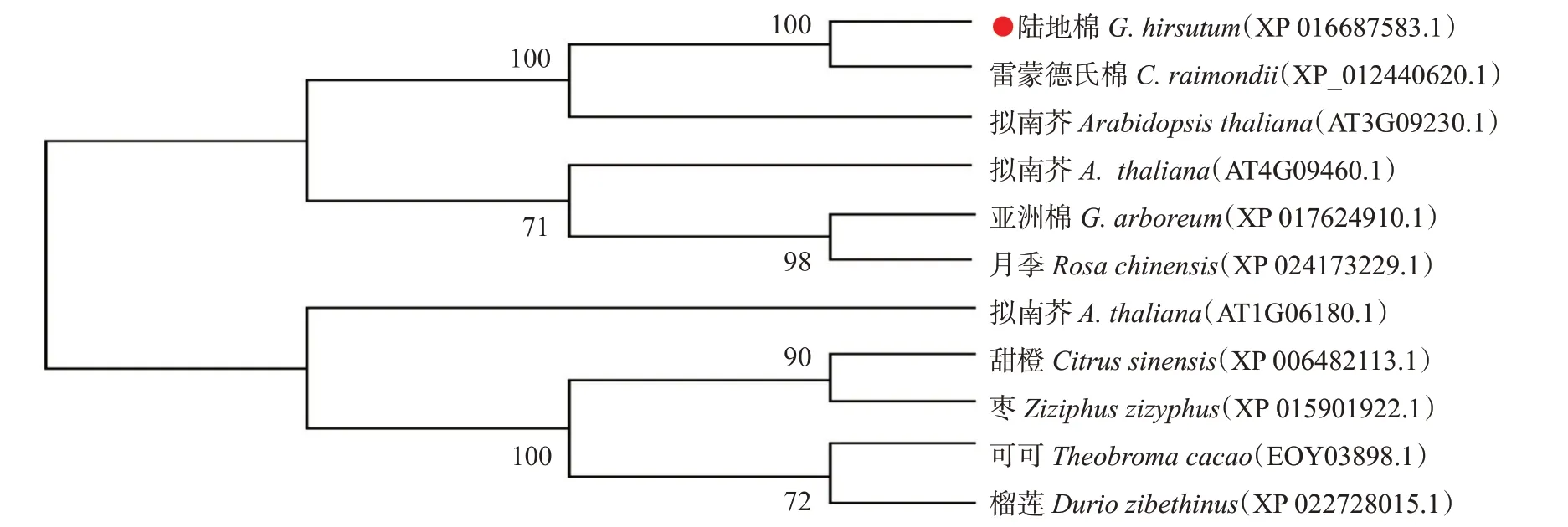
图4 基于不同植物MYB氨基酸序列相似性构建的系统发育进化树Fig.4 Phylogenetic tree based on MYB amino acid sequence similarity in different plants
2.2 GhMYB6基因在黄萎病菌V991侵染下的表达模式
利用大丽轮枝菌V991接种侵染棉花TM-1,分别在0、6、12、24、48和72 h时取棉花根部样品并提取总RNA,反转录合成cDNA第一链,以其为模板进行qRT-PCR检测,结果(图5)显示,GhMYB6基因在V991侵染后6和12 h时相对表达量较CK极显著下调(P<0.01,下同),在72 h显著上调(P<0.05,下同),24和48 h时与CK无显著差异(P>0.05,下同),推测GhMYB6基因在棉花抵御黄萎病菌响应中发挥重要的调控作用。
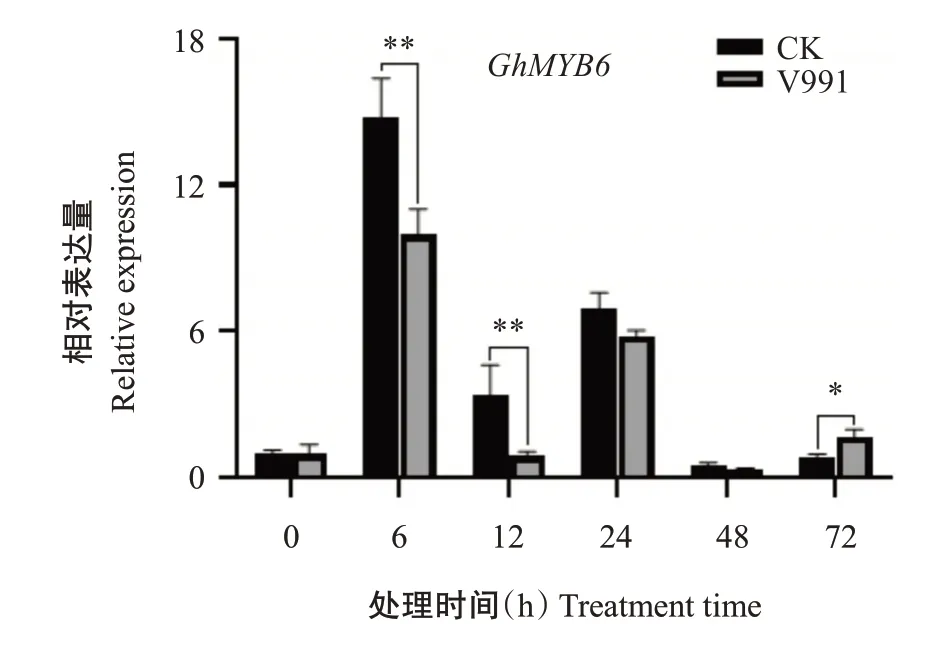
图5 黄萎病菌侵染下GhMYB6基因的表达模式Fig.5 Expression pattern of GhMYB6 gene infected with Verticillium wilt
2.3 GhMYB6基因的VIGS载体构建结果
利用引物CM-GhMYB6-F和CM-GhMYB6-R,通过PCR扩增抑制GhMYB6基因表达的靶序列(CMGhMYB6),结果(图6-A)显示,扩增条带大小约300 bp,与预期大小一致,其测序结果与目标序列一致。对TRV:GhMYB6载体进行双酶切鉴定,结果如图6-B所示,双酶切产物中存在2条带,分别是约300 bp的目标条带和大于8000 bp的载体条带,初步表明GhMYB6基因的VIGS载体构建成功。
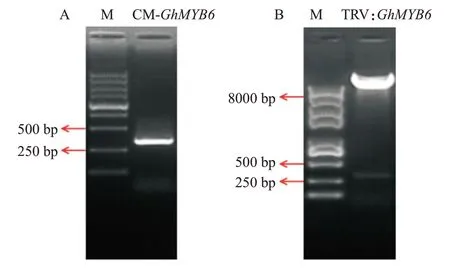
图6 GhMYB6的VIGS载体构建Fig.6 Construction of VIGS vector of GhMYB6
2.4 GhMYB6基因的沉默效率检测结果
将农杆菌菌液侵染棉花子叶,接种大约2周后发现,与未转入TRV载体的阴性对照植株(TRV:00)相比,接种TRV:GhCLA1农杆菌(阳性对照)的植株叶片出现明显的白化现象(图7-A)。利用qRT-PCR检测阳性对照GhCLA1和目的基因GhMYB6在根部和真叶中的相对表达量,结果显示,GhCLA1和GhMYB6基因已被有效沉默(图7-B和图7-C),表明本研究所用TRV-VIGS体系能在植株体内正常工作,成功获得GhMYB6基因的沉默植株。
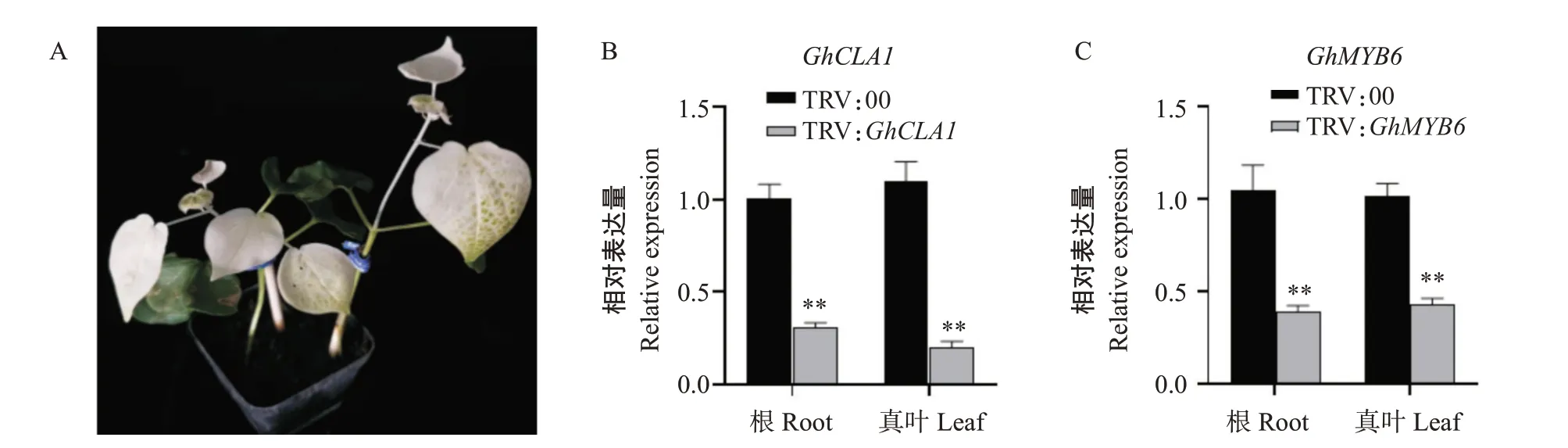
图7 GhMYB6基因的沉默效率检测结果Fig.7 Detection results of silencing efficiency of GhMYB6 gene
2.5 GhMYB6基因沉默植株的黄萎病抗性鉴定结果
选取长势一致的GhMYB6基因沉默植株和阴性对照植株TRV:00侵染黄萎病菌,18 d后记录其表型差异,并进行病情指数统计、茎段恢复培养及剖秆检测试验,结果如图8所示。与阴性对照植株TRV:00相比,GhMYB6基因沉默植株萎蔫程度和叶片黄化更严重(图8-A),病情指数显著升高(图8-B),茎秆的褐变程度更严重(图8-C),且茎段在培养基上生长的真菌菌丝数量明显增多(图8-D)。综上所述,Gh-MYB6是棉花抗黄萎病反应的一个正调控因子,抑制GhMYB6基因表达后,增强了棉花对黄萎病菌的敏感性。
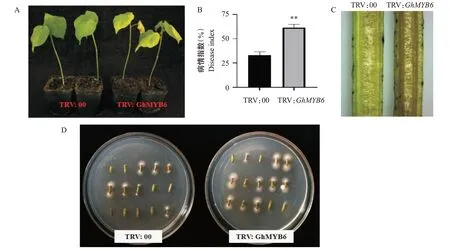
图8 GhMYB6基因沉默植株的抗病性鉴定Fig.8 Disease resistance identification of GhMYB6 gene silencing plants
3 讨论
本研究通过前期转录组数据筛选得到1个响应黄萎病菌侵染的MYB家族基因GhMYB6,因其与雷蒙德氏棉GrMYB6基因具有较高的核苷酸序列相似性(100%),将其命名为GhMYB6,其ORF长度为258 bp,编码85个氨基酸残基,相对分子质量为9.86 kD,定位于细胞核,为碱性、亲水性的非跨膜蛋白,无信号肽。MYB转录因子家族的N端含有MYB结构域,具有高度保守性。棉花GhMYB146(倪志勇等,2016)和澳洲坚果MiMYB1(王文林等,2020)蛋白N端均有2个高度保守结构域SANT。而本研究克隆的GhMYB6基因所编码蛋白N端只有1个高度保守结构域SANT,位于第11~63个氨基酸残基,与倪志勇等(2016)、王文林等(2020)的结果存在差异,推测其可能属于不同的亚家族。本研究发现GhMYB6基因定位于细胞核,与倪志勇等(2016)、王文林等(2020)研究结果一致,符合转录因子的结构特征。当棉花TM-1接种大丽轮枝菌V991后,结果发现GhMYB6基因在V991侵染后在6和12 h时的相对表达量较CK极显著下调,72 h时显著上调,24和48 h时均与CK无显著差异,整体表现出先下调后上调的变化趋势,与棉花GhMYB12(李菲等,2014)的研究结果一致,表明GhMYB6基因响应黄萎病菌V991侵染,推测其可能在棉花黄萎病菌防御中发挥一定的功能。
转录因子通过调节相关防御基因的转录与其他调控因子相互作用,在植物抵御病原体响应中扮演重要角色(Tsuda and Somssich,2015)。目前对于棉花MYB转录因子参与棉花抵御黄萎病菌响应的相关报道较少。Cheng等(2016)研究发现,GhMYB108可与钙调素类似蛋白GhCML11发生互作从而形成一个正反馈环,正向介导棉花抵御大丽轮枝菌侵染反应;沈吉丽等(2020)研究发现,GhMYB43通过负调控木质素的生物合成和及茉莉酸信号通路相关基因的表达,在棉花抗黄萎病反应中作为一个负调控因子;Liu等(2021)研究发现,GhMYB36转录因子通过调控植物中病程相关蛋白1(Pathogensis-related protein 1,PR1)基因的表达,增强了棉花对黄萎病菌的抗性和干旱的耐受性。序列比对结果显示,本研究克隆获得的GhMYB6基因所编码的蛋白序列与上述前人研究中的蛋白序列均存在一定差异,表明GhMYB6是一个新的棉花MYB转录调控基因,进一步丰富了棉花MYB家族转录因子在抗黄萎病中生物学功能。另外,与阴性对照植株TRV:00相比,GhMYB6基因沉默植株萎蔫程度和叶片黄化更严重,病情指数显著升高,茎秆的褐变程度更严重,茎段在培养基上生长的真菌菌丝数量明显增多,说明GhMYB6基因棉花抗黄萎病响应中发挥了重要的正向调节作用,与沈吉丽等(2020)研究的GhMYB43在棉花抗黄萎病响应中作为一个负调控因子的功能相反,与GhMYB12(李菲等,2014)、GhMYB108(Cheng等,2016)及GhODO1(Zhu et al.,2022)正向介导棉花抵御大丽轮枝菌侵染反应的功能一致,推测MYB家族基因功能具有多样性。本研究通过反向遗传学的方法,初步证明了GhMYB6是一个理想的棉花抵御黄萎病菌入侵的正向调节基因,为后续利用基因组编辑技术创制突变体材料提供了新的靶向选择,同时也为培育棉花抗病新种质提供了一定的理论基础,但该基因的调控机制仍需进一步探究。
4 结论
GhMYB6基因响应黄萎病菌V991侵染,当抑制GhMYB6基因表达后,棉花对黄萎病菌的敏感性增强,抗性明显降低,推测GhMYB6是棉花抗黄萎病防御的一个正向调节因子。
