新型可降解编织结构神经再生导管的制备及其性能
2022-03-18姚若彤赵婧媛闫一欣段立蓉张淑军
姚若彤, 赵婧媛, 闫一欣, 段立蓉, 王 恬,严 佳, 张淑军, 李 刚,2
(1. 苏州大学 纺织与服装工程学院, 江苏 苏州 215123; 2. 苏州大学 现代丝绸国家工程实验室, 江苏 苏州 215123; 3. 北卡罗莱纳州立大学 纺织学院, 罗利 27695)
周围神经损伤在临床病症中十分常见,占据了所有外科创伤病例的2%~5%[1]。自然灾害或意外事故都会对人体周围神经造成不同程度的损伤,从而导致创伤性或非创伤性疾病、感觉不良,甚至是瘫痪[2]。当周围神经的缺损距离较短(小于5 mm)时,可以直接通过手术缝合的方式进行修复,但对于长距离(缺损距离大于受损神经直径4倍以上或者缺损长度大于3 cm)的神经损伤,直接缝合会使得缝合线处的张力较大,导致手术效果不理想[3]。对此,临床上常使用的治疗方案是自体移植和异体移植,自体神经移植是修复周围神经受损的“金标准”[4],但其也因供体不足、供区功能受损以及神经瘤的形成而具有一定的局限性[5],异体移植可能会产生免疫排斥反应和交叉感染等问题[6]。基于此,人工神经移植成为治疗周围神经损伤的热点研究方向。
神经导管需具备良好的力学性能、生物相容性和一定的引导性,目前针对神经导管性能的改善工作主要从材料选择和结构设计两方面进行[7]。常用的材料主要有生物降解材料、非生物降解材料和生物衍生材料[8],其中生物降解材料来源广泛,具有优异的生物相容性和可降解性能,是植入体内的首选材料之一[9]。蚕丝理化性质优良,同时具有良好的力学性能和生物相容性[10],丝素蛋白约占蚕丝总质量的80%[11-12],以丝素蛋白为原料制作的神经导管在体内炎症反应低且可进行生物降解,能够有效促进受损神经的功能恢复[13];壳聚糖具有抗菌和抑制炎症反应的作用[14]。镁元素作为人体内必不可少的微量元素,在适宜的微环境下能够促进雪旺氏细胞的增殖,如分泌生长因子和细胞外基质等,从而改善周围神经缺损的修复[15]。静电纺纳米纤维与细胞外基质具有相似结构,为细胞的黏附与增殖提供仿生微环境,同时可负载药物用于在受损部位构建药物释放系统[16-17],但纯纳米纤维结构不稳定,且中空结构的导管缺乏对轴突再生的结构性支撑。
本文将传统编织技术、静电纺丝和冷冻干燥技术相结合,轴纱与编织纱紧密交织形成稳定的编织结构,起到力学支撑的作用,而导管内腔的海绵层结构为轴突生长提供了物理引导,同时为细胞的黏附和增殖提供稳定空间。以丝素蛋白溶液、蚕丝纱、壳聚糖和氧化镁为原料制备了一种含有壳聚糖涂层-编织层-纳米纤维海绵层的3层复合结构的神经导管支架,并对其外观形貌进行表征,讨论了导管轴纱、内外层结构对力学性能的影响,同时研究了导管在体外实验条件下的离子缓释性能和细胞相容性。
1 实验部分
1.1 材料与设备
生丝(4A级),桑蚕丝线(5、9 tex),嵊州市协和丝绸有限公司;壳聚糖(BR脱乙酰度95%),国药集团化学试剂有限公司;纳米氧化镁粉体(粒径20 nm,纯度98%),江苏先丰纳米材料科技有限公司;镁离子标准溶液(100 μg/mL),上海麦克林生化科技有限公司;无水碳酸钠(AR)、聚乙二醇,上海国药集团化学试剂有限公司;溴化锂(AR),上海阿拉丁试剂有限公司;磷酸缓冲盐溶液(PBS,pH值为7.4),美国Hyclone公司;胎牛血清,美国Gibco公司;高糖培养基(DMEM),美国Gibco公司;1%链霉素-青霉素,美国Gibco公司;CCK-8细胞计数试剂盒(1 000 U),苏州碧云天生物技术。
SFJ-Y-C32型立式锭子编织机,上海哈考线带设备有限公司;TL-Pro-BM型静电纺丝机,深圳通力微纳有限公司;ALPHA 2-4 LSC型冷冻干燥机,德国Christ公司;TMS-PRO型质构仪,美国FTC;5967万能材料试验机,美国英斯特朗公司;S-4800型冷场发射扫描电子显微镜,日本日立公司;TM3030型能谱仪,日本日立公司;Nicolet 5700型傅里叶红外光谱仪,美国尼高利科学仪器技术公司;AA240FS-GTA120型原子吸收光谱仪,美国瓦里安公司;酶联免疫检验仪6500,美国Wisdom公司。
1.2 神经导管制备
1.2.1 丝素蛋白/镁离子纳米纤维膜的制备
将30 g生丝与一定量的无水碳酸钠放入沸水中煮沸30 min,进行脱胶处理,冲洗2~3次后放置在通风处进行干燥[18]。将干燥后的脱胶蚕丝溶解于浓度为9.3 mol/L的100 mL溴化锂溶液中,在60 ℃ 的恒温箱中静置4 h,得到淡黄色透明的丝素蛋白溶液[19]。将溶液装入透析袋,放入去离子水中透析36 h,随后再次放入15%的聚乙二醇溶液中,将其置于磁力搅拌器上不断搅拌,48 h后丝素蛋白的含量上升为24%~28%[20]。配置一定浓度梯度的镁离子溶液,质量浓度分别为0、0.01、0.015和0.02 g/mL,将其与一定量的丝素蛋白溶液均匀混合,得到丝素含量为24%的丝素蛋白/镁离子溶液。利用静电纺丝技术,在20 kV电压下,保持针头与接收器之间的距离为25 cm,纺丝推速为0.2 mL/h,制备纤维膜结构完整均匀的丝素蛋白/镁离子纳米纤维膜[21]。
1.2.2 编织结构层的设计
采用立式锭子编织机,分别以5和9 tex的桑蚕丝线为轴纱和编织纱,制备内径为2 mm的三维管状编织物[9],作为导管的中间层结构。为讨论编织层中轴纱对导管性能的影响,实验同时设置无轴纱编织层作为对照组。
1.2.3 壳聚糖涂层的制备
将质量分数为6%的壳聚糖溶液涂覆于编织层外层上,经烘箱干燥后形成壳聚糖涂层。壳聚糖降解过程中生成壳寡糖,起到抑制炎症反应和细胞感染的作用[22]。
1.2.4 海绵结构层的制备
将1.2.1中制备的丝素蛋白/镁离子纳米纤维膜经乙醇处理后裁剪成细小的短纤维,均匀分散于6%的壳聚糖溶液中,利用注射器将混合溶液注入导管内腔,放入-80 ℃的低温冰箱中冷冻2 d,利用真空干燥机冷冻干燥3 d,得到含纳米纤维的海绵层结构。
1.2.5 神经导管结构设计
为探究轴纱和内外层结构对神经导管力学性能的影响,本文以这2种要素为变量,通过设置不同的排列组合方式,制备4种结构的神经导管,如表1所示。通过对相应测试结果进行分析,找到最优化的材料组合比例和结构设计方案。

表1 神经导管的制备参数
1.3 结构与性能测试
1.3.1 形貌观察
采用扫描电子显微镜对4个浓度梯度的丝素蛋白/镁离子纳米纤维膜的形貌进行观察,利用Image-J 软件分别在每个样品中选取100根纤维进行直径测量,经数据处理后分析其分布情况。同时,对制备的神经导管进行横向切片处理,利用扫描电子显微镜分别对含/不含海绵层的导管截面及管壁进行观察,利用Image-J软件测量每个海绵层中的100个孔径直径,绘制孔径分布图,对海绵层中的孔径直径大小和分布情况进行测试分析。
1.3.2 化学结构测试
以经过乙醇处理的丝素蛋白/镁离子纳米纤维膜和未经处理的纳米纤维膜为样品,利用傅里叶红外光谱仪进行测试,波数范围为4 000~400 cm-1,对得到的数据进行处理,绘制出红外光谱图。
1.3.3 试样表面元素含量测试
分别在4种浓度梯度的丝素蛋白/镁离子纳米纤维膜上取样,使用能谱仪分析每个样品中的C、O、Mg 3种元素的含量,得到数据汇总成表格。
1.3.4 力学性能测试
取长度为5 cm的4组不同结构的导管作为样品,每组设置3个平行样。利用TMS-PRO型质构仪检测导管的轴向压缩性能,压缩位移为导管直径的50%,压缩速度为15 mm/min,测试径向所能承受的最大挤压力,取平均值±标准误差并绘制数据图;拉伸性能测试在万能材料试验机上进行,夹持距离为20 mm,加载速度为100 mm/min,拉伸样品直至轴纱断裂,绘制应力-应变曲线图[23]。
1.3.5 镁离子缓释性能测试
分别将含有不同镁离子质量浓度的导管样品浸入10 mL、pH值为7.4的PBS溶液中,放置于37 ℃恒温箱,培养至固定时间(1、3、7、14、28 d) 后取出1 mL 培养液,同时配置标准溶液,利用原子吸收光谱仪检测溶液吸光度,根据标准曲线确定镁离子质量浓度,做出镁离子质量浓度-时间关系曲线图。
1.3.6 细胞实验
细胞实验材料采用大鼠神经雪旺氏细胞,培养基的组成成分为89%的DMEM,10%的胎牛血清和1%的链霉素-青霉素双抗。将直接培养在24孔细胞培养板中的细胞作为对照组,实验组则将细胞分别培养在镁离子质量浓度为0、0.01和0.02 g/mL的神经导管中。将大鼠神经雪旺氏细胞复苏后,放入5%二氧化碳的培养箱中进行增殖,同时将导管样品切成5 mm,辐照灭菌处理。接种细胞后,将样品放入完全培养基中继续培养[24]。在第1、3、5、7 d后取出对照组和实验组,更换新的24孔板。每孔放入1个样品并加入100 μL含有CCK-8试剂的培养基,利用酶联免疫检验仪测其在450 nm处的吸光度,根据吸光度值估计细胞数量。
2 结果与讨论
2.1 丝素蛋白/镁离子纳米纤维膜微观结构
2.1.1 表观形貌分析
利用静电纺丝技术纺制的纳米纤维膜具有较大的比表面积,可很好地模拟细胞外环境,有助于神经细胞黏附、增殖,从而促进受损神经再生。图1示出纳米纤维的形貌及其直径分布。可知在电镜观测下,含有不同质量浓度纳米级别氧化镁粉、质量分数为24%的丝素蛋白溶液均成功制备出了静电纺丝薄膜。其中加入了0.02 g/mL氧化镁所纺得的静电纺丝纤维的均匀度及细度(0.6~0.9 μm)最好,加入了0.01 g/mL氧化镁所纺得的静电纺丝纤维的均匀度较好,但直径(1.5~2 μm)较大,未加入纳米氧化镁和加入0.015 g/mL的氧化镁所得到的静电纺丝纤维的均匀度较好,细度分布主要集中于1~1.5 μm 和0.8~1.4 μm。
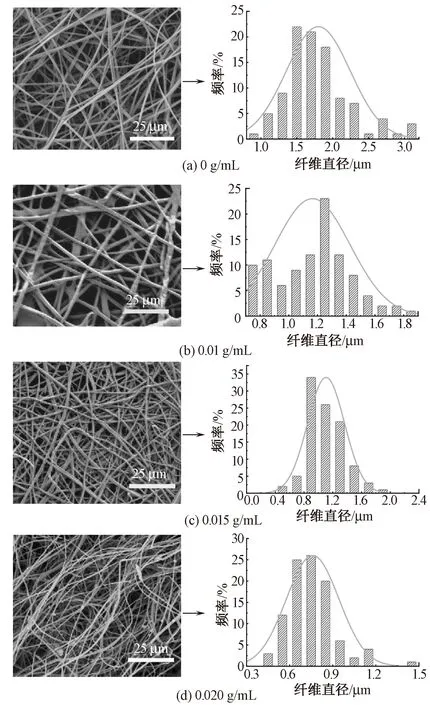
图1 静电纺纳米纤维的形貌及其直径分布
2.1.2 元素含量分析
表2示出静电纺丝膜中C、O、Mg 3种元素的含量。可以看出,4组不同镁离子质量浓度的静电纺丝薄膜中均含有微量镁元素。其中0 g/mL实验组中本不应出现镁元素,但结果中出现了质量分数为0.010%的镁元素,原因可能来自于选样检测时导致的微量残留,但由于其含量极少,可忽略不计。可以发现,镁元素在几种镁离子质量浓度的静电纺丝膜中分布不均,其原因是配置好的氧化镁溶液在加入具有黏度的丝素蛋白溶液中时,即使通过搅拌等方式使其混合均匀,仍存在着分布不均的情况。

表2 含不同质量浓度镁离子的静电纺丝薄膜的元素含量
2.1.3 化学结构分析
固体状态下,丝素蛋白具有Silk Ⅰ和Silk Ⅱ 2种构型,其中:Silk Ⅰ构型主要是无规卷曲结构,多在非结晶区;Silk Ⅱ构型主要是β折叠的层状结构。表3示出丝素蛋白的主要吸收峰[24]。

表3 丝素蛋白的红外光谱特征峰[24]
图2示出静电纺丝薄膜的红外光谱测试结果。由图可得,未经乙醇处理的丝素蛋白膜的酰胺 Ⅰ和酰胺 Ⅱ结构的特征峰位于1 655、1 541 cm-1处,表明其中丝素蛋白的主要结构为Silk Ⅰ。经过无水乙醇处理的丝素蛋白膜中,酰胺 Ⅰ和酰胺 Ⅱ的特征峰向低波数方向偏移,且峰形变宽,表明经乙醇处理后,丝素蛋白中的结晶结构从不稳定的Silk Ⅰ 转变成了稳定的Silk Ⅱ。这种结构的转变改变了丝素蛋白的降解性能,增强了丝素蛋白膜的结构稳定性。在制备导管海绵层结构时,经乙醇处理的纳米纤维膜在壳聚糖溶液中不易溶解破坏,从而在一定程度上改善了导管的力学性能。

图2 静电纺丝薄膜的红外光谱图
2.2 神经导管的形貌结构分析
通过三向带芯编织技术得到的编织层为内径2 mm 的中空管状结构,如图3所示。其管壁清晰可见,编织纱和轴纱相互紧密交织形成编织结构,编织结构的主要作用是为复合神经导管结构提供力学支撑,主要增强其轴向拉伸性能[25]。壳聚糖和静电纺丝纳米短纤维混合溶液注入编织层内部后,经过冷冻干燥形成纳米纤维海绵层结构,该结构可极大增强神经导管的径向压缩性能。冷冻干燥后的纳米纤维海绵层表面粗糙,多孔且相互连通。

图3 复合编织结构神经导管的扫描电镜照片
纳米纤维海绵层中孔径分布较为均匀,且主要集中在0.04~0.08 mm之间,有利于神经细胞黏附与增殖且使神经导管具有一定的渗透性,有助于受损神经部位同周围的组织环境进行水、氧气和营养物质的交换[26]见图4所示。

图4 复合编织结构神经导管中纳米纤维海绵层中的孔径分布
2.3 神经导管的力学性能分析
为研究编织结构中轴纱以及纳米纤维海绵层的力学作用,使用TMS-PRO质构仪对4组神经导管样品在形变50%下的径向压缩性能进行测量,结果如图5所示。可知,编织结构中有轴纱的神经导管相对于无轴纱的神经导管来说,径向压缩性能更好。具有纳米纤维海绵层结构的神经导管其径向压缩性能比无纳米纤维海绵层结构的更好。同时,以海绵层为变量的2组神经导管其径向压缩性能存在显著差异,而改变轴纱并不会对压缩性能产生显著影响,由此可以说明,相较于轴纱,导管的纳米纤维海绵层结构是影响导管压缩性能的主要因素。有轴纱有纳米纤维海绵层的神经导管的径向压缩性能大约为无轴纱无纳米纤维海绵层的4倍,前者为1.3 N,后者为0.3 N,该结论为制备力学性能良好的复合结构的神经导管提供了依据。当研究神经导管的轴向拉伸性能时,以纳米纤维海绵层为变量,可以发现,有纳米海绵层的2组比相应的无纳米纤维层的2组的拉伸性能更优异(见图5(b))。但以有无轴纱为变量时,无轴纱的2组神经导管明显比有轴纱的2组神经导管的拉伸性能更好,原因是在拉伸过程中,测试有轴纱的神经导管组的拉伸性能时直致轴纱断裂,而无轴纱的神经导管组则到编织结构被破坏。

图5 神经导管的力学性能
2.4 镁离子的缓释性能分析
镁离子的缓释速率会影响神经导管在体内的工作时间和效果。神经导管放入人体后,纳米纤维海绵层中的镁离子会缓慢释放,从而起到促进神经中蛋白质的合成和神经细胞再生的作用。图6示出镁离子的缓释曲线,显示了第1、3、7、14、28 d镁离子的累计释放浓度。从整体来看,镁离子缓释浓度与样品中所含药物浓度成正相关,导管中的镁离子质量浓度越高,在相同时间内释放到环境中的镁离子含量就越大。数据表明,当导管中镁离子的质量浓度为0.01、0.015和0.02 g/mL时,导管能在培养基中缓慢释放镁离子28 d,释放出的质量浓度水平保持在0.8~1.25 g/mL之间,不超过人体内镁离子含量极限值,所以是安全的。

图6 神经导管内镁离子的缓释曲线
2.5 神经导管的细胞相容性分析
图7示出神经导管与细胞共培养第1、3、5、7 d的实验结果。吸光度值可间接反映导管样品中细胞的数量。图中数据表明,3个实验组(镁离子质量浓度分别为0、0.01、0.02 g/mL)中细胞的增殖情况相似。从第1~3 d,细胞大量增殖,之后增速放缓,细胞数量保持稳定。其中含镁离子导管样品中细胞的增殖速度大于不含镁离子的导管样品。细胞逐渐在导管中充满,之后从导管的两端进入培养液中,这种情况可能导致细胞的增长速度保持不变甚至下降。在相同观测时间内,含有镁离子的样品中细胞数量大于对照组,表明了在导管内加入镁离子能够促进细胞增殖,且随着培养时间的延长,镁离子对细胞增殖的促进效果越明显。镁离子浓度也会对细胞增殖产生一定的影响,当镁离子质量浓度为0.01~0.02 g/mL 时,随着浓度的提高,导管样品中的细胞数量有所增加,表明在这一浓度范围内,镁离子质量浓度与细胞数量成正相关。实验结果同时证明了该神经导管对细胞无明显毒性,安全有效,具有良好的生物相容性。

图7 CCK-8细胞增殖图
3 结 论
本文利用编织技术、静电纺丝和冷冻干燥制备三层结构的神经导管,通过形貌分析和力学性能表征,得到以下结论。
1)轴纱和海绵层结构能够改善导管的抗压缩能力,使导管具有优异的力学性能。其中海绵层表面粗糙,孔径大小均匀,孔与孔之间相互连通,利于细胞黏附和环境中物质的内外交换。
2)神经导管内镁离子能够在体外微环境下长效稳定释放,且当镁离子质量浓度为0.02 g/mL时,其对细胞增殖的促进效果更明显。
