改性核桃壳生物炭对枯草芽孢杆菌SL−44的吸附
2022-03-18邓子禾田飞武占省陶治东孙琳琳杨帆李海杰
邓子禾,田飞,武占省,*,陶治东,孙琳琳,杨帆,李海杰
(1.石河子大学化学化工学院,新疆 石河子 832000;2.西安工程大学环境与化学工程学院,西安 710000)
近年来,由于土地的不合理开发利用,越来越多的农田遭到破坏,土壤污染日益严重,耕地土壤质量问题尤为突出。据报道,我国16.1%的土壤未达到土壤环境质量标准,其中11.2%的土壤受到严重污染。因此,对污染土壤进行修复是当前研究的热点。微生物修复由于具有效率高、成本低、产品无害等优点,应用越来越广泛。影响生物修复的关键因素是微生物数量和活性,以及土壤养分和氧气状况。然而,被污染土壤通常不利于微生物的存活,因而能够提升微生物适应性及稳定性的固体菌剂制备成了当前研究的热点。吸附法由于操作简单且对微生物活性影响较小,成为制备微生物菌剂的常用方法。有研究表明,载体种类在菌剂制备中尤为重要。生物炭由于含碳量高、稳定性好、表面官能团丰富、孔隙发达、具有较高的比表面积和阳离子交换量,可以为微生物的存活提供营养和有效庇护,同时具有改善土壤肥力和固碳的潜力。因此以生物炭为载体吸附微生物制备炭基菌剂,是提高菌体储藏存活率、增强协同改良土壤效果的一种可靠方法。
吸菌量是评价载体性能的关键性指标,对生物炭进行改性的主要方向之一就是提高其对菌体的吸附能力,制备效果更好、性能更优的生物炭基菌剂。生物炭的吸附能力与其表面积、孔径分布、表面官能团、阳离子交换能力等理化性质直接相关。化学改性能够增加生物炭的表面积和吸附位点,以增强其对菌体的吸附性能。草酸等弱酸可通过酯化作用将羧基引入生物炭表面,不仅为菌体黏附提供吸附位点,还能够有效降低土壤pH,促进环境中磷的溶解,使其易于被植物吸收。碱改性可以增加生物炭的正电性,减少生物炭与菌体之间的静电斥力,另外氨基修饰可以为植物和微生物提供氮源,增加土壤的肥力,促进作物的生长。因此增加生物炭上氧氮官能团含量,既能增强生物炭与菌体的协同能力,用于改良土壤,还能增加生物炭的吸菌量。课题组前期从根际土壤中筛选获得了枯草芽孢杆菌(Bacillus subtilis)SL−44,已被证明能够促进植物生长,具有固氮、溶磷、分泌IAA、缓解土壤盐危害、生物防治和吸附重金属等功效。另外SL−44优越的产孢性能对固体菌剂制备具有良好的适配性。但是,如何提高载体对菌体的吸附性能仍然是目前亟待解决的问题。
基于此,本文使用草酸和氨水对生物炭进行改性,探究生物炭性能变化对其吸附菌体的影响,揭示载体物理化学性质及环境对吸附菌体的影响规律,探究生物炭与SL−44的黏附位点及结合方式,为制备高效稳定的生物炭基菌剂提供理论指导。
1 材料与方法
1.1 实验材料
1.1.1 实验原料
菌 株:SL−44 经 课 题 组 筛 选 获得。由于SL−44 在培养4 d 左右时达到最大生长量及芽孢产率,故选取培养4 d 的菌液,其芽孢产率达60%,OD值为(1.00±0.05)。核桃壳生物炭(CW)购自河南众邦环保科技有限公司。
1.1.2 培养基
在LB 培养基中添加0.05%的MnSO·HO 作为产孢剂,然后将培养基的pH调节至7.0。
1.2 生物炭改性
称量CW 各10.0 g,分别装于50 mL 锥形瓶中,酸改性为分别加入30 mL配制好的5%、10%、15%草酸,氨水改性为分别加入30 mL 配制好的5%、10%、15%的氨水,放置于40 ℃、70 r·min的恒温水浴摇床,振荡12 h 后取出,用去离子水冲洗至pH 值不变。酸改性生物炭和氨水改性生物炭分别按照浓度从低到高标 记 为CCW5、CCW10、CCW15 和NCW5、NCW10、NCW15。
1.3 材料表征与分析
对CW 及酸碱改性的生物炭进行表征分析:pH使用酸度计(雷磁PHS−3C)测定;pH采用零点电荷法测定,即ΔpH=0所对应的pH;采用Beohm滴定法测定生物炭的表面官能团含量;利用X射线光电子能谱(XPS Thermo ESCALAB 250XI)测定生物炭表面C、N、O 元素占比;采用有机元素分析仪(Vario EL cube)测定生物炭中C、H、O、N、S的含量;根据Brunner−Emmet−Teller(BET)与Barrett−Joyner−Halenda(BJH)理论,使用全自动气体吸附分析仪(Automated Gas Sorption Anlyzer,Autosorb−IQ)测定生物炭比表面积、孔径及孔体积;采用Zetasizer Nano 测定3 种生物炭及SL−44 在pH=7 时的zeta 电位;采用扫描电镜(SEM,Flex-SEM1000)对生物炭、SL−44 及炭基菌剂进行表面形貌特征分析;采用红外光谱仪(FTIR,Nicolet 50)对材料进行表面官能团的测定。
1.4 实验设计
1.4.1 标准曲线测定
待测SL−44 菌液经6 000 r·min离心、1∶1 重悬后,分别取0、0.2、0.4、0.6、0.8、1.0 mL,用稀释涂布平板法,测定对应活菌数。随后取对应含量的菌液于100 ℃下裂解30 min,用考马斯亮蓝法测定蛋白含量。绘制OD−蛋白含量(μg·mL)、蛋白含量(μg·mL)−活菌数(×10CFU·mL)、OD−活菌数(×10CFU·mL)的标准曲线,分别为:=119.3(=0.994***)、=0.406 4(=0.997***)、=48.49(=0.995***),***表示<0.001。
1.4.2 吸附实验
取出培养4 d 的SL−44 菌液,6 000 r·min离心后按1∶1重悬,根据1.4.1方法测定初始浓度。
取CW 及酸、碱改性的CW 样品各0.1 g 加入100 mL 的锥形瓶中,在每个锥形瓶中加入50 mL 的重悬液(0.002 g·mL),调节pH=7,置于170 r·min摇床中吸附2 h。将吸附后的生物炭分别记为CW−SL、CCW−SL、NCW−SL。随后测定生物炭材料的吸附平衡浓度,为提升菌体与生物炭的分离效果,采用密度梯度离心法:取上清液1 mL 覆盖在60%的蔗糖溶液上,经1 500 r·min离心15 min 使生物炭与游离菌分离,取蔗糖上层液体100 ℃水浴30 min,根据1.4.1方法测定平衡浓度。由公式(1)计算吸附量:

式中:为平衡时的吸附量,CFU·g;、分别为初始、平衡时的浓度,CFU·mL;为溶液体积,mL;为吸附剂质量,g。
1.4.3 吸附动力学实验
将50 mL SL−44 菌液分别与0.1 g CW 和不同处理的CCW、NCW 混合,调节pH=7,在28 ℃、170 r·min的水浴摇床中进行吸附。采样时间点设为5、10、15、20、30、40、60、80、100 min,引入了两种传统的动力学模型对吸附进行拟合,如公式(2)、公式(3)所示:
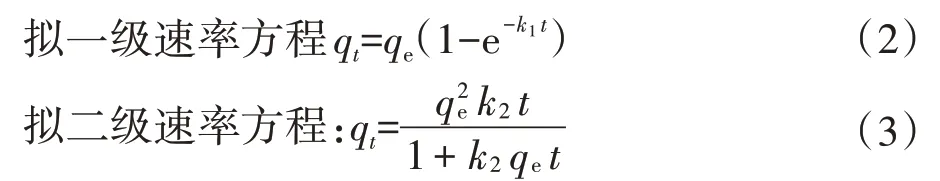
式中:、q分别为平衡与时刻吸附量,CFU·g;和分别为拟一级和拟二级速率常数,CFU·g·min。1.4.4 吸附等温线及热力学分析
将SL−44 菌液配制为初始浓度的100%、80%、60%、40%、20%,另设置不含菌液的对照,各取50 mL,分别加0.1 g 的CW、CCW、NCW 进行吸附性能研究,调节pH 为7,在28、38、48 ℃的水浴摇床中(170 r·min)吸附2 h,测定载体和溶液当中菌体含量。吸附模型分别选取Langmuir模型和Freundlich模型:


式中:为平衡时溶液中菌体的浓度,CFU·L;、分别为平衡、饱和吸附量,CFU·g;为Langmuir 常数,L·CFU;和为Freundlich模型的经验常数。
实验中使用的热力学参数包括吉布斯自由能变化、焓变和熵变,实验温度28、38、48 ℃。3 个热力学参数通过热力学方程(6)~(8)计算。

式中:为无量纲平衡常数,由×10L·CFU×转化系数4.068×10CFU·mg×体系系数2 000 mg·L得到;为常数;为理想气体常数,8.314 J·mol·K;为热力学温度,K;Δ为吉布斯自由能变,kJ·mol;Δ为焓变,kJ·mol;Δ为熵变,kJ·mol·K。
1.4.5 菌剂菌体存活性能
取CW、CCW15、NCW15 各0.1 g 与0.5 mL 的SL−44 重悬液混合,于50 ℃烘箱中烘干,随后在室温下保存,于第0、30、60、90、120 d 加入2 mL 去离子水重悬10 min,用稀释涂布平板法记录菌剂活菌数。
2 结果与讨论
2.1 改性剂浓度对生物炭的影响
2.1.1 改性剂浓度对生物炭化学性能的影响
生物炭的pH 会影响其在土壤中的适用性,所以对改性生物炭的pH 进行了测定。CW、CCW5、CCW10、CCW15、NCW5、NCW10、NCW15 的pH 值分别为7.12、3.20、3.07、3.01、8.28、8.29、8.32。由此可知未改性生物炭为中性,草酸改性生物炭为酸性,氨水改性生物炭为弱碱性,改性前后生物炭的pH 值差异明显,但相同类型不同浓度改性剂对pH 值的影响差异较小。调节土壤pH是改良酸碱土壤的常用方法之一,因此草酸改性生物炭适用于碱性土,氨水改性生物炭适用于酸性土。
研究表明,pH值越小,材料表面负电荷越多。如图1所示,CW 的pH值在7左右,酸改性生物炭的pH值为6~7,碱改性生物炭的pH值为7~8。改性前后生物炭的负电性排序为CCW15>CCW10>CCW5>CW>NCW5>NCW10>NCW15。
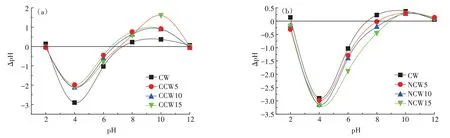
图1 不同浓度酸碱改性生物炭的pHPZCFigure 1 The pHPZC of modified biochar by different concentrations of acid or base
生物炭的pH 和表面电荷含量的差异,可能会引起生物炭表面官能团含量的变化。由表1 可知,草酸改性生物炭表面的总酸性官能团含量随着草酸浓度的增加而上升,羧基的含量也随之上升,但酚羟基的含量随草酸浓度的增加而下降。氨水改性生物炭表面的总碱性官能团含量随着氨水浓度增加而增加。两种改性生物炭的官能团含量均有所增加,且酸改性生物炭官能团含量大于氨水改性生物炭。

表1 不同生物炭材料表面官能团的含量测定(mmol·g−1)Table 1 The surface functional groups of different biochars(mmol·g−1)
2.1.2 改性剂浓度对生物炭吸附性能的影响
为了研究改性剂对生物炭吸附菌性能的影响,在常温下进行吸附实验。由图2 可知,生物炭负载SL−44 的数量排序为NCW15>CCW15>NCW10>NCW5>CCW10>CCW5>CW,总体上氨水改性生物炭的吸附性能略强于草酸改性生物炭,且生物炭对菌的吸附能力随着改性剂浓度的增加而增加。CW 负载菌体数量 为1.041 9×10CFU·g,性 能 最 优 的NCW15 与CCW15 的菌体负载量分别为1.539 6×10CFU·g和1.493 5×10CFU·g。由此可以得出草酸和氨水改性均可显著提高生物炭对菌体的吸附能力,草酸改性可提高43.34%,氨水改性可提高47.77%。后续对CW及改性生物炭中表现最优、代表性最强的NCW15 和CCW15这3 种生物炭进行深入探究。
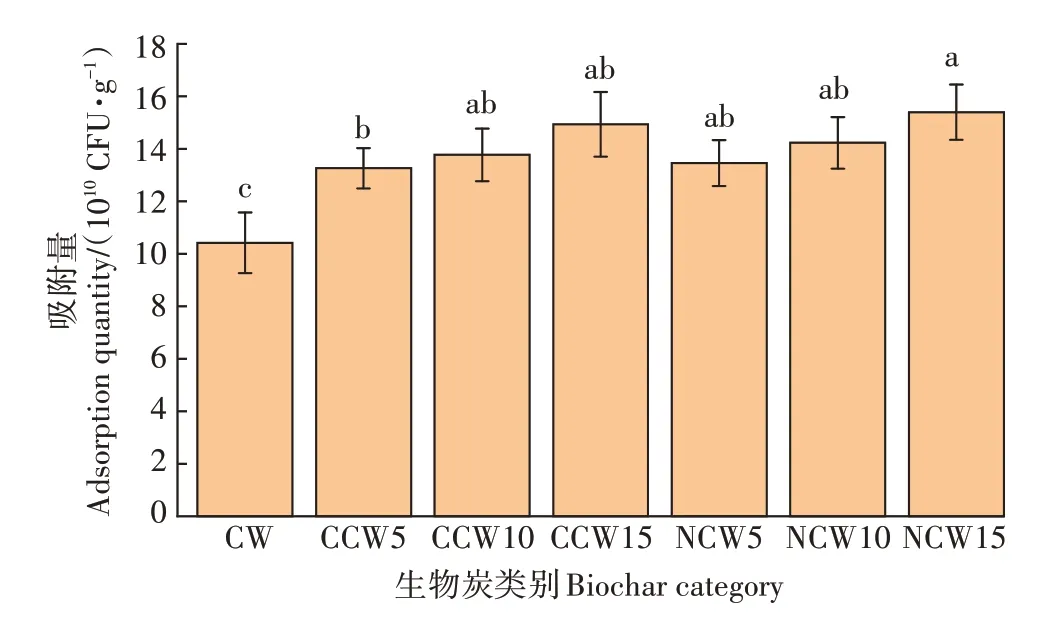
图2 不同生物炭吸附平衡时负载菌体量Figure 2 The adsorption equilibrium of biochars
2.2 表征分析
2.2.1 元素组成及BET表征分析
生物炭元素组成与其芳香性和炭化程度有关。如表2 所示,3 种生物炭含C 量均高于60%,与CW 相比,草酸与氨水改性分别提高了生物炭O 元素及N 元素的含量。O、N 含量的提高,意味着与CW 相比,CCW15 及NCW15 在土壤中被微生物利用的效率提高。

表2 生物炭元素组成Table 2 The composition of biochar elements
表面积、孔径、孔容等性能是影响生物炭吸附能力的关键因素,因此对CW、NCW15 和CCW15 进行BET 表征。图3(a)为炭材料的N吸附−脱附曲线,图中3 种生物炭的吸/脱附曲线呈现相似趋势。吸附速率先增加后稳定随后再增加,为Ⅱ型等温线(S 形等温线),在低相对压力区有拐点,而在蒸气压饱和时,吸附层数无限大,这表明炭材料以中孔为主,与葛欣宇等的研究结果相似。图3(b)为炭材料的孔容分布曲线,由图可知,CCW15 在3.7 nm 孔径处,孔容出现增长,这可能是由于高浓度草酸使其微孔结构发生细微改变,使生物炭3.7 nm孔径处的孔洞结构有所增加。CW、CCW15、NCW15 的比表面积为562~566 m·g,孔容为0.463~0.468 m·g,孔径为3.28~3.34 nm,3 种材料的BET 总测试结果差异不明显,表明这两种改性方式对原始生物炭的物理结构改变较小。VITHANAGE等的研究也表明草酸改性对生物炭形貌的影响十分有限。改性生物炭材料均有较大的比表面积和较多的孔结构,证明其为合适的菌剂载体。同时,由于形貌结构无显著差异,推测图1 中吸附的差异可能是由炭材料化学性质的改变引起的。

图3 N2吸附−脱附曲线及孔容分布曲线Figure 3 The N2 adsorption−desorption curve and the pore volume distribution curve
2.2.2 XPS分析


表3 生物炭表面C、N、O元素百分比(%)Table 3 Percentage of elements C,N and O in surface of biochar(%)

图4 改性前后生物炭XPS图Figure 4 XPS diagrams of biochars before and after modification
2.2.3 表面形貌
通 过SEM 对 负 载SL−44 前 后CW、CCW15、NCW15 的形貌结构进行观察。改性前后均可观察到生物炭的孔洞结构以及片层结构,且表面均有被侵蚀的痕迹(图5),这表明氨水和草酸改性均未改变生物炭的表面形貌结构,与BET 测试结果一致。图5(d)~图5(f)显示生物炭负载的SL−44 是椭圆形短棒状结构,直径约0.5~1.0 μm,且3 种生物炭表面均有大量SL−44 负载,这说明CW、CCW15、NCW15 均为适合的菌剂载体。

图5 CW、CCW15、NCW15吸附菌体前后的扫描电镜图(×5 000倍)Figure 5 Scanning electron microscopy of CW,CCW15 and NCW15 before and after adsorption of SL−44(×5 000 times)
2.3 生物炭吸附菌体的机理研究
2.3.1 静电力对菌体吸附的影响
官能团的改变会对生物炭的电负性产生影响,羧基会增加材料表面的电负性,而氨基可以使生物炭拥有更多的正电荷。为了研究静电力对生物炭吸附SL−44的影响,测定了CW、CCW15、NCW15以及菌SL−44 在pH=7 时的zeta 电位,结果显示,SL−44、CCW15、CW和NCW15的zeta电位分别为−30.3、−17.9、−15.6 mV 和−12.2 mV,与pH的测定结果相符。由于生物炭与SL−44 的zeta 电位值均为负值,在吸附过程中菌与炭之间会产生静电斥力,且NCW15<CW<CCW15。由此可知,NCW15 的zeta 电位对吸附最有利,而CCW15 的zeta 电位对吸附最不利。但CCW15对菌剂的吸附性能强于CW,因此推测生物炭表面的化学基团对吸附产生了一定的影响。
2.3.2 表面官能团对菌体吸附的影响
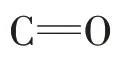

图6 SL−44与不同生物炭吸附SL−44前后的FTIR光谱图Figure 6 FTIR of SL−44,and different biochars befor and after the absorption of SL−44
2.3.3 吸附动力学
通过吸附动力学研究生物炭吸附菌体的速率快慢,从而探讨吸附过程的速率控制步骤。对CW、CCW15、NCW153 种代表性生物炭进行动力学分析,如表4 和图7 所示,3 种生物炭达到吸附平衡的时间均在20 min 左右。拟一级动力学平衡吸附量为1.003 2×10~1.527 4 ×10CFU·g,拟二级动力学平衡吸附量为1.055 4×10~1.440 8×10CFU·g,两者接近,且均与吸附实验中测定的吸附量相近。CCW15 的吸附动力学常数最大,且最先达到吸附平衡,这可能与其表面含氧官能团数量最多,更易与菌结合有关。动力学模型拟合结果表明,拟一级动力学模型的决定系数为0.985~0.991,拟二级动力学模型模拟的值为0.983~0.985,所以拟一级动力学模型更符合炭对菌的吸附过程。动力学实验表明生物炭对菌的吸附过程主要受液膜扩散的影响,与LIU等的研究结果相类似。3 种生物炭拟合所得值与实验测定值近似,且拟一级、拟二级动力学常数皆大于0.95,说明两种动力学模型均有较好的拟合度。拟二级动力学方程的拟合结果较好,表明吸附过程包括电子共享或电子得失等化学反应,表明3 种生物炭对SL−44 的吸附过程化学结合也发挥了非常重要的作用。
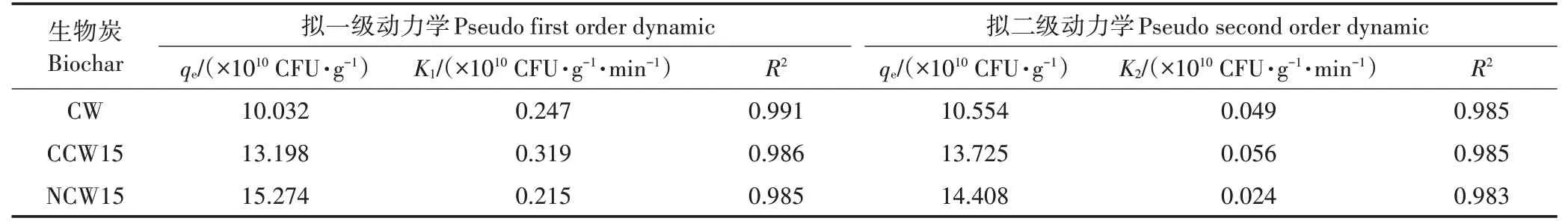
表4 生物炭吸附SL−44动力学模型参数Table 4 The kinetic model parameters of biochar adsorption for SL−44

图7 3 种生物炭吸附SL−44的动力学曲线Figure 7 Adsorption kinetics curves of the three biochar for SL−44
2.3.4 吸附等温线
通过吸附等温线来研究吸附过程的界面平衡,以更深入地了解生物炭对SL−44 的吸附性能。由图8可知,生物炭的平衡吸附能力随菌液初始浓度的增加而增大。3 种生物炭的最大吸附量排序为NCW15>CCW15>CW,这表明改性使生物炭的平衡吸附量与最大吸附量均得到提升。对比表5 中与2可知,与Freundich 模型相比,Langmuir 模型能更好地拟合SL−44 在生物炭上的细菌吸附,这说明生物炭上的活性位点分布较为均匀,且吸附过程以单层吸附为主。随着温度的升高,3 种炭材料的值与值减小,说明反应的亲和力减小,困难度变大,该结论与LIU等和WU 等的研究结果相类似。Freundlich 等温线的1/小于1,说明该吸附反应易于发生,且1/越低表明生物炭与菌体越易结合。表5 中1/值与图8 均说明,在28 ℃和38 ℃时生物炭吸附菌体能力为NCW15>CCW15>CW,且28 ℃时各平衡吸附量之间的差值大于38 ℃时。在48 ℃时CW 的吸附能力高于NCW15 的吸附能力。但常温下生物炭对菌体的吸附量均远大于48 ℃时,其中CW相差1.064×10CFU·g(提升10.0%)、CCW15 相差4.994×10CFU·g(提升48.5%)、NCW15 相 差6.002×10CFU·g(提 升61.6%),改性后的生物炭更适合在常温下对SL−44进行吸附。
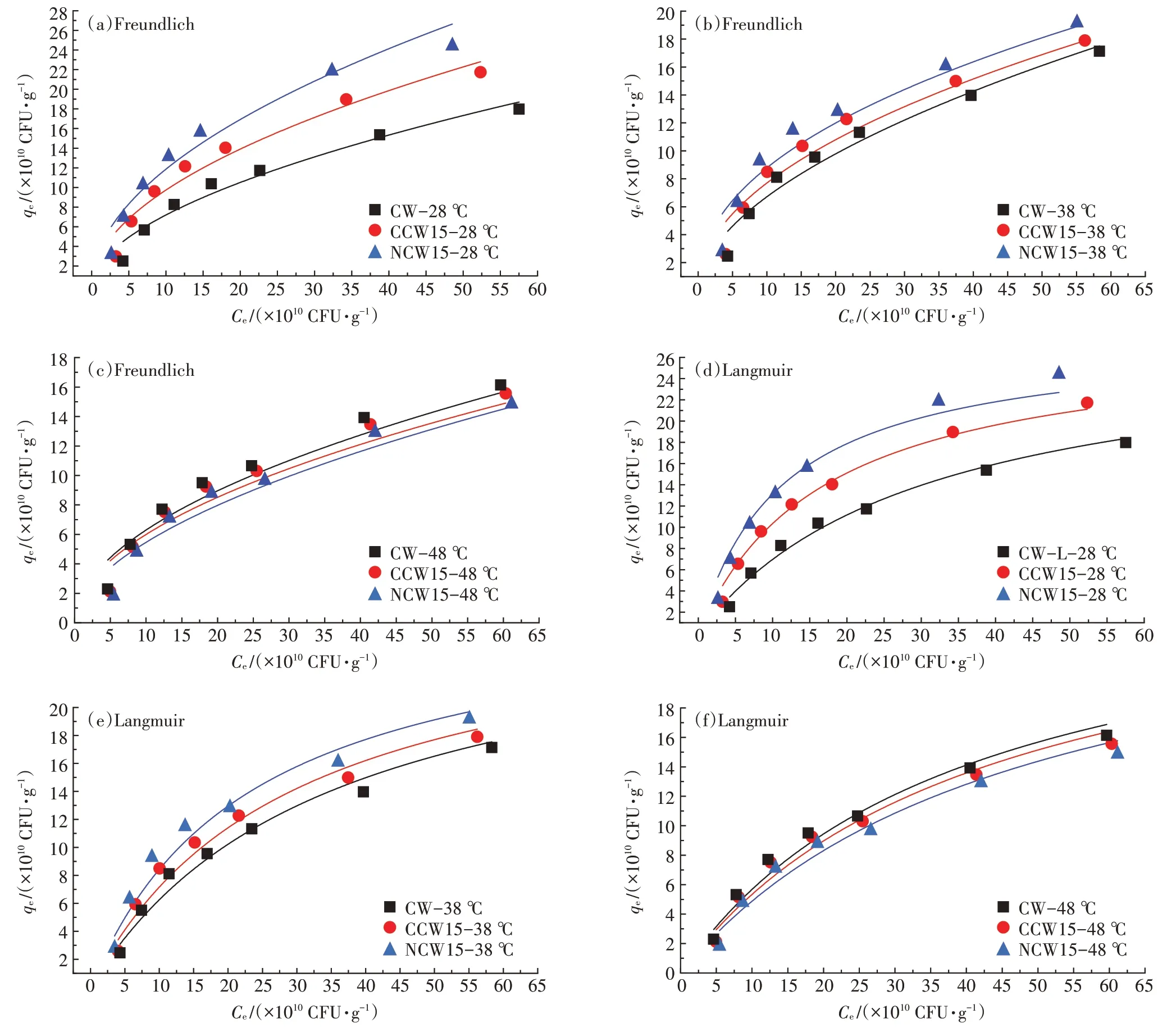
图8 3 种生物炭在不同温度下对SL−44吸附等温线图Figure 8 The adsorption isotherm of three biochars at different temperatures for SL−44
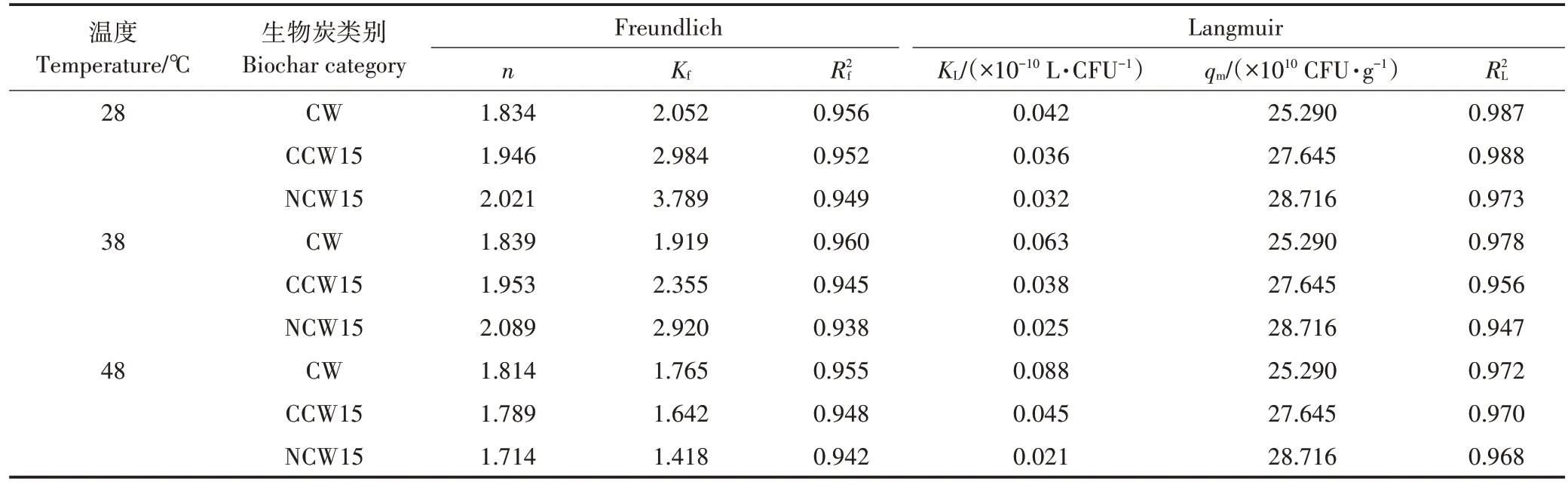
表5 生物炭吸附SL−44的Freundlich与Langmuir参数Table 5 Freundlich and Langmuir parameters of SL−44 adsorbed on biochar
2.3.5 吸附热力学
吉布斯自由能、焓和熵是热力学中常用的参数,如表6 所示,Δ<0 说明生物炭对菌体的吸附反应可以自发进行,Δ<0说明吸附为放热反应,温度升高会使反应的难度加大,且Δ的绝对值小于40 kJ·mol,说明吸附过程以物理吸附为主,这与吸附动力学分析结果相吻合。焓变的绝对值越大,温度改变对吸附的影响越大,表中Δ>Δ>Δ,且差值较大,说明温度升高对这3 种生物炭吸附菌的影响程度不同,且CW<CCW15<NCW15。除此以外,吸附焓变的绝对值随着吸附质浓度的增加而变大,这说明吸附过程中,吸附质会优先占据有利的吸附位点,随着吸附的进行,吸附的难度会变大,这表明了吸附剂的不均一性,拥有利于吸附的表面结构。CW、CCW15、NCW15 的Δ有正有负,但总体变化较小,这是由于吸附过程往往伴随着溶剂分子的脱附,虽然被吸附的分子其运动被束缚,但脱附分子的运动趋于无序,当脱附分量子大于被吸附的SL−44的量时,体系的混乱程度增加,反之则减小。
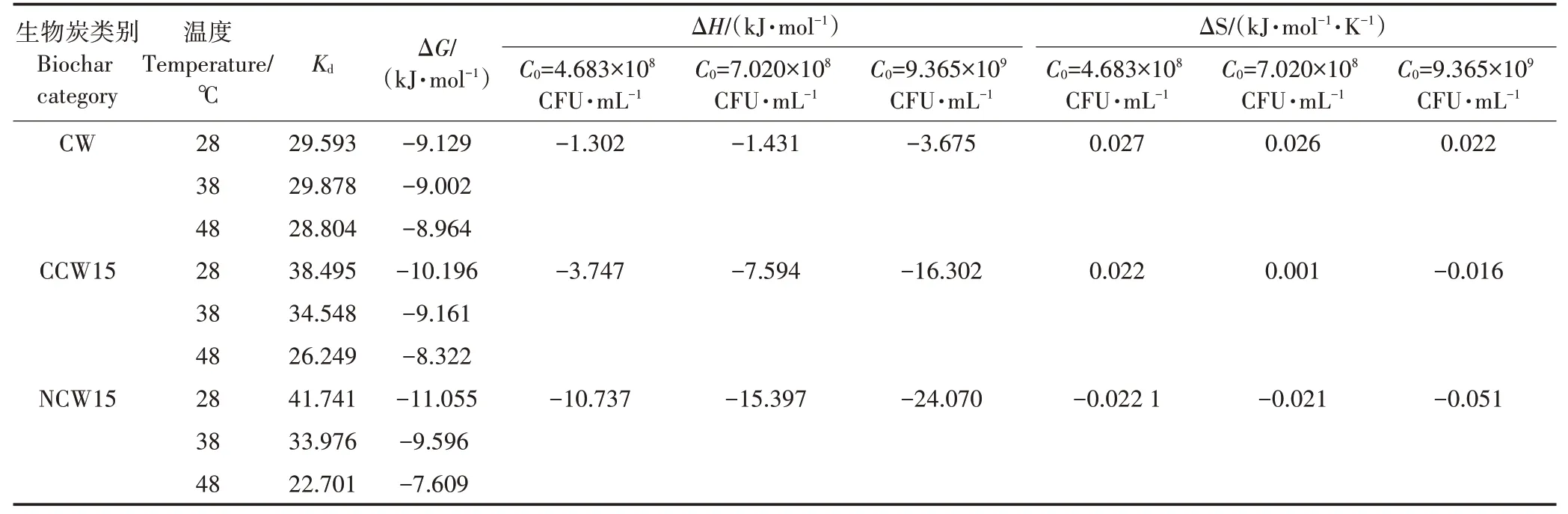
表6 在不同温度下生物炭吸附SL−44的热力学参数Table 6 Thermodynamic parameters of SL−44 adsorption by biochar at different temperatures
2.3.6 吸附过程解析


图9 生物炭改性及吸附过程Figure 9 Modification and adsorption process of biochar
2.3.7 菌剂菌体存活性能
如图10 所示,活菌数随着保藏时间的增加而下降。CW、CCW15、NCW15 的初始活菌数分别为4.19×10、4.47×10、5.28×10CFU·g,在保存120 d 后活菌数分别为2.14×10、2.33×10、3.44×10CFU·g。氨水改性生物炭与未改性相比,其活菌数提高26.01%,保藏4个月后,存活率分别为51.1%、65.2%,氨水改性使存活率亦提高14.1 个百分点,保藏前后活菌数均为NCW15>CCW15>CW,与生物炭载体的吸菌能力相吻合,然而3 种载体中NCW15 的活菌数远高于CCW15与CW,这与在对载体吸菌能力的探究中,NCW15 与CCW15 的负载量相近且远高于CW 不符。研究表明枯草芽孢杆菌的适宜pH 在6.79 左右,当pH<5.5 或>8.5 时,将对其生长存活不利,CW、CCW15、NCW15的pH 值分别为7.12、3.01、8.32,其中CW 的pH 与枯草芽孢杆菌的最适pH相近,而CCW15的pH值对SL−44 的存活不利。因此,虽然CCW15 的吸菌量远大于CW,但两者最终保存性能相似。
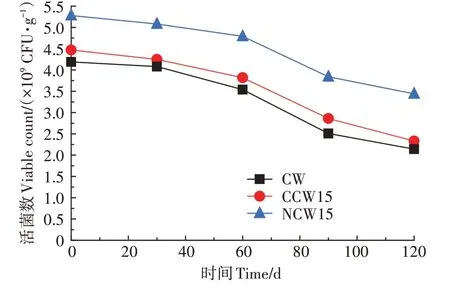
图10 生物炭菌剂菌体存活性能Figure 10 Survivability of biochar bacteria
3 结论
(1)草酸改性在生物炭表面引入羧基、醛基、酮基官能团,氨水改性在生物炭表面引入氨基官能团,官能团的变化使生物炭的性能发生改变。草酸改性使生物炭电负性升高,氨水改性则使其电负性降低。改性前后生物炭的形貌结构得到保留,比表面积没有降低,均在565 m·g左右。两种改性均提升了生物炭的吸附能力,且随着改性剂浓度的增加,吸菌量增加。与CW 相比,CCW15 和NCW15 的菌体吸附量提升了40%以上。
(2)生物炭吸附SL−44的过程虽然以物理吸附为主,但化学反应在吸附过程中也占有重要比重,且吸附过程主要为单分子层吸附,影响吸附的主要步骤是液膜扩散步骤。生物炭表面的羟基、羧基、醛基、酮基以及氨基官能团增加了化学吸附位点,在吸附过程中与菌体的羧基、氨基、磷酸基团以及酰胺结合,提升了生物炭在常温下的吸附性能。
(3)生物炭吸附SL−44 的过程可自发进行,吸附过程是放热行为,温度升高会使吸附的难度加大。常温更有利于改性生物炭对菌体的吸附。
