白果内酯对组胺诱导的气道平滑肌细胞AKT/NF-κB/cyclin D1信号通路及凋亡的影响
2022-03-17邓鸿杰谭娟陈绍平
邓鸿杰 谭娟 陈绍平
气道重构是慢性气道疾病的主要表现特征,涉及气道壁细胞的组成和功能改变,可导致不同程度的不完全可逆且进行性加重的气流受限,使相关疾病的治疗复杂化[1]。气道平滑肌细胞(airway smooth muscle cell,ASMC)是涉及气道的结构细胞,在受到生长因子、炎性递质等外界信号刺激后恶性增殖,进一步释放促炎、抗炎因子加重气道炎性反应及气道重构[2,3]。蛋白激酶B(protein kinase B,AKT)信号通路是人体内的基础信号转导通路之一,可调控下游核因子κB(nuclear factor kappa B,NF-κB)、细胞周期蛋白D1(cyclin D1)调控炎性反应及细胞的增殖、凋亡[4,5]。研究显示,AKT/NF-κB/cyclin D1信号通路与胆脂瘤上皮细胞增生的调控有关,在小鼠Ⅱ型肺泡上皮细胞数量、功能改变中发挥重要作用[6,7]。白果内酯是从银杏叶中提取的倍半萜类化合物,具有抗炎、抗氧化活性,可通过NF-κB通路减轻非酒精性脂肪肝炎大鼠肝纤维化程度[8]。组胺作为常见的炎性介质,可介导慢性炎性反应,影响呼吸道上皮屏障功能[9]。本研究采用组胺诱导ASMC模拟气道重构过程中的炎症环境,探讨白果内酯对组胺诱导的ASMC AKT/NF-κB/cyclin D1信号通路及凋亡的影响。
1 材料与方法
1.1 试剂与仪器 人ASMC细胞(货号:FE992)购自美国ATCC细胞库;胎牛血清(货号:FBS500-S)购自澳大利亚AusGeneX公司;DMEM培养基(货号:KL-P0032)购自德国merck/sigma公司;组胺、白果内酯(货号:D2466、D0166)购自上海宝曼生物科技有限公司;MTT溶液(货号:N/A-896)购自美国AMEKO公司;AnnexinV-FITC/PI细胞凋亡检测试剂盒(货号:S0185)购自哈尔滨新海基因检测有限公司;p-AKT抗体、AKT抗体、p-NF-κB p65抗体、NF-κB p65抗体、cyclin D1抗体、GAPDH抗体(货号:ab32505、ab192623、ab183559、ab32536、ab16663、ab181602)购自abcam公司;辣根过氧化物酶标记的羊抗兔(货号:0295G-HRP)购自美国santa公司;人白介素-6(interleukin-6,IL-6)、白介素-1β(interleukin-1β,IL-1β)酶联免疫(enzyme-linked immunosorbent assay,ELISA)试剂盒(货号:EK0410、EK0392)购自美国Sciencell公司;人肿瘤坏死因子α(tumor necrosis factor-alpha,TNF-α)ELISA试剂盒(货号:YS-E6101)购自上海研生实业有限公司;恒温培养箱(型号:MIR-162-PC/MIR-262-PC)购自日本松下公司;酶标仪(型号:Stat Fax-2100)购自美国Awareness公司;流式细胞仪(型号:BD FACSCanto Ⅱ)购自美国BD公司;化学发光成像系统(型号:ChemiDocXRS)购自美国Bio-Rad公司。
1.2 实验方法
1.2.1 细胞培养:将ASMC细胞接种至含10%胎牛血清的DMEM培养液中,2~3 d换液1次,在37℃、5% CO2恒温培养箱中常规培养至细胞融合率达85%左右时传代培养。
1.2.2 MTT法检测不同浓度组胺对ASMC细胞增殖的影响:取处于对数生长期的ASMC细胞,以1×105个/ml、100 μl/孔接种于96孔板,分别加入终浓度为0 μmol/L、0.1 μmol/L、1 μmol/L、10 μmol/L、100 μmol/L、1 000 μmol/L的组胺常规培养48 h,每孔加入5 g/L MTT溶液20 μl,继续培养4 h,吸弃培养液,加入二甲基亚枫150 μl,充分溶解后使用酶标仪检测波长450 nm处的吸光度(optical density,OD)值。
1.2.3 细胞分组:取处于对数生长期的ASMC细胞,以1×105个/ml、100 μl/孔接种于96孔或6孔培养板,分为对照组、组胺组、低剂量白果内酯组、中剂量白果内酯组、高剂量白果内酯组。其中对照组不进行处理,组胺组加入终浓度为100 μmol/L的组胺,低剂量白果内酯组、中剂量白果内酯组、高剂量白果内酯组均加入终浓度为100 μmol/L的组胺,并加入终浓度分别为2、4、8 μmol/L的白果内酯。
1.2.4 MTT法检测5组ASMC细胞增殖情况:将按照1.2.3分组处理的ASMC细胞培养48 h,按照1.2.2方法检测各组OD值。
1.2.5 流式细胞仪检测5组ASMC细胞凋亡情况:将按照1.2.3分组处理的ASMC细胞培养48 h,收集细胞,调整细胞浓度为1×106个/ml,按照Annexin V-FITC/PI凋亡检测试剂盒说明书步骤进行操作,依次加入5 μl Annexin V-FITC溶液、5 μl PI溶液,避光培养1 h,使用流式细胞仪检测各组细胞凋亡率。
1.2.6 酶联免疫法(enzyme-linked immunosorbent assay,ELISA)检测5组ASMC细胞上清液中炎性因子水平:将按照1.2.3分组处理的ASMC细胞培养48 h,1 000 r/min离心5 min收集上清液,按照IL-6、IL-1β、TNF-α ELISA试剂盒说明书步骤进行操作,使用酶标仪测定波长450 nm处的OD值,根据标准液吸光度结果计算IL-6、IL-1β和TNF-α水平。
1.2.7 蛋白免疫印迹法(Western blot)检测5组ASMC细胞中AKT/NF-κB/cyclin D1信号通路相关蛋白表达:将按照1.2.3分组处理的ASMC细胞培养48 h,收集细胞,磷酸缓冲盐溶液洗涤,加细胞裂解液裂解、离心提取各组细胞总蛋白,二喹啉甲酸法进行蛋白定量。凝胶电泳分离等量蛋白质,转膜、含5%脱脂奶粉的TBST封闭2 h,分别加入p-AKT抗体、AKT抗体、p-NF-κB p65抗体、NF-κB p65抗体、cyclin D1抗体、GAPDH抗体(1∶500),4℃孵育过夜,TBST洗涤,加入羊抗兔二抗(辣根过氧化物酶标记,1∶2 000),室温孵育2 h,TBST洗涤,化学发光法显色并曝光,凝胶成像系统拍摄图像,Tanon 600系统分析条带灰度,以GAPDH蛋白为内参,计算目的蛋白相对表达量。
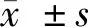
2 结果
2.1 不同浓度组胺对ASMC细胞增殖的影响 与0 μmol/L比较,0.1、1、10 μmol/L组胺处理下ASMC细胞OD值差异无统计学意义(P>0.05),100、1 000 μmol/L组胺处理下ASMC细胞OD值显著升高(P<0.05),故后续实验中选用100 μmol/L组胺作为处理ASMC细胞的浓度。见表1。

表1 不同浓度组胺处理下ASMC细胞OD值比较
2.2 5组ASMC细胞增殖情况 与对照组比较,组胺组ASMC细胞OD值显著升高(P<0.05)。与组胺组比较,低、中、高剂量白果内酯组ASMC细胞OD值均显著降低(P<0.05)。随着白果内酯剂量的升高,ASMC细胞OD值逐次降低(P<0.05)。见表2。

表2 5组ASMC细胞OD值比较
2.3 5组ASMC细胞凋亡情况 与对照组比较,组胺组ASMC细胞凋亡率显著降低(P<0.05)。与组胺组比较,低、中、高剂量白果内酯组ASMC细胞凋亡率均显著升高(P<0.05)。随着白果内酯剂量的升高,ASMC细胞凋亡率逐次升高(P<0.05)。见图1,表3。

图1 5组ASMC细胞凋亡情况

表3 5组ASMC细胞凋亡率比较
2.4 5组ASMC细胞上清液中炎性因子水平 与对照组比较,组胺组ASMC细胞上清液中IL-6、IL-1β和TNF-α水平显著升高,差异有统计学意义(P<0.05)。与组胺组比较,低、中、高剂量白果内酯组ASMC细胞上清液中IL-6、IL-1β和TNF-α水平均显著降低,差异有统计学意义(P<0.05)。随着白果内酯剂量的升高,ASMC细胞上清液中IL-6、IL-1β和TNF-α水平逐次降低(P<0.05)。见表4。

表4 5组ASMC细胞上清液中IL-6、IL-1β和TNF-α水平比较
2.5 5组ASMC细胞中AKT/NF-κB/cyclin D1信号通路相关蛋白表达情况 与对照组比较,组胺组ASMC细胞中p-AKT/AKT、p-NF-κB p65/NF-κB p65、cyclin D1蛋白表达水平显著升高,差异有统计学意义(P<0.05)。与组胺组比较,低、中、高剂量白果内酯组ASMC细胞中p-AKT/AKT、p-NF-κB p65/NF-κB p65、cyclin D1蛋白表达水平均显著降低,差异有统计学意义(P<0.05)。随着白果内酯剂量的升高,ASMC细胞中p-AKT/AKT、p-NF-κB p65/NF-κB p65、cyclin D1蛋白表达水平逐次降低(P<0.05)。见图2,表5。

图2 5组ASMC细胞中AKT/NF-κB/cyclin D1信号通路相关蛋白表达情况

表5 5组ASMC细胞中p-AKT、AKT、p-NF-κB p65、NF-κB p65、cyclin D1蛋白表达水平比较
3 讨论
哮喘、慢性阻塞性肺疾病是常见的慢性气道疾病,发生气道重塑后,会引起慢性阻塞性肺疾病患者气道腔狭窄扭曲及肺气肿形成,哮喘患者对常规治疗药物的反应性降低,导致治疗难度加大,病死率升高[10]。ASMC同时是气道重塑的效应细胞及气道炎症的靶细胞,在长期炎症等因素的刺激下发生增生、凋亡抑制等改变,表达释放的细胞因子、生长因子及蛋白酶类增多,会引起气道重塑,最终导致肺功能下降[11]。组胺是常见的炎性介质,本研究证实,随着组胺处理浓度的升高,ASMC细胞OD值逐次升高,即组胺可增强ASMC细胞的增殖能力,且100 μmol/L组胺即可显著提高ASMC细胞的增殖能力,故选择100 μmol/L作为后续实验中处理ASMC细胞的组胺浓度。
白果内酯是从银杏叶提取物中分离、鉴定出的倍半萜物质,占银杏提取物的2.9%~3.2%[12]。高琳等[13]研究发现,银杏叶提取物治疗慢性阻塞性肺疾病的疗效显著,能促进气道重塑,改善呼吸状态与肺功能,提高预后。谭玉萍等[14]研究发现,银杏叶提取物对慢性阻塞性肺疾病模型大鼠气道重塑及肺血管重塑具有抑制作用。本研究结果显示,使用组胺处理后,ASMC细胞OD值显著升高,细胞凋亡率显著降低;在此基础上加入白果内酯,ASMC细胞OD值显著降低,细胞凋亡率显著升高,提示白果内酯可抑制组胺对ASMC细胞的增殖促进、凋亡抑制作用,且随着白果内酯处理剂量的升高,对ASMC细胞的增殖抑制、凋亡促进作用越强,但其具体调控机制尚不清楚。
Priyanka等[15]研究显示,白果内酯通过控制NF-κB和JNK的活化,减少炎性因子分泌,减少低氧诱导的炎性反应对3T3-L1脂肪细胞的影响。熊丽丹等[16]研究发现,白果内酯、银杏内酯B能减少H2O2诱导的超氧化物歧化酶、谷胱甘肽过氧化物酶活性降低,抑制丙二醛释放增加,减少活性氧产量,减少炎性因子TNF-α、IL-1β、IL-6生成,对人角质形成细胞氧化损伤起保护作用。本研究结果显示,组胺诱导后,ASMC细胞上清液中IL-6、IL-1β和TNF-α水平显著升高;在此基础上加入白果内酯处理后,ASMC细胞上清液中IL-6、IL-1β和TNF-α水平均显著降低,提示白果内酯可减轻ASMC细胞中的炎性因子水平,可能通过减轻炎症刺激,抑制ASMC细胞发生增生、凋亡抑制改变。
AKT信号通路是细胞内的重要信号转导通路之一,可影响下游多种效应分子的活化,在细胞增殖、凋亡中发挥关键作用[17]。NF-κB通路是炎性反应的关键通路,可诱导IL-1β、IL-6分泌[18]。cyclin D1是细胞周期调控蛋白,在细胞凋亡过程中发挥重要作用[19]。研究发现,NF-κB通路与cyclin D1表达密切相关,抑制NF-κB信号通路可抑制cyclin D1的表达[20]。Liu等[6]研究显示,EGFR/Akt/NF-κB/cyclin D1信号通路激活参与了胆脂瘤上皮细胞的增生机制。阮玲瑛等[7]研究显示,Akt通路、NF-κB通路、cyclin D1参与Brg1基因敲除后小鼠肺泡Ⅱ型上皮细胞数量、功能发生改变的作用机制。本研究结果显示,组胺诱导后,ASMC细胞中AKT磷酸化、NF-κB p65磷酸化、cyclin D1蛋白表达水平显著升高;白果内酯处理后,AKT磷酸化、NF-κB p65磷酸化、cyclin D1蛋白表达水平均显著降低,提示白果内酯可抑制组胺对AKT/NF-κB/cyclin D1信号通路的激活,可能通过抑制AKT激活进而抑制NF-κB p65磷酸化,减轻炎性反应并抑制cyclin D1表达,最终抑制组胺对ASMC细胞的增殖促进、凋亡抑制作用。
综上所述,白果内酯对组胺诱导的ASMC细胞具有增殖抑制、凋亡促进作用,并减轻炎性反应,其作用机制可能与抑制AKT/NF-κB/cyclin D1信号通路激活有关。
