miR-25-3p靶向ADAM15保护脓毒症诱导的人脐静脉内皮细胞损伤
2022-03-17郭伟黎艳晖陈亮李琪
郭伟 黎艳晖 陈亮 李琪
脓毒症是一种严重危及生命的疾病,是全球住院患者死亡的主要原因。内皮细胞是心脏和血管系统的基本组成部分,其形成血管内皮并维持血管稳态[1]。细菌内毒素、炎性因子等刺激可引起血管内皮细胞功能障碍,导致血管屏障功能丧失,进而参与包括脓毒症在内的多种疾病发生和进展[2]。因此,明确内皮细胞损伤的分子机制为开发新的脓毒症治疗策略至关重要。微小RNA(miRNA)是一种非编码小分子RNA,参与转录后基因表达的调控,越来越多的研究证实其在微调或维持血管内皮功能中具有关键作用[3,4]。研究显示脓毒症患者外周血中miR-25-3p表达降低,恢复其表达可降低巨噬细胞迁移能力,抑制炎性细胞因子分泌[5]。去整合素金属蛋白酶15(ADAM15)是由5个胞外结构域和一个包含Src同源对接位点组成的跨膜蛋白,其在调节细胞、基质粘附和信号传导中具有重要功能。研究指出ADAM15表达增加可提高血管内皮通透性,促进炎性细胞迁移,导致脓毒症过程中的内皮屏障功能障碍[6]。本研究通过starbase在线分析发现ADAM15是miR-25的潜在靶点,于是推测miR-25-3p可能靶向ADAM15在脓毒症内皮细胞损伤中发挥作用。脂多糖(LPS)已被证实是导致脓毒症血管内皮损伤主要致病因素[7],本研究以人脐静脉内皮细胞(HUVEC)为研究对象,探讨miR-25-3p靶向ADAM15对LPS诱导的HUVEC损伤的影响,以期为临床脓毒症治疗提供新的见解。
1 材料与方法
1.1 材料 HUVEC购于上海奥陆生物科技公司;逆转录试剂盒、SYBR Green PCR Master Mix购自大连Takara公司;miRNA逆转录试剂盒、miRNA分析试剂盒购于美国ABI公司;噻唑蓝(MTT)购于上海贝博生物;膜联蛋白V-异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)细胞凋亡检测试剂盒购于杭州联科生物公司;丙二醛(MDA)含量检测试剂盒以及乳酸盐脱氢酶(LDH)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性检测试剂盒购于北京索莱宝公司;兔源ADAM15、细胞周期素D1(CyclinD1)、p21、β肌动蛋白(β-actin)、B细胞淋巴瘤(Bcl-2)和Bcl相关x蛋白(Bax)单克隆抗体以及羊抗兔IgG第二抗体购于上海艾博抗公司;miR-25-3p模拟物(mimics)及其对照(miR-con)、miR-25-3p抑制物(anti-miR-25-3p)及其对照(anti-miR-con)、ADAM15小干扰RNA(si-ADAM15)及其对照(si-con)、空载体质粒(pcDNA)、ADAM15过表达载体(pcDNA-ADAM15)以及荧光素酶报告载体购于广州锐博公司。
1.2 方法
1.2.1 细胞培养:HUVEC采用内皮细胞基础培养基EBM-2在37℃含5%CO2的细胞培养箱中培养。以100 ng/ml的LPS处理第3代对数期HUVEC 24 h建立血管内皮细胞损伤模型[7]。
1.2.2 实时定量PCR(RT-qPCR)检测miR-25-3p和ADAM15 mRNA表达:使用TRIzol试剂从细胞中分离总RNA。为检测ADAM15 mRNA表达,使用逆转录试剂盒将2 μg的RNA反转录为cDNA,再用SYBR Green PCR Master Mix进行RT-qPCR。为了检测miR-25-3p的表达,使用miRNA逆转录试剂盒进行逆转录,再用miRNA分析试剂盒进行RT-qPCR。2-ΔΔCT法计算miR-25-3p(内参为U6)和ADAM15 mRNA(内参为β-actin)表达量。miR-25-3p上游引物5’-CATTGCACTTGTCTCGGTCTGA-3’,下游引物5’-GCTGTCAACGATACGCTACGTAACG-3’;U6上游引物5’-CTCGCTTCGGCAGCACA-3’,下游引物5’-AACGCTTCACGAATTTGCGT-3’;ADAM15上游引物5’-GCTGGCAGTCTC GTCCTACCAGAGGCG-3’,下游引物5’-GGTGCACCCAGCTGCAGTTCAGCTCAGTCC-3’;β-actin上游引物5’-TGGACTTCGAGCAGGAAATGG-3’,下游引物5’-ACGTCGCACTTCATG ATCGAG-3’。
1.2.3 转染和分组:以5×105/孔的密度接种HUVEC在6孔板中,24 h后使用Lipofectamine 2000将miR-con、miR-25-3p mimics、si-con、si-ADAM15、miR-25-3p mimics与pcDNA、miR-25-3p mimics与pcDNA-ADAM15分别转染至HUVEC,收获转染48 h细胞。用100 ng/ml的LPS处理转染细胞24 h,根据转染序列或载体不同分为LPS +miR-con组、LPS +miR-25-3p组、LPS+si-con组、LPS+si-ADAM15组、LPS +miR-25-3p+pcDNA组、LPS +miR-25-3p+pcDNA-ADAM15组。未转染HUVEC采用100 ng/ml的LPS处理24 h记为LPS组。未处理HUVEC记为PBS组。
1.2.4 MTT实验检测细胞活力:以5×103个细胞/孔的密度将各组HUVEC接种于96孔板,37℃培养箱孵育48 h后,每孔分别加入20 μl的MTT试剂,培养箱继续孵育4 h,每孔再加入150 μl的二甲基亚砜,低速振荡至结晶溶解。用酶标仪在490 nm波长下测定光密度(OD)值。
1.2.5 流式细胞术检测细胞凋亡:将各组细胞重悬于500 μl结合缓冲液中,分别添加10 μl的Annexin V-FITC、5 μl的PI,在室温下于黑暗环境中孵育30 min后,立即采用流式细胞仪分析样品。Annexin-V阳性细胞为凋亡细胞。
1.2.6 试剂盒检测MDA含量以及LDH、SOD和GSH-Px活性:收集各组细胞至离心管内,离心后弃上清。按照试剂盒说明书加入提取液,冰浴、超声波破碎细胞,4℃离心机10 000 r/min离心10 min,取上清置于冰上。按照各个试剂盒操作步骤分别测定MDA含量以及LDH、SOD、GSH-Px活性。
1.2.7 蛋白质印记检测ADAM15、CyclinD1、p21、Bcl-2和Bax蛋白表达:使用含有蛋白酶抑制剂的RIPA裂解缓冲液裂解细胞。12 000 r/min离心10 min去除细胞碎片。蛋白质定量后,通过聚丙烯酰胺凝胶电泳分离,并转移蛋白至聚偏二氟乙烯膜上。将膜在含5%脱脂牛奶的缓冲液中封闭1 h,然后与第一抗体(1∶1 000稀释)在4℃下过夜。β-actin抗体(1∶1 500稀释)作为内参对照。室温下与对应的二级抗体(1∶2 000稀释)孵育1 h后,用电化学发光试剂盒进行印迹显色。Quantity One定量软件分析各条带光密度值,计算目的蛋白相对表达量。
1.2.8 双荧光素酶报告实验:starbase在线预测miR-25-3p的靶基因。合成含有miR-25-3p结合位点的ADAM15的野生(WT)型3’-非编码区(UTR)序列以及突变(MUT)型3’-UTR序列。将WT/MUT-3’-UTR序列连接到荧光素酶报告质粒获得荧光素酶报告载体WT-ADAM15-3’UTR、MUT-ADAM15-3’UTR。将WT/MUT-ADAM15-3’UTR分别与miR-25-3p mimics、miR-con共转染HUVEC。48 h后裂解细胞。使用双重萤光素酶报告基因检测系统测定细胞的萤火虫和海肾萤光素荧光素酶,以萤火虫荧光素酶活性和海肾荧光素酶活性比值表示相对荧光素酶活性。同时将miR-con、miR-25-3p mimics、anti-con、anti-miR-25-3p分别转染HUVEC,蛋白质印迹法分析ADAM15蛋白表达情况。
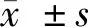
2 结果
2.1 miR-25-3p和ADAM15在经LPS处理的HUVEC中的表达水平 与PBS组比较,LPS组HUVEC中miR-25-3p表达量显著降低,而ADAM15 mRNA和蛋白表达量显著增加,差异有统计学意义(P<0.05)。见表1,图1。

表1 miR-25-3p和ADAM15 mRNA在LPS处理的HUVEC中的表达水平

图1 ADAM15蛋白的表达
2.2 miR-25-3p过表达对LPS处理的HUVEC增殖、凋亡的影响 与PBS组比较,LPS组HUVEC中miR-25-3p表达量显著降低(P<0.05),细胞活力、CyclinD1和Bcl-2蛋白表达量、SOD和GSH-Px活性显著降低(P<0.05),凋亡率、p21和Bax蛋白表达量、MDA含量以及LDH释放量显著升高(P<0.05);与LPS +miR-con组比较,LPS+miR-25-3p组HUVEC中miR-25-3p表达量显著升高(P<0.05),细胞活力、CyclinD1和Bcl-2蛋白表达量、SOD和GSH-Px活性显著升高(P<0.05),凋亡率、p21和Bax蛋白表达量、MDA含量以及LDH释放量显著降低(P<0.05)。见表2、3,图2。


图2 miR-25-3p过表达对LPS处理的HUVEC增殖、凋亡的影响;A 细胞凋亡流式图;B 凋亡、增殖相关蛋白表达

表2 miR-25-3p过表达对LPS处理的HUVEC增殖、凋亡的影响

表3 miR-25-3p过表达对LPS处理的HUVEC中MDA、SOD、LDH、GSH-Px的影响
2.3 miR-25-3p与ADAM15直接相互作用 Starbase软件预测到miR-25-3p与ADAM15之间存在互补的核苷酸序列。与转染miR-con比较,转染miR-25-3p mimics显著降低WT-ADAM15-3’UTR的相对荧光素酶活性(P<0.05),而对MUT-ADAM15-3’UTR的相对荧光素酶活性影响不显著。与miR-con组比较,miR-25-3p组HUVEC中miR-25-3p表达量显著增加,ADAM15蛋白表达量显著减少,差异有统计学意义(P<0.05);与anti-con组比较,anti-miR-25-3p组HUVEC中miR-25-3p表达量显著减少,ADAM15蛋白表达量显著增加,差异有统计学意义(P<0.05)。见表4、5,图3、4。

表4 双荧光素酶实验

表5 miR-25-3p调控ADAM15的表达

图3 miR-25-3p与ADAM15存在互补核苷酸序列

图4 ADAM15蛋白的表达
2.4 沉默ADAM15对LPS处理的HUVEC增殖、凋亡的影响 与LPS+si-con组比较,LPS+si-ADAM15组HUVEC中ADAM15 mRNA和蛋白表达量显著降低(P<0.05),细胞活力、CyclinD1和Bcl-2蛋白表达量、SOD和GSH-Px活性显著升高(P<0.05),凋亡率、p21和Bax蛋白表达量、MDA含量以及LDH释放量显著降低(P<0.05)。见表6、7,图5。

图5 沉默ADAM15对LPS处理的HUVEC增殖、凋亡的影响;A 细胞凋亡流式图;B 凋亡、增殖相关蛋白表达

表6 沉默ADAM15对LPS处理的HUVEC增殖、凋亡的影响
2.5 过表达ADAM15逆转了miR-25-3p过表达对LPS处理的HUVEC细胞增殖凋亡的影响 与LPS +miR-25-3p+pcDNA组比较,LPS+miR-25-3p+pcDNA-ADAM15组HUVEC中ADAM15 mRNA和蛋白表达量显著升高(P<0.05),细胞活力、CyclinD1和Bcl-2蛋白表达量、SOD和GSH-Px活性显著降低(P<0.05),凋亡率、p21和Bax蛋白表达量、MDA含量以及LDH释放量显著升高(P<0.05)。见图6,表8、9。

表7 沉默ADAM15对LPS处理的HUVEC中MDA、SOD、LDH、GSH-Px的影响
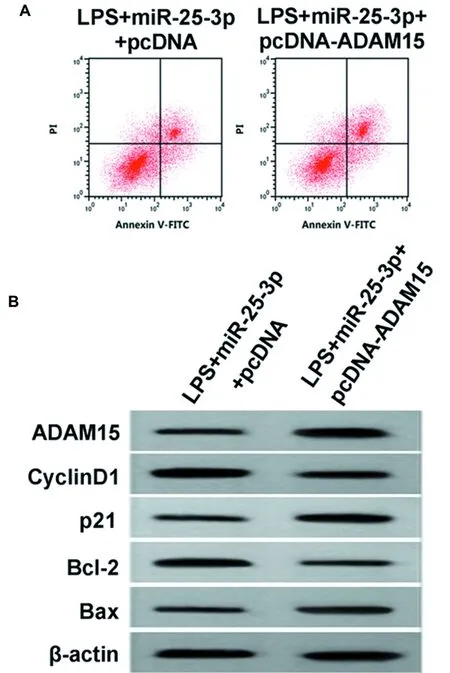
图6 过表达ADAM15逆转了miR-25-3p对LPS处理的HUVEC增殖凋亡的影响;A 细胞凋亡流式图;B 凋亡、增殖相关蛋白表达

表8 过表达ADAM15逆转了miR-25-3p对LPS处理的HUVEC细胞增殖凋亡的影响

表9 过表达ADAM15逆转了miR-25-3p对LPS处理的HUVEC中MDA、SOD、LDH、GSH-Px的影响
3 讨论
脓毒症是严重感染、创伤、外科手术等的常见并发症,如不及时治疗常引起全身炎性反应、循环障碍以及全身器官衰竭甚至死亡。血管内皮细胞是血管壁的天然屏障,细菌内毒素的暴露和内皮细胞激活将促进脓毒症进展。本研究通过体外细胞实验旨在证实miR-25-3p靶向ADAM15对LPS诱导的HUVEC损伤的保护作用。
研究显示脓毒症患者血清中miR-25-3p表达异常,是脓毒症潜在的诊断标记物[8]。脓毒症大鼠血清、LPS诱导的心肌细胞中miR-25-3p表达亦降低,miR-25-3p的过表达提高了大鼠存活率,抑制LPS诱导的心肌细胞凋亡,并降低炎性因子的分泌量[9]。本研究中LPS干预后HUVEC中miR-25-3p表达量显著降低,提示miR-25-3p表达异常可能与LPS诱导的HUVEC损伤有关。转染miR-25-3p mimics恢复miR-25-3p表达进行功能验证发现,miR-25-3p过表达显著提高LPS诱导下HUVEC活力,减轻LPS诱导的细胞凋亡。miR-25-3p的促增殖和抗凋亡作用在其他类型细胞中也被报道。研究表明miR-25-3p通过靶向BTG2促进乳腺癌细胞的体外增殖,而抑制miR-25-3p表达可诱导细胞凋亡[10]。在胶质瘤miR-25-3p对细胞增殖具有促进作用[11]。本研究中miR-25-3p过表达还导致LPS诱导的HUVEC中促凋亡因子Bax表达下调、抗凋亡因子Bcl-2表达上调。因此,miR-25-3p的抗凋亡作用是通过调控线粒体凋亡途径实现的。miR-25-3p还导致LPS诱导的HUVEC中CyclinD1表达增加,p21表达降低,这提示miR-25-3p的促增殖作用可能与调控细胞周期有关。此外,本研究发现miR-25-3p过表达可以降低MDA含量以及LDH释放量,升高SOD和GSH-Px抗氧化酶的活性,从而保护HUVEC免受LPS诱导的损伤。这些研究证实miR-25-3p可以保护HUVEC免受LPS诱导的损伤和细胞凋亡。
miRNA主要通过结合靶mRNA的3’非翻译区(UTR)进而参与靶基因的转录后调控[12]。本研究使用荧光素酶报告基因检测法确认ADAM15是miR-25-3p的潜在靶标,并证实在HUVEC中ADAM15表达受到miR-25-3p的负向调控。ADAM15是一种多功能跨膜糖蛋白,通常情况下ADAM15能够裂解细胞表面蛋白外结构域,并通过受体脱落参与信号传递,其异常表达与慢性炎症、免疫紊乱以及癌症转移有关[13,14]。在LPS诱导的急性肺损伤小鼠模型中,ADAM15表达增加促进了肺水肿和中性粒细胞浸润,破坏内皮屏障完整性[15]。内皮祖细胞抑制通过下调ADAM15表达对LPS诱导的肺微血管内皮细胞发挥保护作用[16]。本研究中LPS处理的HUVEC中ADAM15在mRNA和蛋白表达水平显著上调,表明ADAM15可能参与LPS诱导的HUVEC损伤。功能实验发现,沉默ADAM15通过上调CyclinD1、Bcl-2表达,下调p21和Bax表达来调控HUVEC细胞增殖和凋亡,并通过提高SOD和GSH-Px活性、降低MDA含量、抑制LDH释放来减轻LPS诱导的细胞损伤。此外,恢复试验证实过表达ADAM15显著减弱miR-25-3p过表达对LPS诱导的HUVEC损伤的影响。
综上所述,miR-25-3p通过调控ADAM15的表达可保护HUVEC免受LPS诱导的凋亡和损伤,有助于更好了解内皮细胞损伤分子机制,为临床脓毒症治疗提供潜在有效策略。
