新疆药桑葚酵素发酵动力学模型及其发酵比速率的研究
2022-03-17吕明珊袁艺洋邢军王亮茹先古丽买买提依明艾合买提江艾海提
吕明珊,袁艺洋,邢军,王亮,茹先古丽·买买提依明,艾合买提江·艾海提*
(1.新疆大学 生命科学与技术学院,乌鲁木齐 830046;2.华南农业大学 食品学院,广州 510642)
新疆药桑,属桑科(Moraceac)、桑属(MorusL.)、黑桑种(MorusnigraL.),是新疆特有生长环境下的原始桑种资源[1]。药桑葚是其成熟果实,性寒、无毒,有消炎、补血、镇静等功效,对治疗耳眼不灵、内热消渴、精神状态不佳、便秘、风湿导致的关节疼痛均有疗效[2]。桑葚是一种营养丰富的浆果果实,其富含多酚类化合物[3-4],有研究表明新疆药桑葚的营养成分如多糖、黄酮[5]含量都高于其他桑葚。现今,由果蔬汁经乳酸菌发酵得到的酵素产品逐渐受到众人的关注。果浆在经过发酵后富含各种有机酸[6]、多酚类化合物、超氧化物歧化酶等。且果蔬汁经过发酵后较好地丰富了其原本的口感,发酵时产生的发酵产物还能起到调节肠道菌群、促进消化、抗炎、抗氧化[7]等作用。
目前,以药桑葚为原料的产品有药桑罐头、药桑果汁、果酒、果醋和果酱等,但药桑葚酵素这种生物发酵制品却极为罕见,与之相关的文献也寥寥可数,并且对于药桑葚酵素发酵动力学的研究也未见报道。药桑葚果味浓厚、香气浓郁,含糖量及总酸含量均高于其他桑葚,但是药桑葚果实属于季节性收获的,结构脆弱且极易受到挤压和易腐烂[8],不过这些看似不利的条件使药桑葚有着非常杰出的发酵基础。利用药桑葚制成酵素不但能满足人们对于营养和保健的需求,还能解决药桑葚货架期短、不易运输等问题[9]。本实验通过对药桑葚酵素发酵动力学的研究,对探索和优化药桑葚酵素混菌发酵的优良酿造工艺、混菌发酵酵素的扩大化生产和质量把控及市场开发有着积极的意义。
在食品发酵领域,研究者们采用数学模型来描述和预测发酵过程中的菌密度、生成物浓度和底物浓度等主要代谢指标的变化规律,例如,Logistic 模型[10]、SGompertz[11]模型和Boltzmann模型[12],从而为发酵液的发酵过程工艺优化、实验室转工业生产实现数据的放大提供了理论基础。本研究以乳酸菌为发酵菌株,将药桑葚果浆酶解后进行乳酸菌无氧发酵并测定发酵过程中乳酸菌生长变化、还原糖和总酸含量变化,采用Logistic模型、Boltzmann模型、SGompertz模型和DoseResp模型对药桑葚酵素发酵过程中菌体生长、总酸生成、还原糖消耗情况进行拟合,并依据相关系数判断其可靠性,为进一步扩大化生产提供了理论依据。
1 材料与方法
1.1 材料与试剂
药桑葚:新疆阿克苏地区库车市生产;鼠李糖乳杆菌(Lactobacillusrhamnosus)bio-52962、副干酪乳杆菌(Lactobacillusparacasei)bio-114001:中国微生物菌种保藏中心;MRS肉汤培养基:北京奥博星生物技术有限公司;果胶酶、纤维素酶、半纤维素酶:诺维信有限公司。
1.2 仪器与设备
KX-101恒温干燥箱、RH-QG全温振荡器(摇床) 江苏科析仪器有限公司;DHP-9052恒温培养箱 上海齐欣科学仪器有限公司;1004分析天平 上海越平科学仪器有限公司;LS-150LD立式压力蒸汽灭菌器 江阴滨江医疗设备有限公司;SW-CJ-2G超净工作台 上海沪净医疗器械有限公司;UV752紫外可见分光光度计 上海佑科仪器仪表有限公司。
1.3 实验方法
1.3.1 药桑葚酵素工艺流程
新鲜的药桑葚→预处理→破碎机打浆→酶解→85 ℃灭酶30 min→冷却至37 ℃→菌种经活化扩大培养后接种→37 ℃恒温摇床内发酵→终止发酵(110 ℃灭菌20 min)→室温下冷却→生产线罐装→4 ℃冰箱内储藏。
1.3.1.1 菌种活化及培养
乳酸菌:MRS液体培养基,于37 ℃恒温培养箱培养乳酸菌24 h,将乳酸菌继续传代2次,备用。
1.3.1.2 药桑葚发酵液的发酵过程
选取紫色成熟的药桑葚,剔除病害部分。使用破壁机打浆,将果汁放入1000 mL三角瓶中,酶添加量0.4 °Brix(果胶酶∶纤维素酶∶半纤维素酶为2∶1∶1),然后放置在55 ℃恒温水浴锅内酶解3.5 h,85 ℃灭酶30 min,冷却至37 ℃接种,在1 L补料瓶内接种,接种量为药桑葚发酵液内菌密度6×106CFU/mL。密封隔绝空气进行厌氧发酵定时于无菌室超净间内取样检测。
1.3.2 乳酸菌计数
在无菌操作台内将发酵液取出0.5 mL用无菌水稀释10倍,用无菌移液枪移取稀释发酵液滴于血球计数板上,在光学显微镜下计数。
1.3.3 总酸含量测定
参照GB 12456-2021《食品安全国家标准 食品中总酸的测定》测定总酸含量[13]。
1.3.4 还原糖含量的测定
采用3,5-二硝基水杨酸比色法测定还原糖的质量浓度[14]。葡萄糖标准曲线回归方程:y=5511x-0.0126,相关系数R2=0.9993。
1.4 数据处理与分析
1.4.1 数据处理
每组实验重复3个平行,结果取其平均值,采用 Origin 9.0 对数据进行统计和作图分析,选取合适的动力学模型对乳酸菌体生长、还原糖基质消耗和总酸产量生成情况进行非线性拟合,并利用每个模型的拟合系数R2作为可靠性评价标准来筛选出拟合度高的动力学模型进行定量描述。
1.4.2 发酵动力学模型
乳酸菌菌体生长动力学模型拟合:乳酸菌菌体的生长呈S形曲线,故采用Logistic、SGompertz和 DoseResp模型进行非线性拟合,选取拟合系数R2最大的模型用于描述乳酸菌体生长规律。
总酸产量生成动力学模型拟合:有机酸是乳酸菌转化糖类代谢而生成的产物。有机酸生成速率与乳酸菌生长速率的相关性属于生长偶联型,其增长曲线呈现出与乳酸菌菌体生长相似的S形曲线,故选用Logistic、SGompertz和DoseResp模型对其进行非线性拟合,选用拟合系数最大的模型描述总酸产量生成。
还原糖含量消耗动力学模型拟合:乳酸菌发酵药桑葚酵素过程中,还原糖在乳酸菌发酵过程中主要被转化成乳酸等有机酸,因此选用模型中的Logistic、Boltzmann和DoseResp模型进行非线性拟合,选用拟合系数R2最大的模型描述还原糖消耗情况。
2 结果与分析
2.1 药桑葚酵素发酵过程中乳酸菌密度、还原糖含量和总酸含量变化趋势
乳酸菌混菌发酵药桑葚果浆过程中,乳酸菌数、还原糖含量和总酸含量变化见图 1。

图1 药桑葚酵素发酵过程中乳酸菌生长、还原糖基质含量和发酵液内总酸含量变化趋势Fig.1 The change trend of lactic acid bacteria growth, reducing sugar substrate content and total acid content of fermentation liquid during the fermentation process of Morus nigra L. enzyme
由图1可知,发酵初期6 h前,乳酸菌产酸速度缓慢,发酵4~6 h,还原糖消耗2.43 g/L,总酸增长0.21 g/L,这可能是因为乳酸菌进入新的生长环境需要适应与培养基不同的pH和单糖浓度[15]。酵素发酵6 h后,乳酸菌生长进入指数期,还原糖迅速在2 h内消耗11.07 g/L,总酸含量在2 h内迅速增加了0.44 g/L。经历指数生长期后,发酵时间16 h末时生物量从初始值5×106CFU/mL增加到最高值8.47×108CFU/mL。发酵液中的还原糖含量从初始值123.33 g/L降至90.12 g/L,从而使有机酸产生,总酸从初始值26.17 g/L增加至27.79 g/L。16 h后由于还原糖含量下降,总酸含量过高,pH值过低,抑制菌群生长,乳酸菌比生长速率下降,乳酸菌于18 h后进入稳定期,乳酸菌数量最高达8.66×108CFU/mL。
2.2 药桑葚酵素发酵动力学模型的建立
2.2.1 乳酸菌菌体生长动力学模型
乳酸菌数在不同模型下的拟合方程及拟合系数见表1。Logistic 模型、SGompertz 模型和DoseResp 3种模型对乳酸菌菌体生长情况的非线性拟合结果见图2。

表1 乳酸菌生长拟合方程及相关系数
由表1可知,拟合模型的相关系数R2值均接近1,其中Logistic模型的相关系数R2=0.99975,SGompertz 模型的相关系数R2=0.99945,DoseResp模型的相关系数R2=0.99925。最接近1的Logistic模型能更好地预测药桑葚酵素中乳酸菌的生长状况,其拟合曲线见图2中a。

a.Logistic模型拟合曲线
2.2.2 还原糖基质消耗动力学模型
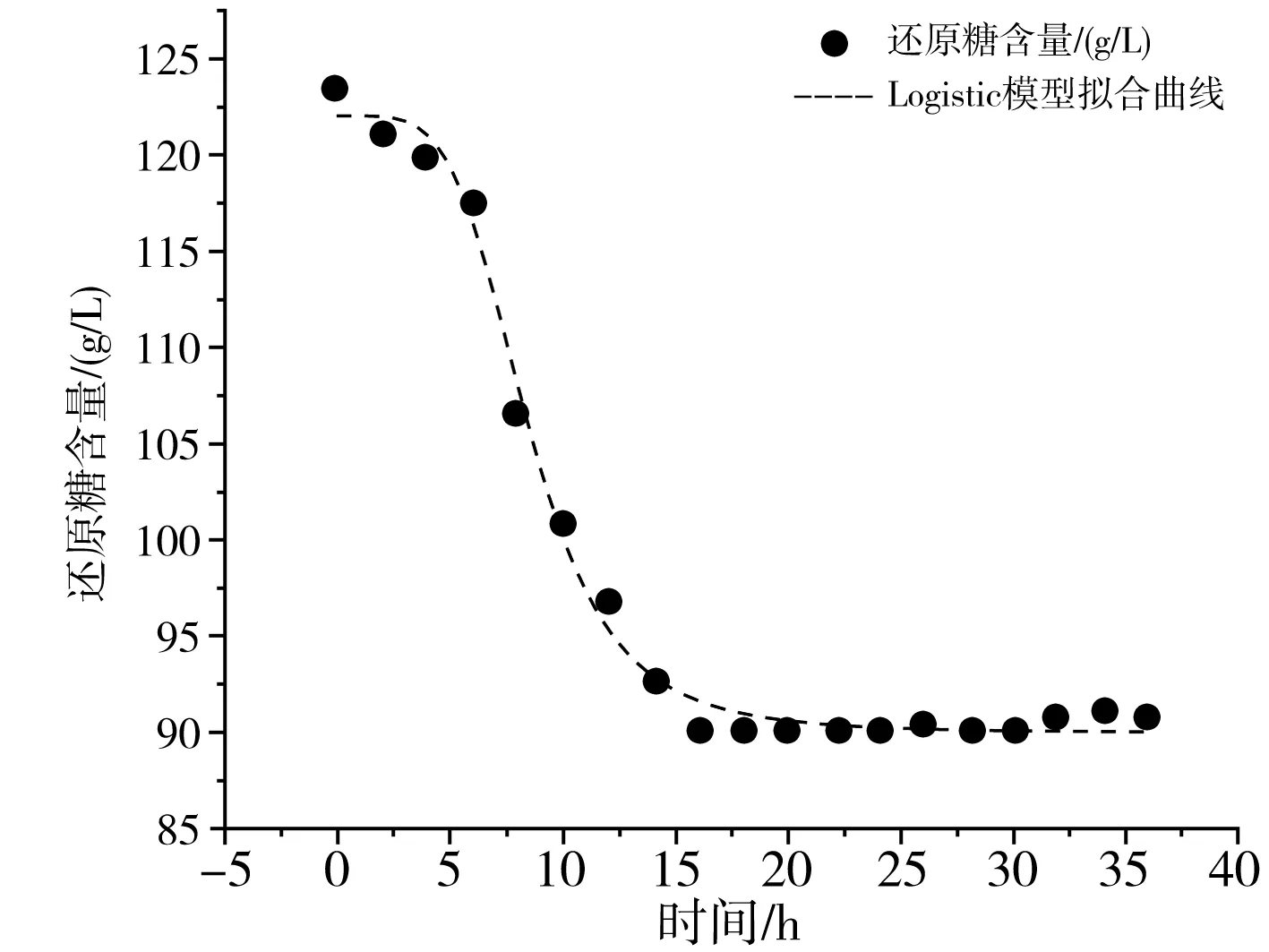
采用Logistic模型、DoseResp模型和 Boltzmann 模型对药桑葚酵素发酵过程中还原糖基质消耗情况进行拟合,拟合曲线见表2和图3。

表2 还原糖消耗拟合方程及拟合系数Table 2 Reducing sugar consumption fitting equation and fitting coefficient
a.Logistic模型拟合曲线
由图3可知,3种模型拟合下的还原糖消耗曲线趋势基本一致,其中DoseResp模型和Boltzmann模型验证所得参数相同,且其相关系数R2=0.99512相较于Logistic模型的R2=0.9948更接近于1,故DoseResp模型和 Boltzmann 模型均可用于定量描述和预测药桑葚酵素发酵过程中还原糖基质消耗情况,拟合曲线见图3中b和c。
2.2.3 总酸含量动力学模型
采用Logistic模型、DoseResp模型和SGompertz 模型对药桑葚酵素发酵过程中总酸含量的变化情况进行拟合,由表3可知,Logistic模型和DoseResp模型拟合曲线趋势相似且R2都在0.997以上,SGompertz模型拟合曲线相较前两种模型拟合效果欠佳,故选用R2最接近1的Logistic模型对药桑葚酵素发酵过程中总酸生成情况进行定量描述,拟合曲线见图4中a。

表3 总酸生成拟合方程及拟合系数
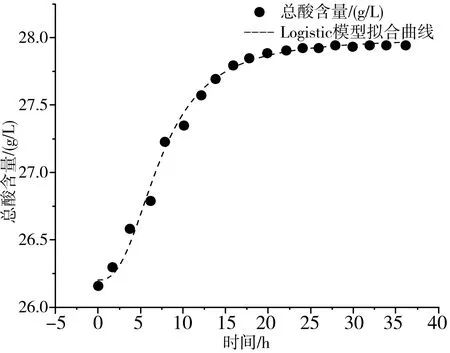
a.Logistic模型拟合曲线
2.3 药桑葚酵素发酵过程中比生长速率、比消耗速率和比增长速率的研究
由图5可知,在限制性条件下发酵的乳酸菌菌体生长的初期受发酵液pH和底物浓度影响使其菌体生长速度缓慢,适应期结束后菌体生长速度变快,随后乳酸菌生长的比生长速率达到最大,接着比生长速率逐渐降低甚至菌体停止生长,乳酸菌比生长速率呈钟形曲线。乳酸菌比生长速率表示每小时单位质量的菌体所增加的菌体量[16]。由图5可知,酵素内总酸含量的生成与菌体生长显现出强相关性系,为生长偶联型关系[17]。由图1可知,乳酸菌在0~16为快速生长期,随后进入稳定期,乳酸菌数量随着发酵时间继续增加无明显变化,此时发酵结束。结合图5还原糖比消耗速率曲线可知,乳酸菌在生长稳定期,其葡萄糖的比消耗速率随发酵时间的增加而变化,其比消耗速率与乳酸菌比生长速率呈现负相关性。

图5 药桑葚酵素发酵过程中比生长速率、还原糖消耗速率和总酸生成速率随时间的变化曲线Fig.5 The specific growth rate, reducing sugar consumption rate and total acid production rate during the fermentation process of mulberry enzymes with time
3 结论
目前发酵动力学模型在发酵实验转小罐生产方面的应用愈发广泛,但对于药桑葚酵素相关产品的研究较少,利用多种乳酸菌混菌发酵制备药桑葚酵素的发酵动力学研究还未见文献报道,本实验以新疆药桑葚为原料,打浆酶解后放入多种乳酸菌进行发酵,发酵液色泽呈紫红色,果香浓厚,酸甜可口。在药桑葚酵素发酵过程中对菌生长量、总酸含量和还原糖含量进行测定,在整个酵素发酵过程中菌生长量、总酸含量和还原糖含量互相关联,发酵进行到6 h后菌生长量迅速增长,总酸含量也随之增加,而还原糖含量在同一时期下降。发酵结束后(18 h)酵素中还原糖含量降至90.12 g/L,发酵液内总酸含量增加至27.79 g/L。利用Logistic 模型、SGompertz 模型、DoseResp模型和Boltzmann 模型对菌生长量、总酸含量和还原糖含量进行非线性拟合,发现Logistic 模型、DoseResp模型和Boltzmann 模型能够较好地对乳酸菌生长、总酸生成和还原糖基质消耗进行非线性拟合,并采用相关系数R2对拟合模型进行可靠性评价,所选模型能够较好地描述药桑葚酵素的发酵动力学特征。通过对比生长速率、总酸比合成速率与还原糖基质比消耗速率研究,研究三者在整个发酵过程中随时间的变化情况,可知总酸的生成与菌体生长是生长偶联型的。研究药桑葚酵素既解决了药桑葚不易运输、难储存的弊端,又满足了人们对营养保健方面的需求,研究药桑葚发酵动力学能了解发酵过程中生理生化及动力学特征,也能反映出酵素发酵过程中底物和产物之间的关系,为药桑葚酵素工业化生产提供了理论指导,为扩大化生产提供了可能性。
