黑果枸杞 LrPIP1基因的克隆鉴定及外施水杨酸对其在干旱胁迫下表达的影响
2022-03-17马永慧
马永慧,李 进,可 静
(1.新疆特殊环境物种保护与调控生物学实验室,干旱区植物逆境生物学实验室,新疆师范大学 生命科学学院,乌鲁木齐 830054;2.乌鲁木齐市十三中学,乌鲁木齐 830000)
水通道蛋白(Aquaporins,简称AQPs)即水孔蛋白,是主要内在蛋白(membrane intrinsic proteins, MIPs)超家族的成员之一[1],正调控水分和其他小分子物质如甘油、CO2、NH3、尿素、硼和H2O2等的跨膜运输[2-3]。目前在烟草(NicotianatabacumL.)、白沙嵩(ArtemisiasphaerocephalaKrasch.)、水稻(OryzasativaL.)、拟南芥(ArabidopsisthalianaL.)、番茄(SolanumlycopersicumMill.)等植物中均证实了水通道蛋白的存在[4-6]。植物体内水分的长距离运输、细胞渗透平衡的调控和气孔运动等过程都有水通道蛋白的参与[7]。AQPs诱导气孔闭合推测是通过改变植物叶细胞的内外渗透势,如烟草NtAQP1基因在质膜以及叶绿体内膜上表达,对CO2电导率有一定影响[8];向日葵(HelianthusannuusL.)保卫细胞中SunTIP7基因的表达量随着气孔关闭而增多[9]。在植物生命进程中,水通道蛋白有其独特的表达模式响应非生物胁迫,如通过过量表达AQPs基因提高植物的抗旱耐盐性[10-11]。
黑果枸杞为茄科枸杞属落叶小灌木,是优秀的经济树种,可作为水土保持植物广泛种植,其果实富含花色苷、总黄酮、多糖等物质,具有降血脂、抗氧化等作用,并已有相关提取工艺报道[12]。黑果枸杞浆果资源已具有出一定的市场潜力,但黑果枸杞生长环境严苛,对其生态保护较少,加之人们过度开采等严重限制了黑果枸杞的生长、结实,人工种植也同样面临环境以及技术方面相关 问题。
前期研究显示干旱胁迫会破坏黑果枸杞叶细胞中叶绿体和线粒体内膜致使气孔关闭[13],外源SA可缓解干旱胁迫造成的生理伤害,这些宏观指标的变化是否与其中PIP1基因表达量的变化有关?基于该问题,本研究从黑果枸杞叶片中克隆PIP1基因,并对其序列进行生物信息学分析,通过RT-PCR技术分析PIP1基因在干旱胁迫以及施加外源水杨酸下的表达情况,以期为探索黑果枸杞耐旱分子机理及耐旱性改良等提供理论 依据。
1 材料与方法
1.1 试验材料及处理
黑果枸杞(LyciumruthenicumMurr.)种子采自新疆博湖县,试验材料于新疆特殊环境物种保护与调控生物学实验室中培养。
选用饱满成熟种子置于40 ℃水浴锅内预种,进行48 h的打破种子休眠处理,消毒后的种子放置适宜环境(12 h光照/12 h黑暗,25 ℃昼温/ 15 ℃夜温)培育成幼苗,每盆5株进行盆栽试验。黑果枸杞幼苗长至15 cm左右,分别对其进行干旱胁迫与外施水杨酸诱导处理。
干旱胁迫处理:每个处理花盆内均有烘干土壤1 kg,土壤体积质量1.23 g·cm-3,田间持水量为20.16%。根据水分梯度设计4个水平,分别是正常对照CK(85%~90%)、轻度干旱胁迫D1(RWC 60%~65%)、中度干旱胁迫D2(RWC 40%~45%)、重度干旱胁迫D3(RWC 20%~25%),干旱胁迫处理持续28 d,每个水平均设定3次重复。黑果枸杞幼苗均在同一环境下,维持正常的光照以及空气流通。干旱胁迫采取不浇水自然消耗法,达到设定标准后,干旱胁迫处理开始。于每天的20:00称量,待土壤持水量达到试验设定标准时,摘取黑果枸杞叶片迅速进行液氮速冻处理,-80 ℃保存,备用。水杨酸处理:水杨酸(salicylic acid, SA)为分析纯,处理浓度为 0.1、0.5 mmol·L-1。试验第1、3、5天的 20:00,处理组分别喷施20 mL的0、0.1、0.5 mmol·L-1SA药液[13],每个处理3次重复,共36个处理。
1.2 方 法
1.2.1PIP1基因的克隆 根据文献获知的PIP1基因序列,将其保守域在NCBI数据库中进行Blast比对,获得一个与植物中PIP1基因序列同源性较高但功能未知的mRNA序列。使用软件Primer premier 5设计引物,(5′-F:CGCTCTGTTTCTTTCACTGCC-3′; R:5′-GGGGTGGTTGATAACACTTGCT-3′);使用OMEGA公司的Plant RNA Kit试剂盒提取黑果枸杞叶片总RNA;使用OMEGA公司的Gel Extraction Kit试剂盒反转录合成cDNA;PCR扩增以黑果枸杞叶片cDNA为模板进行,退火温度设定为 55 ℃。产物经回收后连接至pMD-18T载体(TaKaRa),送华大基因科技股份有限公司进行测序。
1.2.2LrPIP1生物信息学分析 使用NCBI网站提供的在线分析工具ORF Finder(http:// ncbi.nlm.nih.gov/gorf/gorf.html)对 LrPIP1蛋白进行测序结果分析,确定序列的起始密码子、终止密码子和开放阅读框长度,确保是完整的LrPIP1基因;使用BLAST功能对黑果枸杞LrPIP1基因翻译出的氨基酸序列进行分析,使用ProtParam(http://web.expasy.org/protparam/)对 LrPIP1蛋白进行特性预测分析;使用ProtScale(http://web.xpasy.rg/protscale/)对其亲疏水性序列谱进行绘制,图像可直观地反映出水环境下 LrPIP1蛋白质的折叠情况;使用软件KinasePhos对其磷酸化位点进行预测分析;使用NetNES分析信号肽位点;使用NPSA在线分析工具(http://npsa-prabi.ibcp.fr/)中MRLC方法对其二级结构进行预测分析;使用SWISS-MODEL(http://swissmodel.expasy.org/)对其三级结构进行预测分析及同源建模,使用MEGA 7.0软件构建系统进化树。
1.2.3 表达模式分析 根据黑果枸杞PIP1基因序列设计引物,F:5′-GCATTTCTGGCGGTCACA-3′; R:5′-TGTAACCA GGTGCCACAAAGT-3′。以18sRNA作为内参(F:5′-GCGAAATGCGATAA GTAGTGTG-3′; R:5′-GCAA TGTGCGTTCAAAGATTC-3′)[14]。不同处理下的黑果枸杞叶片cDNA为模板,反应体系为2 × Master Mix 10 μL,10 μmol·L-1的PCR特异引物F 0.5 μL,10 μmol·L-1的PCR特异引物R 0.5 μL,加水至总体积为18 μL。反应程序为95 ℃ 30 s;40个循环:95 ℃ 5 s,60 ℃ 40 s(收集荧光)。为建立PCR产物的熔解曲线,待扩增反应结束后,按95 ℃ 10 s;60 ℃ 60 s; 95 ℃ 15 s;并从60 ℃缓慢升温到99 ℃(仪器自动进行-Ramp Rate为0.05 ℃·s-1)。每个反应3次生物学重复,3次技术重复,并计算PIP1基因的相对表达量。
1.2.4 数据分析及图表处理 使用Microsoft Office Excel 2010进行试验数据计算整理以及图表制作,采用SPSS 22.0进行统计分析,不同胁迫间进行One Way ANOVA和Duncan’s多重比较 (P<0.05)以及相关性分析。
2 结果与分析
2.1 黑果枸杞 LrPIP1基因的克隆与序列分析
使用同源克隆的方法,运用RT-PCR技术,从黑果枸杞叶片中获得一个功能未知的PIP1基因,命名为LrPIP1(GenBank登录号为KY230166),该基因完整的开放阅读框长度为852 bp。使用Prot-Param软件对 LrPIP1蛋白保守区进行预测分析,结果表明在101~109氨基酸处含有1个与MIPs蛋白家族保守信号序列HINPAVTFG相匹配的序列及植物质膜水通道蛋白的特征序列GGGANFVQPG和TGI,研究发现 LrPIP1蛋白有6个跨膜域,是典型的水通道蛋白跨膜结构,证明 LrPIP1蛋白为跨膜蛋白且具有典型的水通道蛋白跨膜结构。
2.2 黑果枸杞 LrPIP1基因保守域分析
使用CDD软件分析黑果枸杞LrPIP1基因序列的保守域[15],结果如图1所示,黑果枸杞LrPIP1基因具有水通道蛋白结构域,其中核酸结合区域较为保守,是水通道蛋白,属于MIPs大家族。
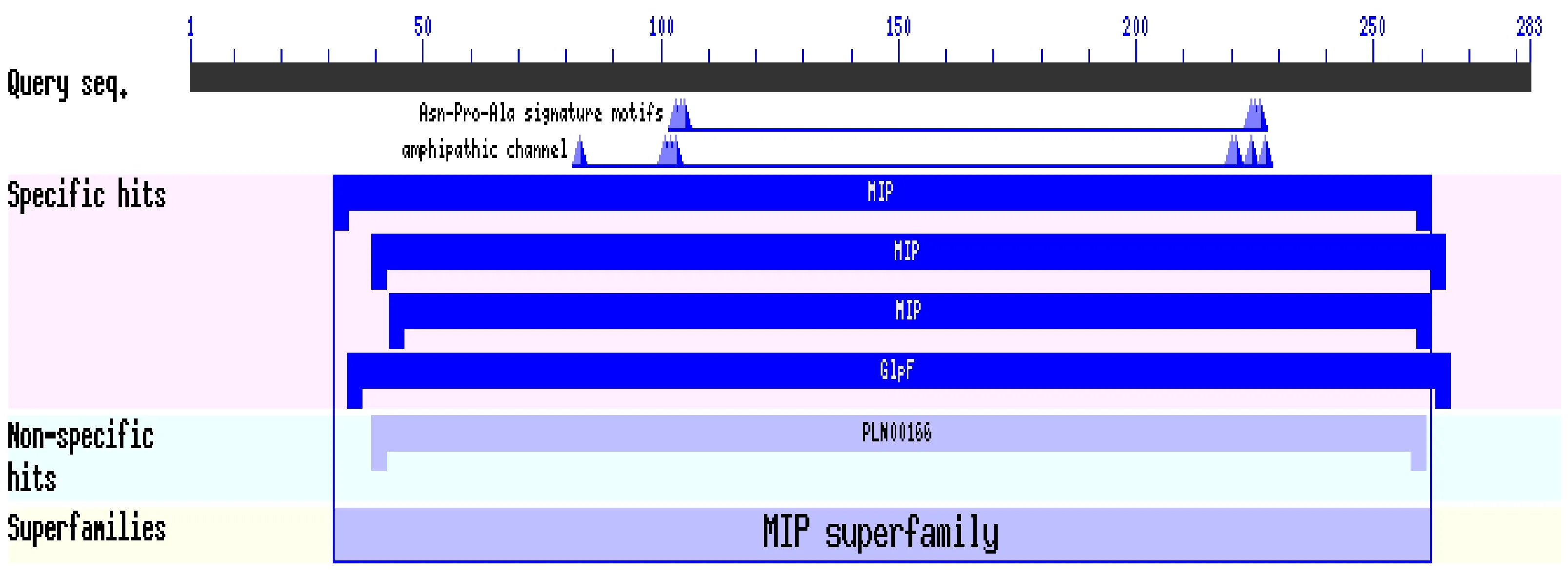
图1 LrPIP1基因保守结构域分析Fig.1 Analysis of conserved domain prediction of L. ruthenicum LrPIP1
2.3 黑果枸杞 LrPIP1蛋白质理化性质和亲疏水性分析
使用ProtParam软件分析发现,黑果枸杞LrPIP1基因编码的蛋白质分子式为C1401H2163O364S11,分子质量为30 268.46 u,理论等电点pI为9.36,LrPIP蛋白含有15个带负电荷的氨基酸残基(Asp + Glu)和22个带正电荷的氨基酸残基(Arg + Lys),消光系数为41 035。脂肪指数为102.72。总平均亲水性为0.506,证明 LrPIP1蛋白是疏水性蛋白。不稳定指数为31.87,证明 LrPIP1蛋白稳定性较好。使用ProScale工具预测 LrPIP1蛋白的亲水性和疏水性,其他设置采用默认,选信号最显著的Kyte & Doolittle氨基酸标度值,表明LrPIP1有9个低分值峰,是疏水蛋白。

图2 黑果枸杞 LrPIP1蛋白亲水性和疏水性预测Fig.2 Prediction of hydrophobicity and hydrophily of L. ruthenicum LrPIP1
2.4 黑果枸杞 LrPIP1蛋白磷酸化位点分析
应用KinasePhos对黑果枸杞 LrPIP1蛋白进行磷酸化分析,结果如图3,表明黑果枸杞 LrPIP1蛋白在第18位含有一个酪氨酸,丝氨酸位于第98、117、194、278位,推测其可能是LrPIP1的潜在磷酸化位点。

图3 黑果枸杞 LrPIP1蛋白磷酸化位点分析Fig.3 Putative phosphorylation sites of L. ruthenicum LrPIP1 by KinasePhos prediction
2.5 黑果枸杞 LrPIP1蛋白信号肽预测和分析
使用基于神经网络模型(Neural Networks models)和隐马可夫模型(Hidden Markov Models)的NetNES1.1 server,对 LrPIP1蛋白中富含亮氨酸的核输出信号进行预测分析[16]。结果如图4所示, LrPIP1蛋白于序列第56位有富含亮氨酸的核输出信号。

图4 黑果枸杞 LrPIP1蛋白核输出信号预测Fig.4 Pediction of nuclear export signal of L. ruthenicum LrPIP1
2.6 黑果枸杞 LrPIP1蛋白二级结构分析
使用NPSA在线分析工具提供的MRLC方法对其二级结构进行预测分析。结果显示(图5),该蛋白由43.46%的 α 螺旋,14.13%的 β 折叠和42.40%的无规则卷曲3种形式构成。其N端主要由无规卷曲结构分布,C端主要由 α 螺旋分布。

图5 黑果枸杞LrPIP1二级结构预测Fig.5 Predicted secondary structure of L. ruthenicum LrPIP1
2.7 黑果枸杞LrPIP1三级结构模型分析
使用SWISS-MODEL对 LrPIP1蛋白质结构做同源建模[17],建模方式采用自动方式。首先将蛋白质序列进行Blast比对,结果显示LrPIP1与数据库中Spinach aquaporin SoPIP2;1的结构最相似(82.92%);其次对目标序列和模板序列结构进行比对,将完全一致的氨基酸序列区域建立一致的三级结构,并将其叠和;根据网络综合服务器算法构建蛋白质模型,先找出主链结构,再进行侧链建模,并通过能量计算优化结构,最后使用全局法中的QMEANscore4记分值估算该模型的建模质量。
构建的蛋白质三维结构如图6所示,可信度值较高为0.56,模板序列方法使用X-ray,分辨率为2.10 Å,比对的范围在第23~277个氨基酸,覆盖度达到99%。

图6 LrPIP1蛋白质的三维结构模型Fig.6 Three-dimensional structure model of LrPIP1
2.8 同源性分析和基因树构建
将 LrPIP1蛋白质序列与马铃薯(SolanumtuberosumL.)、烟草(NicotianatabacumL.)等茄科植物和拟南芥(ArabidopsisthalianaL.)、苹果(MalusdomesticaB.)、葡萄(VitisviniferaL.)等双子叶植物,以及水稻(OryzabrachyanthaL.)、小麦(TriticumaestivumL.)、玉米(ZeamaysL.)、甘蔗(SaccharumofficinarumL.)等单子叶植物的水通道蛋白PIPs进行多序列比对。BLAST同源性分析结果显示(图1),黑果枸杞LrPIP1基因编码氨基酸序列与多种植物相比均具有较高的同源性,其中与马铃薯的同源性高达99%;使用ClustalW软件进行多序列比对,选取比对结果中保守区段较为相近的22种蛋白质序列进行构建基因树的准备;使用MEGA 7.0软件采用邻接法(neighbor-joining, NJ)构建系统进化树;对于参数选项设置:为了确保基因树分枝的稳定,选择“Bootstrap method”的检验方法,其他设置采用默认,重复1 000次。如图7所示,这22种不同物种的水通道蛋白基因大致聚合为4大类群,其中黑果枸杞LrPIP1与同为枸杞属的马铃薯亲缘关系最近,聚为一类,与拟南芥、甘蔗的亲缘关系相对较远。

图7 不同植物PIPs蛋白质序列基因树Fig.7 Phylogentic tree constructed by PIPs protein sequence in plant
2.9 黑果枸杞 LrPIP1基因干旱胁迫和施加外源水杨酸响应的Real-time PCR分析
本试验探究黑果枸杞LrPIP1基因在干旱胁迫下的表达情况,检测LrPIP1基因在叶片中的相对表达量。以黑果枸杞叶片cDNA为模板进行RT-PCR反应,18S作为内参基因。结果如图8所示,干旱胁迫下黑果枸杞LrPIP1基因相对表达量在不同处理下具有明显差异。轻度干旱胁迫可诱导LrPIP1基因的相对表达量显著上调 (P<0.05),LrPIP1基因的快速上调,推测可能是黑果枸杞响应干旱胁迫从而大量表达 LrPIP1蛋白,以此摄入更多水分从而适应干旱,增强抗旱性;中度胁迫D2时,LrPIP1基因的相对表达量较CK有一定程度的上调,但相较于D1表现为显著下降(P<0.05);重度胁迫D3时,LrPIP1基因相对表达量较D2有显著性上升(P<0.05)。前有研究证明外源SA可促进细胞内H2O2积累,诱导PIP1在细胞内在化定位进行重定位,调节质膜渗透性从而应答环境胁迫[18]。本研究发现,外源0.1 mmol·L-1SA时,随着胁迫程度加深,LrPIP1基因相对表达量呈现线性递增且差异显著(P<0.05);外源喷施0.5 mmol·L-1SA时,LrPIP1基因相对表达量较CK显著增加 (P<0.05)。结果说明LrPIP1基因的相对表达受到外源SA的影响,推测外源SA可引起LrPIP1基因在细胞内的重定位,使其在重度胁迫下大量表达。综合表明,轻度胁迫下黑果枸杞具有一定的耐逆性,重度胁迫下外源SA可诱导LrPIP1基因大量表达,增强黑果枸杞的抗旱性。

不同小写字母表示不同处理间差异显著(P<0.05)
3 讨 论
干旱胁迫会严重影响黑果枸杞的生长、结实,从而对黑果枸杞的产量与品质有一定影响。因此,探究黑果枸杞抗逆基因,培育抗逆性良好的黑果枸杞品种至关重要。干旱胁迫影响黑果枸杞的生长发育的原因在于能够引起黑果枸杞细胞失水,水是植物生长发育过程中的重要因子,水通道蛋白特异的水分运输的通道,对于植物体内水分的长距离运输和细胞水分的跨膜运输具有一定促进作用,可调节植物体内和细胞间水分平衡。因此,研究PIP在黑果枸杞响应干旱胁迫方面具有重要意义。
该研究通过同源克隆的方法,从黑果枸杞叶中克隆获得黑果枸杞水通道蛋白基因LrPIP1(登录号:KY230166),预测其蛋白的保守域显示,LrPIP1基因有6个跨膜区,并且含有MIPs蛋白家族保守信号序列和质膜水通道蛋白的特征序列,这是MIPs大家族和质膜水通道蛋白的最基本特征。通过亚细胞定位预测,LrPIP1基因位于质膜上,推测可能是与细胞水分运输功能有关,使其更高效地进行细胞水分的调控。LrPIP1与其他植物PIPs蛋白质氨基酸序列同源性很高,证明 LrPIP1蛋白为质膜水通道蛋白。在LrPIP1的N端和C端都分布着高度保守的NPA序列,这种高度保守的结构是水通道蛋白家族的基序,是其功能密切相关的[19]。
LrPIP1蛋白二级结构预测结果显示,其是由α-螺旋、β-折叠和无规则卷曲3种结构元件构成。三维结构预测显示 LrPIP1蛋白以4个单体形成同源四聚体的形式存在,这种高度保守的结构对保持结构的稳定以及高效准确地行使功能具有重要生物学意义。蛋白质磷酸化是蛋白质翻译后重要的修饰方式,在调控蛋白质的活力与功能、细胞信号转导的过程中具有重要作用。Maurel等[20]、Van Wilder等[21]研究发现,磷酸化是生物体内AQPs调节活性的方式,植物体内的AQPs磷酸化主要发生在位于N端或C端的丝氨残基上。在本研究中, LrPIP1蛋白磷酸化位点结果分析显示其主要分布在丝氨酸上,有4个丝氨酸位点,推测其可能是蛋白质磷酸化的作用位点。
聚类分析结果表明,黑果枸杞LrPIP1基因与同科的马铃薯PIPs遗传距离最近,而与单子叶植物甘蔗、玉米等亲缘关系相对较远,此聚类结果符合遗传进化的关系,亲缘关系近的物种同源性较高,亲缘关系相对较远的物种同源性则较低。
前有研究证明水通道蛋白可调控植物水分运输,水分胁迫诱导PIPs的上调表达也可抑制表达[22]。Barrieu等[23]研究发现,在轻度干旱胁迫下,花椰菜(BrassicaoleraceaL. var.BotrytisL.)细胞中水通道蛋白BobTIP26-1基因在失水、复水中都具有调控作用;Mahdieh等[24]研究发现,烟草NtPIP1;1和NtPIP2;1基因的转录水平在干旱胁迫下明显下调,而NtAQP1基因的转录水平则有所上调;干旱胁迫下5种苹果矮化砧木的水通道蛋白基因PIPs(MpPIP1;1 、MpPIP2;1),既有上调表达,也有下调表达[25];干旱胁迫诱导黄瓜叶细胞中质膜水通道蛋白表达上调[26]。香蕉(MusaacuminataL.)叶和根中,MaPIP1;1基因相对表达量随着土壤含水量的减少呈递增的趋势,但在重度胁迫下表达量下降,低于轻、中度胁迫处理但高于对照[27],这与本试验中LrPIP1基因在干旱胁迫下相对表达量的变化情况相同。研究发现,黑果枸杞LrPIP1基因在轻度胁迫D1下显著上调表达,中度D2、重度胁迫D3下LrPIP1基因表达呈现下调趋势,但仍高于对照CK。
已有众多研究证明,植物激素(包括脱落酸、生长素、水杨酸和赤霉素)可以调控水通道蛋白的表达。例如:水稻OsPIP2;6基因表达受到GA、IAA、ABA的诱导[28],白桦幼树叶中FPS在MeJA和SA处理下表达上调[29]。已有研究表明,水杨酸可作为信号分子协助AM真菌促进水稻多胺代谢,提高水稻低温抗性[30];张静等[31]发现,外源SA处理下,水稻叶中OsAQP基因表达上调,相对表达量是正常对照CK的2.93倍。目前关于干旱胁迫下黑果枸杞PIPs基因相对表达量对外源水杨酸的响应相关研究较少,本研究发现外源SA处理可诱导LrPIP1基因的相对表达,在轻度胁迫下,外源喷施SA诱导LrPIP1基因表达下调,在中、重度胁迫下,SA可诱导LrPIP1基因表达量上调,且重度胁迫下上调最多;与无外源SA处理情况下干旱胁迫诱导LrPIP1基因表达量结果不同,推测可能是黑果枸杞可以抵御轻度的干旱胁迫,而外源SA诱导 LrPIP1蛋白的重定位导致结果不同,但其具体的调控机理还待进一步研究。
综上所述,轻度干旱胁迫下黑果枸杞具有一定的抗旱性,上调LrPIP1基因以适应逆境胁迫;但在中、重度胁迫下,黑果枸杞叶细胞中LrPIP1基因呈现下调趋势;外源SA处理可诱导黑果枸杞叶LrPIP1表达上调,水杨酸诱导H2O2积累导致细胞膜发生去极化导致细胞膜的透性改变,引起电导率升高、气孔关闭,然而PIPs有转运H2O2的能力,从而增强黑果枸杞的耐旱性。关于水通道蛋白调控机理,运动轨迹以及水杨酸对其表达量变化的直接作用机理等仍需进一步研究,以期为该基因在响应水分亏缺等非生物胁迫中的深层次机制提供重要的前期参考。
致谢:感谢新疆师范大学“十三五”校级重点学科生物学学科资助。该研究得到新疆师范大学沙漠藻研究院的大力支持和帮助,在此表示衷心的感谢。
