胶原酶化学溶解联合射频消融术治疗神经根型颈椎病的临床观察
2022-03-17谭利琴谭升星陈平吴春根
谭利琴,谭升星,陈平,吴春根*
(1.南昌大学第四附属医院,江西 南昌 330009;2.南昌大学第一附属医院,江西 南昌 330006)
神经根型颈椎病(cervical spondylotic radiculopathy,CSR)发生率占颈椎病的60%~70%,是因神经根遭受压迫、刺激所致,以上肢神经根性疼痛、颈部疼痛为主要表现,影响患者正常工作与生活[1-2]。胶原酶化学溶解术治疗椎间盘的有效术式,能降解Ⅱ型胶原,改善病情,但单一治疗时使用剂量较大,术后髓核溶解易出现高涨期,降低椎间盘高度,疗效欠佳[3]。射频消融术(radio frequency ablation,RFA)能灭活椎间盘内外靶点处的神经炎性因子活性,缓解患者疼痛,还能热凝退变椎间盘裂隙、炎性血管,修复椎间盘,逐渐被应用于CSR 治疗[4]。本研究旨在分析胶原酶化学溶解联合射频消融术治疗CSR 的效果,以指导临床制定合理手术方案,现报道如下。
1 资料与方法
1.1 临床资料 选取 2018 年 1 月至 2020 年 2 月本院收治的84例CSR患者,按照随机数字表法分为实验组与对照组,各42 例。实验组男26 例,女16 例;年龄28~71 岁,平均年龄(59.32±3.45)岁;病程1~12 个月,平均病程(6.45±1.62)个月。对照组男29例,女13例;年龄27~69岁,平均年龄(59.19±3.38)岁;病程2~11个月,平均病程(6.37±1.60)个月。两组患者临床资料比较差异无统计学意义,具有可比性。本研究经本院医学伦理委员会审核批准。
1.2 纳入及排除标准 纳入标准:经保守治疗3个月以上无效;符合《脊柱外科学》[5]中CSR 相关诊断标准,经MRI、X线检查确诊;签署知情同意书:ASA分级为Ⅰ~Ⅱ级。排除标准:合并严重肝肾等重要脏器功能不全;既往有颈椎内固定手术史;后纵韧带骨化;血液系统疾病。
1.3 方法 实验组行胶原酶化学溶解联合RFA 治疗:取仰卧位,薄枕垫于肩下垫,肩膀用约束带向下绑紧,下颈段充分显示。按照术前MRI、X线评定病变椎间盘,穿刺点取突出物对应椎间盘间隙对侧胸锁乳突肌、气管间。采用2 ml 1%利多卡因行局部浸润麻醉,X 线监测下使用型号适宜的射频穿刺针穿刺至椎体后缘近突出物、椎间盘中后1/3处,进针需避开周围迷走神经、甲状腺、食管等器官组织,角度一般与中轴矢状线成45°。注射约0.2 ml 碘海醇造影剂进行造影,按照术前影像治疗、突出物大小、术中显影情况等,DSA 监视下再次明确深度、穿刺部位,调整针芯,确保其辐射半径5 mm 范围为突出物组织,防止造成神经损伤。按照患者突出物大小、症状程度选择射频参数,置入射频电极,阻抗测定后,确保电极(400 Ω)位于髓核内,随后实施感觉(1 mA,100 HZ)和运动(3.0 mA,3 HZ)诱发检测,针对难以诱发出上肢肌肉收缩和疼痛,对穿刺射频症距离脊髓、神经距离进行估算。行运动、感觉刺激,未诱发出四肢肌肉、感觉运动异感,给予1 次×30 s 70℃,1次×30 s 80℃,1次×60 s 90℃,2次×90 s 95℃模拟连续射频。待射频温度降至约45℃时,拔出射频电极针芯。采用0.9%氯化钠溶液和注射用胶原酶(辽宁味邦生物制药有限公司,国药准字H10960177)配置成胶原酶药液600 U/1.2 ml,给予100 U/0.2 ml小剂量胶原酶,将穿刺针拔出,按压无出血后送回病房。对照组行单一胶原酶化学溶解术治疗,穿刺方式、同实验组,术中注射200 U/0.4 ml胶原酶。术后,两组患者颈旁固定沙袋,绝对卧床,常规使用抗生素预防感染,按照患者恢复情况逐渐行适应性锻炼、颈部活动等。
1.4 观察指标 比较两组术前、术后3个月疼痛程度、影像学参数(椎间盘高度、突出物面积)和颈部功能障碍程度。①疼痛程度采用视觉模拟评分法(VAS)评估,总分10分,分值越高表示患者疼痛程度越严重。②使用Somapho 1.5T超导磁共振机测量椎间盘高度、突出物面积。③使用颈椎功能障碍指数量表(NDI)评估两组患者颈部功能障碍程度,总分50分,包括集中注意力、疼痛程度、阅读、睡眠、自理等,分值越低表示患者颈部功能障碍程度越轻。
1.5 统计学方法 采用SPSS 21.0统计学软件进行数据分析,计量资料以“”表示,采用t检验,计数资料以[n(%)]表示,采用χ2检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 两组疼痛程度比较 术前,两组VAS评分差异无统计学意义;术后,实验组VAS 评分低于对照组(P<0.05),见表1。
表1 两组VAS评分比较(,分)
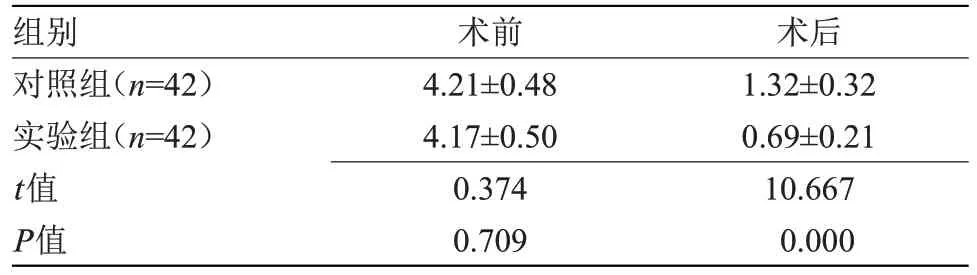
表1 两组VAS评分比较(,分)
术后1.32±0.32 0.69±0.21 10.667 0.000组别对照组(n=42)实验组(n=42)t值P值术前4.21±0.48 4.17±0.50 0.374 0.709
2.2 两组影像学指标比较 术前,两组术前椎间盘高度、突出物面积比较差异无统计学意义;术后,实验组椎间盘高度高于对照组,差异具有统计学意义(P<0.05),且突出物面积比较差异无统计学意义,见表2。
表2 两组影像学指标比较()
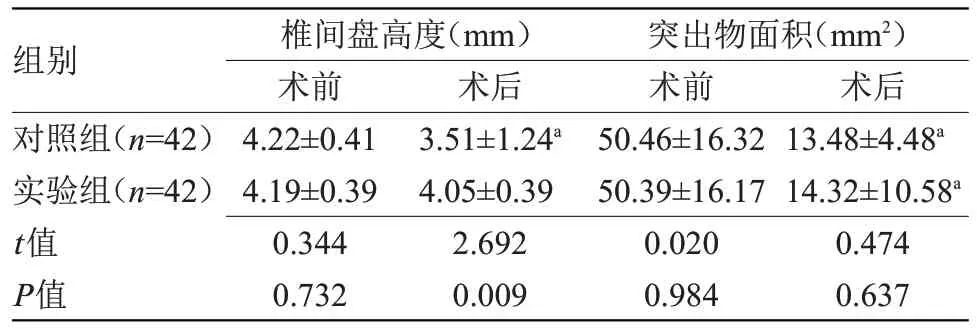
表2 两组影像学指标比较()
注:与本组术前比较,aP<0.05
组别对照组(n=42)实验组(n=42)t值P值术后13.48±4.48a 14.32±10.58a 0.474 0.637椎间盘高度(mm)术前4.22±0.41 4.19±0.39 0.344 0.732术后3.51±1.24a 4.05±0.39 2.692 0.009突出物面积(mm2)术前50.46±16.32 50.39±16.17 0.020 0.984
2.3 两组颈部功能障碍程度比较 术前,两组NDI评分比较差异无统计学意义;术后,实验组NDI 评分低于对照组,差异具有统计学意义(P<0.05),见表3。
表3 两组NDI评分比较(,分)
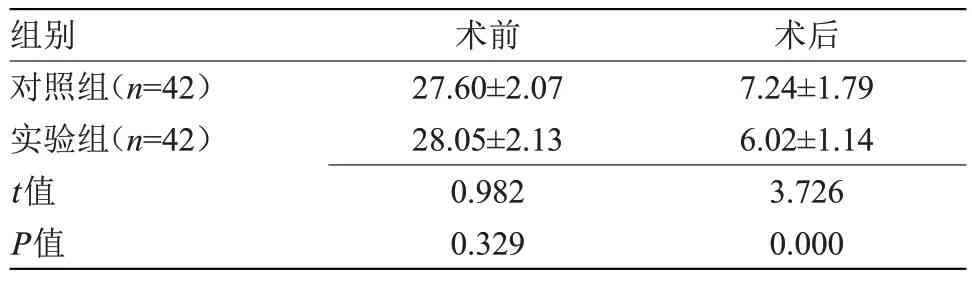
表3 两组NDI评分比较(,分)
组别对照组(n=42)实验组(n=42)t值P值术前27.60±2.07 28.05±2.13 0.982 0.329术后7.24±1.79 6.02±1.14 3.726 0.000
3 讨论
CSR 多伴有韧性钙化、颈椎间盘退化、骨质增生等,会刺激神经根,导致患者出现颈部疼痛、颈肩活动受限等,易反复发作,根治困难[6]。胶原酶是一种能作用于胶原螺旋区的酶,将其注射至病变椎间盘内,能特异性分解胶原蛋白,溶解突出的纤维环、髓核、炎症形成的粘连带;对蛋白多糖依附的胶原网状结构形成破坏,影响其亲水性,使其水分丢失等,发挥水解突出髓核、椎间盘内层纤维环,降低盘内压力,促使突出变形的椎间盘回缩,可减轻CSR病情[7-8]。但因盘外注射胶原酶、髓核组织与椎间盘纤维接触不够紧密,药物难以有效抵达突出物,多使用较大剂量胶原酶治疗,但会引起硬脊膜变薄,影响治疗效果。
本研究结果显示,实验组术后VAS、NDI评分低于对照组,术后椎间盘高度高于对照组(P<0.05),两组术后突出物面积比较无差异统计学意义,提示胶原酶化学溶解联合RFA 能有效减轻CSR 患者疼痛程度,保留责任椎间盘高度,减轻颈部功能障碍程度。RFA能通过电极直接应用于突出的椎间盘,迅速升高局部温度,消融突出的髓核组织,使其变性挛缩,减轻椎间盘内压力,消除或缓解神经压迫。局部温度升高能加速局部血液循环,改善供氧和营养,进一步加快局部产物代谢;毁损沿椎间盘裂隙新长入的不完整血管、窦椎神经,降解或破坏炎性致痛因子,减轻患者疼痛程度[9-10]。胶原酶化学溶解联合RFA 治疗,射频消融在髓核内开出槽道,胶原酶药液更易抵达突出物表面,增加接触面积和作用时间,最大程度避免其接触非突出物,同时胶原酶化学溶解、RFA 作用机制不同,联合治疗可起到优势互补作用,提高治疗效果。
综上所述,CSR 患者行胶原酶化学溶解联合RFA 治疗效果显著,能保留责任椎间盘高度,减轻患者疼痛程度、颈部功能障碍程度。
