谷子CHs家族全基因组鉴定及表达分析
2022-03-17孙卓楠付振鑫孙玉荣张宝俊
孙卓楠,付振鑫,孙玉荣,刘 旭,张宝俊
(山西农业大学 植物保护学院,山西 太谷 030801)
聚酮合成酶(Polyketide Synthase,PKS)可催化聚酮类化合物形成芪类、黄酮类化合物、抗生素及真菌毒素等多种物质,在防御UV、植物体营养生长及响应病原菌侵染等方面具有至关重要的作用[1-2]。根据蛋白结构可将PKS分为I、II和III型,其中III型PKS即查尔酮合酶(Chalcone synthase,CHs),包括Cys164、Phe215、His303和Asn336等4个保守残基,可催化生成一系列结构各异、具有不同生理活性、含CHs基本骨架的植物次生代谢产物[3]。CHs是植物类黄酮生物合成途径中的第1个关键酶,催化一分子香豆酰-CoA和三分子丙二酰-CoA生成四酮中间体,再进一步环化为查尔酮[4-5]。研究表明,CHs不仅催化类黄酮的合成而且在花青素合成、植物根瘤形成、抵抗生物胁迫和预防紫外线损伤中发挥重要作用[6-7]。
CHs基因是多基因家族,保守性较强,蛋白序列长度约400个氨基酸,在水稻、玉米、烟草及拟南芥等植物中已有研究[8]。典型的CHs家族成员参与花色素合成途径,还有部分成员与植物抗真菌病害有关[9],比如矮牵牛CHs突变体的花冠与花药颜色变浅且雄性不育,而这种表型可被CHs转基因互补[10];高粱接种炭疽菌(Colletotrichum sublineolum)后,CHs活性升高,花青素、芹菜素大量积累,从而使高粱对炭疽菌侵染的抗性提高[11];棉花受枯萎病菌(Fusarium oxysporumf.sp.Vasinfectum)侵染时,棉花CHs家族基因通过苯丙氨酸代谢途径合成大量类黄酮物质,防御病原菌侵染[12];黄瓜中CHs基因上调表达,黄酮类物质大量合成,诱导黄瓜产生抗性抵抗白粉病菌(Sphaerotheca fuliginea)的侵染[13];紫甘薯中编码CHs的基因发生突变后更容易被立枯丝核菌(Rhizoctonia solani)侵染,当转入CHs基因后紫甘薯合成大量类黄酮物质抵抗病原菌的侵染[14]。可见,CHs基因催化合成类黄酮等抗病类物质,调控水杨酸防御途径,在植物响应生物与非生物胁迫的过程中有着极其重要的作用。
谷子(Sitaria italica)是我国重要的粮食作物,具有基因组小、生命周期短、抗旱抗贫瘠等特点,是C4植物抗逆基因挖掘的模式植物[15]。近年来,谷子种植面积扩大,谷子白发病、谷子锈病及谷瘟病等病害加重,严重影响谷子的生长及品质[16]。
本研究通过对谷子CHs家族基因成员的鉴定及同源进化分析,结合其组织特异性表达分析以及在响应禾生指梗霉菌(Sclerospora graminicola)侵染的差异表达分析,以明确CHs家族基因在谷子生长发育及抗病其他代谢通路中的作用,为谷子抗病育种奠定基础。
1 材料和方法
1.1 SiCHs基因家族数据获取及鉴定
从Multi—omics Database for Setaria italica数据 库(http://foxtail—millet.biocloud.net/home)获取xiaomi全基因组数据,利用Pfam数据库(http://pfam.xfam.org/)构建的Chal_sti_synt_C(PF00195)和Chal_sti_synt_N(PF02797)结构域的HMM模型,在TBtools[17]中利用Simple HMM Search程序,在xiaomi全基因组蛋白序列中选取比对值E—value<0.01的同源序列。
1.2 SiCHs基因蛋白特性分析、亚细胞预测及基因定位
利 用ExPASy—ProtParam tool(https://web.expasy.org/protparam/)预测谷子CHs家族蛋白序列的氨基酸数目、分子量及等电点。通过在线网站(http://psort1.hgc.jp/form.html)进行亚细胞定位。通过谷子的基因组注释gff3文件,利用TBtools(http://dx.doi.org/10.1101/289660)对基因定位的结果进行可视化。
1.3 SiCHs基因同源进化分析及motif分析
通过MEGA 7.0[18]对筛选到的玉米、水稻和谷子的CHs家族蛋白序列进行比对后,再用最大似然法(Maximum Likelihood Estimate,MLE)构建系统发育树,iTOL(https://itol.embl.de/)优化进化树,利用MEME(http://meme—suite.org/tools/meme)分析保守motif,并用TBtools可视化作图。
1.4 SiCHs启动子顺式作用元件分析
提取起始密码子上游2 000 bp的基因组序列为启动子序列,在Plant CARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测其顺式作用元件,并用TBtools进行可视化作图。
1.5 SiCHs基因家族特异性表达分析
从Multi—omics Database for Setaria italica数据 库(http://foxtail—millet.biocloud.net/home)中获得谷子种子、根、茎、穗、叶等不同组织的基因表达量数据,通过R3.4.4绘制谷子CHs基因组织差异表达热图,进行可视化分析。
1.6 SiCHs基因家族响应禾生指梗霉菌侵染的转录表达分析
处理组(TG)将种子与2020年禾生指梗霉菌卵孢子按照10∶1比例混匀后种植,将耕层土壤与卵孢子按500∶1(0.2%)比例充分混匀覆盖于种子上,菌土覆盖2~3 cm。对照组(CK)种子采用75%无水乙醇消毒,种植于山西农业大学杂粮基地。自谷子雌雄蕊分化期至开花期间,谷穗受禾生指梗霉菌侵染刺激后,谷子颖花结构中俘片显著伸长,引起花变叶形成“刺猬头”。本试验在雌雄蕊分化期至开花期每隔3 d剪取谷穗中上部,共取5次,对照组编号为CK1~CK5,处理组编号为TG1~TG5,液氮速冻,-80℃保存,3次生物学重复。将上述样品进行转录组测序建库,利用转录组数据中FPKM值,通过R 3.4.4绘制谷子CHs基因响应禾生指梗霉菌侵染的表达热图,进行可视化分析,通过Gene Ontology(GO)数据库(http://geneontology.org)对差异表达基因进行GO富集分析。
2 结果与分析
2.1 SiCHs基因家族的鉴定、理化性质和基因定位
通过Pfam数据库筛选得到同时含有Chal_sti_synt_C和Chal_sti_synt_N等2个结构域的SiCHs家族基因共33个(图1),按照其在染色体上的位置(图2),命名为SiCHs1~SiCHs33,其中,SiCHs1~SiCHs33分布于谷子1、2、4、5、7、8、9号染色体,其中在8号染色体上分布最多为11个(SiCHs17~SiCHs27)。对SiCHs蛋白进行理化性质和亚细胞定位预测结果显示(表1),除SiCHs19仅编码156个氨基酸外,其余SiCHs基因编码氨基酸序列长度在331~530 bp,平均氨基酸数目423个;蛋白分子质量为16.74~57.50 ku;SiCHs家族33个成员的总平均亲水性(GRAVY)为负值,为疏水性蛋白;亚细胞定位多在细胞质,为一类调控酶合成的蛋白。


2.2 SiCHs家族蛋白序列同源进化分析及保守基序分析
对玉米、水稻与谷子的98个CHs蛋白进行比对,结果显示,CHs基因被分为5大类(图3)。class1含有15个CHs同源基因,包括6个谷子CHs、6个玉米CHs和3个水稻CHs;class2含有16个CHs同源基因,包括5个谷子CHs、7个水稻CHs和4个玉米CHs;class3含有13个CHs同源基因,包括7个谷子CHs、3个水稻CHs和3个玉米CHs;class4含有24个CHs同源基因,包括3个谷子CHs、17个水稻CHs和4个玉米CHs;class5含有30个CHs同源基因,包括12个谷子CHs、13个玉米CHs和5个水稻CHs。其 中,SiCHs13、SiCHs14、SiCHs25和SiCHs27这4个基因单独分支,推测不同物种在进化过程中部分基因功能不同。
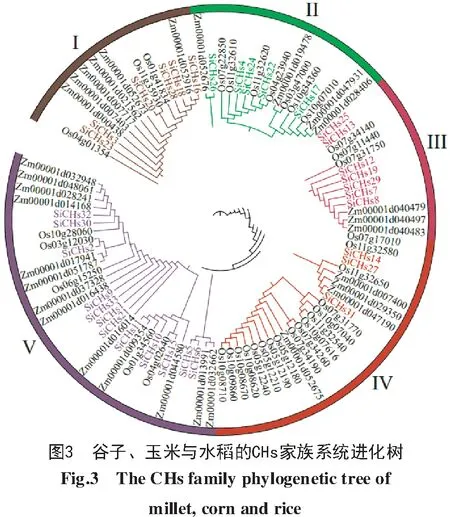
SiCHs基因家族成员的保守序列基序分析显示(图4),33个SiCHs蛋白序列共鉴定到8个保守序列基序,命名为motif1~motif8。33个SiCHs蛋白序列中均存在motif3、motif8和motif6,motif3中较为保守的序列为DLRLASLLGLRPSVRRTMLYG MGCSAGLAALRLAKDLAE,motif8中较为保守的序列为NNRGARVLVVCSEIT,motif6中较为保守的序列为MLVGQALFGDGAAAVIVGADP。class1~class5中,class2中的SiCHs24、SiCHs17不包含motif2;class3中的SiCHs19不包含motif1、motif2、motif4、motif5;class4中的SiCHs31不包含motif4、motif2、motif7;class5中SiCHs30、SiCHs1不包含motif2,且SiCHs2、SiCHs9、SiCHs10、SiCHs11、SiCHs15、SiCHs32、SiCHs33不包含motif2、motif4,其余class1~class5中SiCHs基因均含有motif1~motif8,且排布基本一致。说明CHs蛋白家族成员基本结构相对保守。

2.3 SiCHs基因家族启动子顺式作用元件
对SiCHs基因上游2 000 bp的序列进行顺式作用元件预测,结果共鉴定了20种顺式作用元件(图5)。SiCHs12、SiCHs26包含的顺式调控元件最多为12种;SiCHs15包含的顺式调控元件最少仅3种。该家族中具有防御和应激响应元件的基因有16个,8个基因具有玉米醇溶蛋白代谢调节响应元件,3个基因具有类黄酮生物合成基因调控响应元件,表明谷子CHs基因家族可能参与调控谷子响应病菌侵染的过程;31个基因具有MeJA响应元件,29个基因具有脱落酸响应元件,具有赤霉素响应元件的基因数目达18个,具有生长素响应元件的基因为12个,具有水杨酸响应元件的基因为7个,表明谷子CHs基因家族可能参与调控激素合成信号。此外,SiCHs家族基因还包括低温响应、干旱胁迫、光响应、分生组织表达、胚乳表达等顺式作用元件。

2.4 SiCHs基因家族特异表达分析
SiCHs基因在Xiaomi不同组织中的表达结果表明(图6),在茎中,SiCHs2、SiCHs27、SiCHs32基因表达量高于其他基因,其中SiCHs27表达量高达377.31,SiCHs2、SiCHs32基因表达量分别为86.57和86.92,其余基因低表达或不表达。在根中,SiCHs18基因表达量为89.74,其余基因低表达或不表达。在种子、叶和穗中SiCHs家族基因低表达或不表达。测定结果表明,谷子CHs家族基因的表达存在组织特异性表达。

2.5 SiCHs基因家族响应禾生指梗霉菌侵染的转录表达分析
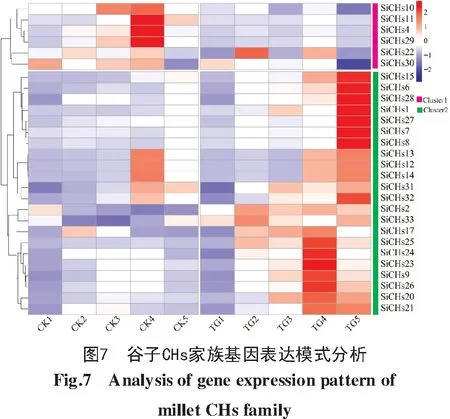
在CK 1~CK 5、TG1~TG5这10个样本中,去除表达量为0的5个基因(SiCHs3、SiCHs5、SiCHs16、SiCHs18、SiCHs19)。对样本中其余28个共有的差异表达基因进行聚类分析,根据表达模式的不同,可将这些差异表达基因聚为2类(图7)。聚类1(Cluster1)中有6个基因,与CK组比较,TG组表达下调,GO功能富集在脂肪酸的生物合成过程(GO:006633)、四酮α—吡喃酮合酶活性(GO:0090439)、花粉外壁形成(GO:0010584)、苯丙烷生物合成(GO:0009699)、聚酮生物合成(GO:0030639)、孢粉素生物合成(GO:0080110)等通路。聚类2(Cluster2)中有22个基因,与CK组比较,TG组表达上调,且在TG4、TG5时期显著上调,GO功能富集在类黄酮物质合成(GO:0009813)、查耳酮生物合成(GO:0009715)、花青素生物合成(GO:0031540)、蜡质合成(GO:0010025)、防御反应(GO:0009611)、生长素运输(GO:0009926)、茉莉酸抗病性(GO:0009753)、花粉管发育(GO:0048868)等通路。说明谷子受禾生指梗霉侵染后,CHs家族基因通过合成抗病类次生代谢产物及调控激素来防御病原菌侵染。
3 结论与讨论
本研究利用生物信息学方法对Xiaomi中的33个CHs基因进行分析发现,SiCHs基因与玉米、拟南芥、水稻等同源性较高,可能与同属禾本科单子叶植物有关,CHs家族在进化过程中相对保守。SiCHs家族成员多分布于8号染色体上,这与拟南芥中鉴定的聚类和分布情况相似[19]。亚麻中疏水性氨基酸占比较高,与本研究中SiCHs家族基因结果一致[20]。亚细胞定位预测表明,SiCHs蛋白多在细胞质,为一类调控酶合成的蛋白。林玲等[21]研究发现,辣木CHs基因在细胞质形成结合位点,与酶合成相关。SiCHs基因家族在Xiaomi不同组织中特异表达,在多种植物中也观察到类似的现象,如拟南芥、苦荞、辣椒等[22]。SiCHs2、SiCHs27和SiCHs32基因的表达主要集中在茎部,与茶树CHs基因在茎中表达量最高的结果相一致[23]。SiCHs18基因的表达主要集中在根部,与桑树CHs4基因在根皮中显著表达的结果一致[24]。
对SiCHs启动子顺式作用元件预测分析,发现SiCHs启动子区含有茉莉酸甲酯、水杨酸、生长素、赤霉素、脱落酸反应等激素响应元件,推测SiCHs的表达可能受激素影响。这与在烟草中CHs基因NTCHs启动子区也含有茉莉酸甲酯、水杨酸、生长素等激素响应元件一致[25]。其次,SiCHs启动子区含有类黄酮合成基因调控、玉米醇溶蛋白代谢、低温反应、干旱胁迫等防御应激响应元件,预测SiCHs可提高谷子抵抗逆境胁迫和病原菌侵染的能力。水稻CHs启动子区包含类黄酮物质合成、干旱诱导、缺氧诱导等防御和胁迫响应的作用元件[26]。再者,SiCHs启动子区含有分生组织表达、胚乳表达等顺式作用元件,与荞麦中CHs基因的部分启动子元件功能一致[27],推测SiCHs可能参与谷子生长发育调控。
本研究发现,受禾生指梗霉菌侵染,SiCHs家族中22个基因在穗部诱导高表达,类黄酮、花青素等抗病类次生代谢物质合成及水杨酸、茉莉酸、生长素等激素合成途径显著富集。芒果CHs基因表达量与查尔酮含量协同增减,查尔酮对11种芒果病原菌均具有明显抑制活性,MiCHs参与了植物自身防御反应[28]。大丽轮枝菌侵染拟南芥后,AtCHs基因上调表达,并合成花青素、类黄酮等抵抗病原菌的侵染[29]。推测谷子受禾生指梗霉菌侵染后,SiCHs家族基因通过合成抗病类次生代谢产物及调控激素来防御病原菌侵染及扩展。
本研究基于Xiaomi基因组和转录组数据,鉴定了33个SiCHs基因。通过染色体定位分析,发现8号染色体上基因最多,且位于8号染色体的SiCHs27在茎部特异表达,SiCHs18在根部特异表达。SiCHs启动子序列包含与激素响应相关、抗病类次生代谢、生长发育调控及逆境响应等顺式作用元件。SiCHs家族基因通过调控激素、类黄酮物质合成等途径抵抗禾生指梗霉菌的侵染。本研究结果可为进一步分析谷子CHs基因家族的功能及在谷子生长过程中的调控机制提供参考。
