急性冠脉综合征患者大颗粒HDL结合miR-33介导HDL趋炎化转变
2022-03-17赵晓静刘树理张琳
赵晓静,刘树理,张琳
(保定市第二医院 老年病科,河北 保定 071000)
高密度脂蛋白(high-density lipoprotein,HDL)在血浆中的水平被认为与心血管事件的发生风险密切相关,HDL水平越低心血管事件的发生风险越高[1-2]。HDL具有胆固醇逆转运(reverse cholesterol transport,RCT)、抗炎、抗氧化等多种重要的心血管保护功能,因此过往认为升高HDL水平可作为心血管保护的治疗靶点。但全球多个通过抑制血浆胆固醇酯转移蛋白(cholesteryl ester transfer protein,CETP)来升高HDL-C水平的大型队列研究均以失败告终,其中的具体机制尚未清楚,可能的解释为在不同的机体状态下,HDL-C的水平并不能总是反映HDL的心血管保护效应。HDL的颗粒大小及颗粒中的成分如蛋白质、miRNA和脂质等均具有多样性,在不同的疾病状态下呈现动态的变化。在急性冠脉综合征(acute coronary syndromes,ACS)等急性炎症条件下,HDL的颗粒大小及颗粒成分发生改变,从而失去其心血管保护作用转变为趋炎HDL,但其中的趋炎化转变机制尚不清楚,miR-33是一种内含子miRNA,与细胞胆固醇运输的基因表达调控密切相关[3]。此外miR-33可靶向结合ABCG1,降低RCT[3-4]。HDL在循环系统中可充当microRNA的运输载体,转运特定的microRNA到特定细胞组织发挥作用[5]。本研究旨在探讨ACS患者HDL大颗粒(L-HDL)运载的miR-33上调在介导HDL趋炎转变中的作用。
1 资料和方法
1.1 一般资料
本研究纳入2019年1月至2019年12月在本院心血管内科住院的男性ACS患者(ACS组),并选择同时间段无高血压、无糖尿病、无血脂异常、无吸烟史等无心血管危险因素的健康体检者作为对照组。患者的纳入标准:入院诊断符合美国心脏病学会(American College of Cardiology,ACC)、美国心脏病协会(American Heart Association,AHA)和欧洲心脏病学会(European Society of Cardiology,ESC)发布的指南对ACS的诊断标准;年龄≥18岁。排除标准:(1)风心病、心肌病、肺心病、心脏瓣膜病等其他器质性心脏病;(2)合并严重感染;(3)严重慢性肝肾功能不全;(4)甲状腺功能亢进、甲状腺功能低下、肿瘤、自身免疫性疾病、结缔组织病、近2个月行大手术或发生外伤、烧伤及重大应激事件;(5)既往有调脂药物应用史、抗氧化及非类固醇消炎镇痛药应用史;(6)有其他潜在的炎症相关因素疾病;(7)年龄≥80岁。最终共纳入48例ACS患者,52例健康体检者,并抽取全血分离血浆。
1.2 耗材和试剂
Tris、NaCl、EDTA和碳酸氢铵购自上海生工公司,硅钙水合物(calcium silicate hydrate,CSH)、佛波酯(Phorbol 12-myristate 13-acetate,PMA)均购自Sigma公司。Qiazol miRNAeasy Kits和miScript II RT Kit购自Qiagen公司。Luminex 200 assay(Milliplex Map Kit,Human Magnetic Bead,MAPmateTMBuffer Kit)和ox-LDL购自Millipore公司。
1.3 方法
1.3.1 一般资料和生化检测 采集ACS组入院时及对照组体检时的一般资料,包括年龄、BMI和血压。ACS组入院时及对照组体检时检测TC、TG、LDL-C、HDL-C、APOA1、ApoB、hsCRP、Insulin、HbA1c和GLU,上述生化指标均在本院检验科检测。
1.3.2 HDL大中小颗粒分离及纯化 本实验采用快速蛋白液相色谱(fast protein liquid chromatography,FPLC)法分离HDL大中小颗粒成分[6]。取500 μl血浆注入FPLC的进样器中,加入标准Tris缓冲液(STB:10 mmol·L-1Tris,0.15 mol·L-1NaCl,1 mmol·L-1EDTA),样本以0.3 ml·min-1流速经过3个串联 Superdex 200凝胶过滤柱进行分离,最终用1.5 ml馏分收集器(GE Healthcar)收集洗脱液,并4 ℃保存。洗脱液用CSH进行纯化,除去非HDL杂质,每0.5 ml洗脱液中每1 μg磷脂加入45 μg CSH,室温下颠倒混合30 min;2 200×g离心2 min,CSH压缩为球状沉淀;弃上清,上清包含无磷脂的蛋白及其他CSH杂质用50 mmol·L-1碳酸氢铵进行清洗,得到所有含有磷脂的组分,纯化完成。
1.3.3 miR-33水平测定 采用实时荧光定量PCR法检测miR-33的表达水平,根据Qiazol miRNAeasy Kits说明书分别提取血浆和HDL大中小颗粒组分中总RNA,琼脂糖凝胶电泳检测RNA的完整性,超微量分光光度计Nonodrop 2000 检测RNA浓度及纯度,合格样品定义为OD260 nm/280 nm为1.8~2.0,OD260 nm/230 nm>2。使用miScript II RT Kit进行miRNA逆转录生成cDNA。本实验采用SYBR荧光法进行荧光定量PCR检测,以U6为内参,检测miR-33在血浆和HDL大中小颗粒组分中的表达水平。所需引物如下:miR-33 forward primer:5′-GGTTAGATCTTGCTCCAGCGGTTTG-3′,miR-33 reverse primer:5′-GTAAAGCTTGCCCTCCTGTTTCCTG-3′;U6forward primer:5′-GCTTCGGCAGCACATATACTAAAAT-3′;U6 reverse primer:5′-CGCTTCACGAATTTGCGTGTCAT-3。采集反应生成的循环阈值(Ct值),按照2-ΔΔCt法处理数据。
1.3.4 胆固醇流出测定 本研究采用3H标记胆固醇完成胆固醇流出实验,分组如下:阴性对照组、recombination HDL(rHDL)组、L-HDL组、HDL中颗粒(M-HDL)组、HDL小颗粒(S-HDL)组和L-HDL+anti-miR33反义寡核苷酸(TGCAATGCAACTACAATGCAC)组(L-HDL+anti-miR33组)。THP-1巨噬细胞获取:取生长状态良好的THP-1细胞,按1×105个·孔-1均匀接种于6孔培养板中,并加入160 nmol·L-1PMA,37 ℃共孵育48~72 h,诱导分化成巨噬细胞。将各组THP-1巨噬细胞加入3H-胆固醇孵育液0.5 ml·孔-1,37 ℃培养24 h。3H-胆固醇标记24 h后弃去胆固醇孵育液,用无血清培养基洗板3次,随后加入同步液继续培养2 h。同步化2 h后用无血清培基洗板3次,分别加入上述各组含HDL的胆固醇诱导流出液500 μl,继续37 ℃培养4 h后收集培养液到EP管中,4 000 r·min-1离心10 min,取上清为3H-胆固醇流出液。继而用PBS清洗3次,加入0.1%的Triton-X100,充分吹打、振荡至少1 h,收集裂解液到EP管中;液体闪烁计数器计数并统计。胆固醇流出量按胆固醇流出液中3H放射性计量占胆固醇流出液及细胞内液中3H总量的百分比计算。
1.3.5 抗炎能力测定 泡沫细胞模型诱导:THP-1细胞按1×105个·孔-1均匀接种于6孔培养板中,用160 nmol·L-1的PMA和100 μg·ml-1的ox-LDL共孵育,使其分化为巨噬细胞,进而模拟泡沫细胞[7],分组如下:阴性对照组、rHDL组、L-HDL组、M-HDL组、S-HDL组和L-HDL+anti-miR33组。将含上述分组HDL500 μl的培养液分别培养THP-1泡沫细胞24 h,收集细胞上清,采用Luminex 200 assay检测TNF-α、IL-1β和MCP-1等炎症因子的表达。
1.4 统计学处理
本研究结果以平均值±标准差的方式表示,使用SPSS 22.0软件进行统计分析及GraphPad Prism 8.0软件进行作图。针对多个样本差异比较,若符合正态分布和方差齐性,则采用单因素ANOVA分析,并以Bonferroni法进行两两比较;若不符合,则采用Kruskal-Wallis检验分析。以P<0.05为差异具有统计学意义。
2 结 果
2.1 ACS组与对照组临床基线资料比较
两组之间年龄、收缩压、TG、ApoA1、HbA1c和GLU比较差异无统计学意义。ACS组血脂相关指标如TC、LDL-C、ApoB,炎症相关指标hsCRP,糖代谢相关指标胰岛素水平均高于对照组,差异有统计学意义(P<0.05)。两组HDL-C水平差异无统计学意义。此外,ACS组血浆中miR-33相对表达水平显著高于对照组,差异有统计学意义(P<0.05)。见表1。

表1 ACS组与对照组临床基线资料比较Tab 1 Comparison of clinical data between ACS group and Healthy group
2.2 FPLC分离血浆HDL
应用3个Superdex 200串联凝胶过滤层析柱收集,极低密度脂蛋白(VLDL)与LDL位于同一个峰值,故收集46~58组分为VLDL/LDL,收集60~77组分为HDL,其中60~65组分混合为L-HDL,66~71组分混合为M-HDL,72~77组分混合为S-HDL,最后分离出来的成分是白蛋白,见图1。
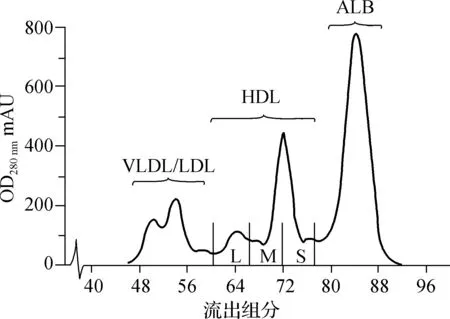
图1 FPLC分离血浆HDL分离谱Fig 1 Lipoprotein separation profile by FPLC
2.3 两组HDL亚组分中miR- 33的相对表达水平比较
采用实时荧光定量PCR检测两组HDL各亚组分中miR-33的相对表达水平如下:ACS组中L-HDL为6.10±0.61,M-HDL为2.01±0.32,S-HDL为1.4±0.18;对照组中L-HDL为2.30±0.45,M-HDL为1.41±0.17,S-HDL为1.01±0.09。两组中相对应HDL亚组分之间的差异均有统计学意义(P<0.05);此外使用反义寡核苷酸后ACS组L-HDL上miR-33的相对表达水平为2.68±0.28,与未使用反义寡核苷酸ACS组之间的结果差异有统计学意义(P<0.05)。见图2。

图2 ACS组和对照组HDL各亚组分中miR-33相对表达水平Fig 2 The expression of miR-33 in different HDL subfraction between ACS group and controll group
2.4 HDL结合miR- 33对HDL胆固醇流出功能的影响
3H胆固醇流出功能测定实验结果显示,与对照组相比,ACS组患者各亚组分HDL的胆固醇流出能力均有不同程度的下降,尤其是L-HDL组(P<0.05)。用反义核苷酸抑制miR-33后,ACS组L-HDL组的胆固醇流出能力显著增高(P<0.05)。见图3。
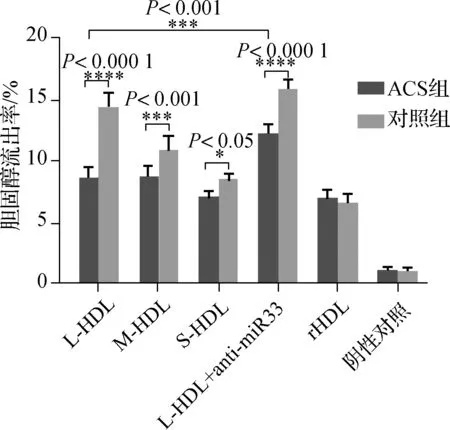
图3 HDL结合miR-33对HDL胆固醇流出功能的影响Fig 3 Effects of HDL combined with miR-33 on HDL cholesterol effluent function
2.5 HDL结合miR- 33对HDL抗炎能力的影响
通过Luminex 200实验检测炎症因子TNF-α、IL-1β和MCP-1在THP-1泡沫细胞中的表达,表达水平越高说明该组HDL亚组分的抗炎能力越低。结果显示:(1)ACS组TNF-α在L-HDL组表达水平为(112.86±10.51)pg·ml-1,L-HDL+anti-miR33组表达水平为(78.56±5.79)pg·ml-1,对照组中TNF-α在上述亚组中的表达水平分别为(60.46±8.29)、(50.02±4.22)pg·ml-1,ACS组和对照组中L-HDL组和L-HDL+anti-miR33组的TNF-α表达水平差异具有统计学意义(P<0.05)。(2)ACS组IL-1β在L-HDL组表达水平为(178.34±7.54)pg·ml-1,L-HDL+anti-miR33组表达水平为(138.24±6.77)pg·ml-1,对照组中IL-1β在上述亚组中的表达水平分别为(103.32±4.76)、(90.16±5.65)pg·ml-1,ACS组和对照组中L-HDL组和L-HDL+anti-miR33组的IL-1β表达水平差异具有统计学意义(P<0.05)。(3)ACS组MCP-1在L-HDL组表达水平为(428.70±10.85)pg·ml-1,L-HDL+anti-miR33组表达水平为(322.78±10.85)pg·ml-1,对照组中IL-1β在上述亚组中的表达水平分别为(294.02±14.051)、(272.14±9.14)pg·ml-1,ACS组和对照组中L-HDL组和L-HDL+anti-miR33组的MCP-1表达水平差异具有统计学意义(P<0.05)。见图4。

图4 HDL结合miR-33对HDL抗炎能力的影响Fig 4 Effects of HDL combined with miR-33 on HDL anti-inflammatory function
3 讨 论
血浆HDL-C水平与动脉粥样硬化性心血管疾病(atherosclerotic cardiovascular disease,ASCVD)风险呈负相关。但通过抑制CETP酶等方法增加血浆HDL-C水平并不能降低动脉粥样硬化性心脏病的风险,因此研究重点已然从HDL水平转到HDL功能。HDL直径大小范围在8~10 nm[8],在人体循环系统中充当一个纳米颗粒载体,运载大量的蛋白质、脂质及miRNA等分子,发挥胆固醇逆转运、抑制脂质氧化、恢复内皮功能、抗炎和抗凋亡等抗动脉粥样硬化的作用。近年来,大量研究表明在机体急性或者慢性炎症状态下,HDL的功能会发生改变,转变为功能失调性HDL或者是趋炎性HDL[9],失去其抗动脉粥样硬化的能力,具体机制尚未阐明,可能是因为炎症状态下HDL颗粒上携带的分子发生动态改变。本研究中ACS患者血浆炎症因子水平均明显高于对照组,说明患者发生ACS后机体处于一个急性炎症状态。我们进一步通过FPLC纯化两组HDL亚组分,观察ACS所致的急性炎症状态是否影响HDL各亚组分的功能。通过体外的胆固醇流出实验、炎症因子表达检测实验发现,ACS患者的HDL各亚组分胆固醇流出能力及抗炎能力均受损,尤其是L-HDL组。我们需要进一步探讨ACS患者L-HDL功能受损及促进炎症因子释放的具体机制。
miRNAs是参与大部分生物过程的关键调控因子和许多疾病的重要治疗靶点。研究[10]表明,miR-33在脂代谢及促动脉粥样硬化中发挥调控作用。本研究发现,ACS患者血浆中miR-33的水平明显高于对照组,ACS组分离纯化后各HDL亚组分结合的miR-33水平均显著高于对照组,尤其是L-HDL组。HDL可结合转运多种分子作用于心血管,而miRNAs是其中一种[11]。HDL结合miR-33水平增多对HDL功能的影响是我们关注的重点。我们通过反义寡核苷酸高亲和力特异性结合miR-33,降低L-HDL结合miR-33的水平,抑制miR-33的活性。我们的研究结果表明,抑制L-HDL结合miR-33后L-HDL的胆固醇流出功能和抗炎能力均相对恢复,说明L-HDL结合的miR-33水平增加可影响HDL的抗动脉粥样硬化功能,促进炎症因子释放,介导L-HDL的趋炎化改变。如果单纯通过药物增加体内HDL-C的水平而不改善HDL的功能,增加的都是趋炎化失功能的HDL,不仅无法抗动脉粥样硬化,还可能会进一步促动脉粥样硬化。越来越多的证据[12-14]表明,中风、心力衰竭和心肌梗死等重大心血管疾病的发生与HDL的功能受损密切相关。因此,如何改善HDL的功能应该是我们防控动脉粥样硬化及心血管事件的重中之重。本研究关注ACS患者HDL结合miR-33水平变化介导HDL功能受损,但HDL结合miR-33通过何种方式促进炎症及抑制胆固醇流出还需进一步探讨。
本研究创新点在于探讨病理条件下HDL颗粒结构成分的动态改变,通过FPLC分子筛温柔地纯化出疾病状态下的HDL,较高程度地还原体内真实的HDL,使我们能够更好地理解可能导致HDL功能丧失的潜在变化。我们需要进一步找到潜在干预靶点,以恢复HDL功能或增强特定的保护功能。对HDL结构和功能的研究,旨在设计和开发不同重组HDL配方,以克服在不同的疾病条件下HDL相关功能的改变,以获得在体内长期保持稳定和有效的HDL结构,并更接近健康和天然的HDL颗粒,才更具有心血管益处。
