探讨受体相互作用蛋白激酶1(RIPK1)在胃癌中的表达情况
2022-03-16蒋雪雪查娟民
刘 梅,蒋雪雪,查娟民
(苏州大学附属第一医院肿瘤科,江苏 苏州 215006)
胃癌是在我国人群中发病率和病死率均较高的消化系统恶性肿瘤,早期无症状且难以检测,诊断时已达到晚期。胃癌的发病机制目前尚未阐明,幽门螺杆菌感染、慢性炎症浸润、癌前病变、胃病史、生活习惯和饮食、精神心理因素都是与胃癌发生相关的危险因素[1]。受体相互作用蛋白激酶1(receptor interacting protein kinase 1, RIPK1)是一种丝氨酸/苏氨酸蛋白激酶,参与调控多个信号转导,决定着细胞存活和死亡[2]。其可以通过激活NF-κB、活化Caspase-8、参与活性氧的产生等方式,调控细胞存活(survival)、细胞凋亡(apoptosis)和程序性坏死(necroptosis)等重要过程[3-4]。目前有研究[5]表明RIPK1与癌症的发生有关,但RIPK1与胃癌发生和发展之间的关系,目前尚不明确。本研究利用免疫组化初步探索了RIPK1蛋白在胃癌组织中的表达及其临床意义。
1 资料与方法
1.1 临床资料 纳入标准:术前未曾进行放化疗和靶向治疗,术后组织病理学诊断为腺癌。收集2017年6月—2021年6月我院收治的20 例胃癌患者的胃癌及癌旁组织样本,获得的标本立即存储在4%中性甲醛中。收集其他临床病理资料,包括年龄、性别、肿瘤直径、临床分期等。其中患者平均年龄为(58.8±9.1)岁;男性患者为12 例,女性患者为8例;肿瘤大小>4.5 cm者8 例,≤4.5 cm者12 例;临床分期,Ⅰ-Ⅱ级13 例,Ⅲ-Ⅳ级7 例。
1.2 主要试剂 兔抗人RIPK1多克隆抗体购自Sigma-Aldrich公司(HPA015257),鼠抗兔二抗购自Cell Signaling Technology公司(7074),免疫组化显色试剂盒购自福州迈新生物技术有限公司(5920)。1.3 实验方法 样本经4%中性甲醛固定,石蜡包埋,予以连续切片,每张切片厚约6 μm。免疫组化操作步骤如下:(1)脱蜡及水化:石蜡组织切片烘片30 min以防止组织脱片。之后使用二甲苯和乙醇进行脱蜡。(2)柠檬酸法-抗原修复及内源过氧化物的去除:柠檬酸修复液在微波炉中加热到即将沸腾,放入脱蜡水化后的玻片,继续用微波炉加热约7 min;之后自然冷却至室温。用1×PBS洗3 次,每次5 min。加入3% H2O2孵育10 min,以去除内源性过氧化物。再用1×PBS洗3 次,每次5 min。(3)一抗孵育:先用5%山羊血清封闭30 min,之后RIPK1抗体按1:200溶于1% BSA,4 ℃孵育过夜。1×PBS洗3 次,每次5 min。(4)二抗孵育:生物素标记的二抗溶于5% NGS,室温孵育60 min。1×PBS洗3次,每次5 min。(5)显色:使用即用型试剂盒(迈新5920),加入1 滴1号试剂,室温孵育30 min;然后用1×PBS洗3 次,每次5 min;再加入2 滴显色液。显微镜下观察至染色完成之后加入PBS中终止反应,随后用1×PBS洗3 次,每次5 min。(6)苏木精染色及封片:切片用苏木精染色1 min后用自来水持续冲洗,之后用乙醇和二甲苯处理并用中性树胶封片。将玻片放在通风橱内风干后,存放于玻片盒,后续显微镜观察(奥林巴斯,IX-73)。
1.4 结果判定 40倍物镜下拍摄的免疫组化照片,每张切片随机选取5 个视野,采用ImageJ的IHC Profiler插件对免疫组化进行定量,其输出结果为high positive(高阳性),positive(阳性),low positive(弱阳性),negative(阴性)的百分比,属于半定量结果[6-7]。为了进行定量比较,我们给高阳性记4 分,阳性记3 分,弱阳性记2 分,阴性记1 分,并采用下列公式进行计算:表达量得分=(高阳性百分比×4+阳性百分比×3+弱阳性百分比×2+阴性百分比×1)/4,表达量得分介于1~4之间。
1.5 统计学方法 采用GraphPad Prism 8软件对实验结果进行统计分析。所有实验数据以均值±标准误表示,采用Student'st-test进行统计分析,P<0.05代表差异具有统计学意义。
2 结果
免疫组化显示,无论是癌旁组织还是癌组织,RIPK1均主要分布在胞质。采用ImageJ对免疫组化染色结果进行定量分析,结果显示RIPK1在癌组织中表达量为(1.663±0.356),在癌旁组织中表达量为(1.424±0.251),表明和癌旁组织相比,癌组织中RIPK1的表达显著上升(P<0.05,见表1)。在癌组织中,RIPK1的表达量与病人的性别、年龄、肿瘤大小及TNM分期均无关(P>0.05,见表2)。

表1 胃癌组织和癌旁组织中RIPK1的表达情况
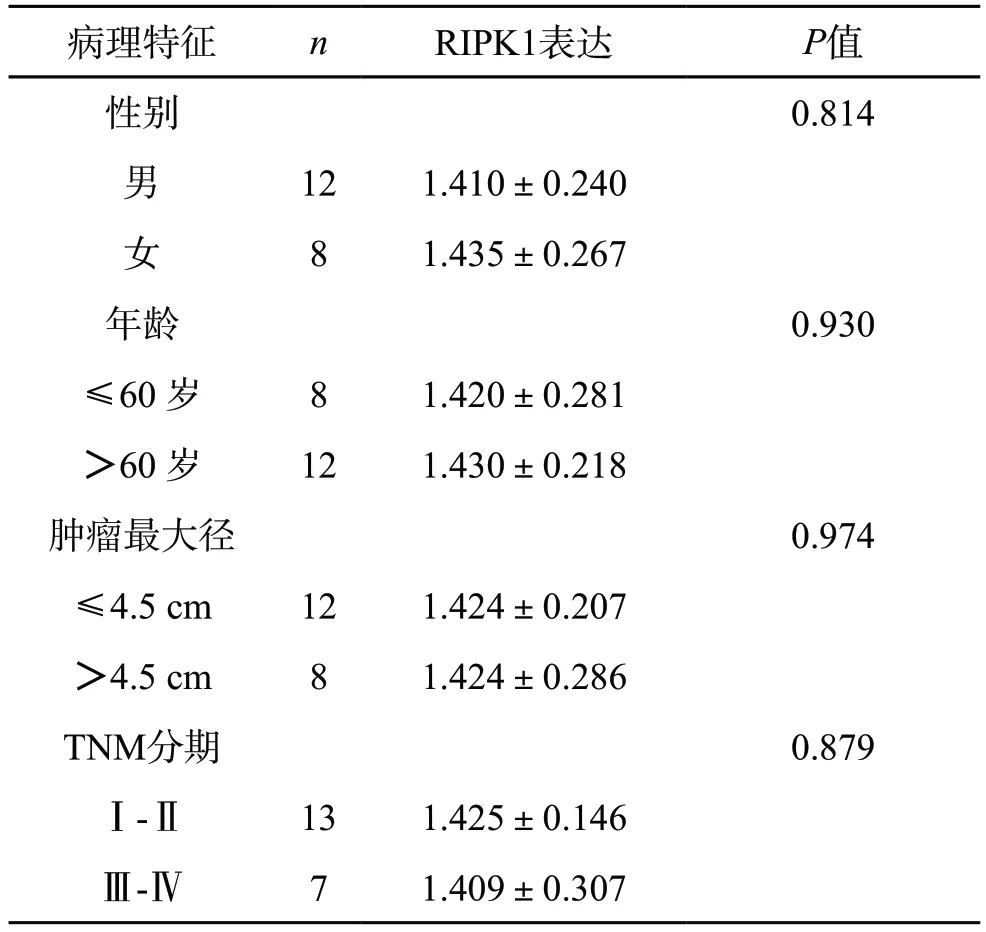
表2 RIPK1的表达与胃癌临床病理特征的关系
3 讨论
RIPK1是一类丝氨酸/苏氨酸蛋白激酶,位于Tumor necrosis factor(TNF)-Tumor necrosis factor receptors(TNFRs)通路下游。RIPK1是重要的细胞信号转导分子,参与调控细胞存活、炎症、凋亡和程序性坏死等多种细胞行为[3-4]。已有的研究表明,RIPK1参与两个重要的促生存通路的激活,包括NF-κB通路和PI3K-Akt通路。这两个通路在癌症的发生、恶性增殖、侵袭、迁移等过程中发挥重要作用,提示RIPK1可能起促癌作用。
RIPK1是细胞应激过程中导致NF-κB激活的信号级联中的必要成分[8-10]。当TNF结合其受体TNFR1时,TNFR1胞内段的死亡受体结构域聚集形成三聚体,招募TRADD、RIPK1、TRAF2、cIAP1/2,形成一种质膜上的蛋白质复合物,称为复合物Ⅰ。cIAP1/2能够诱导RIPK1进行Lys63型多聚泛素化,进而募集TAK1[11-12]。随后,TAK1磷酸化由IKKβ、IKKα、IKKγ形成的IKK复合物,活化的IKK复合物磷酸化下游抑制蛋白IκBα,促进IκBα蛋白降解,从而释放NF-κB二聚体。NF-κB二聚体易位至细胞核,结合到染色质上,最终激活下游靶基因转录[8-10]。RIPK1使用双重机制激活PI3K-Akt。一方面,RIPK1表达的增加通过阻断mTOR负反馈环,从而激活PI3K-Akt。另一方面,RIPK1能够下调胞内PTEN的表达水平,且这一过程不依赖于NF-κB的激活[13]。
目前,越来越多的证据提示RIPK1在癌症的发生发展中起了重要作用。已有研究[14-15]表明,RIPK1在胰腺癌、恶性胶质瘤等多种癌组织中表达上调。体外研究[16-17]表明,在结肠癌细胞系中过表达RIPK1能促进细胞增殖,RIPK1也可通过NF-κB信号调控非小细胞肺癌细胞增殖[18]。采用干扰siRNA特异性沉默RIPK1的表达后,细胞的体外增殖能力明显降低,并诱导了细胞凋亡的发生[19]。癌症是一系列原癌基因激活或抑癌基因失活而引起。P53抑癌基因的失活是许多癌症发生的重要原因。Park等[15]在恶性胶质瘤中发现,RIPK1可以负性调节P53肿瘤抑制性信号,RIPK1表达水平的增高可以完全抑制DNA损伤诱导的P53的增加,这种作用是通过上调胞内mdm2的水平实现的。因此,RIPK1通过激活NF-κB来上调mdm2,从而抑制P53。
本研究中,胃癌组织RIPK1主要定位于肿瘤细胞的细胞质,患者癌组织中RIPK1的表达明显高于对应癌旁组织,提示RIPK1表达增高是胃癌发生发展的一个重要因素。RIPK1参与胃癌发生发展的分子机制还需要进一步研究。
