DHPLC联合一代测序技术在脊髓肌萎缩症携带者筛查中的应用
2022-03-16刘春苗孟雁欣张志敏杨扬王亚男张海娟
刘春苗 孟雁欣 张志敏 杨扬 王亚男 张海娟
脊髓肌萎缩症(spinal muscular atrophy,SMA)因脊髓前角α-运动神经元退化变性引起的一组以缓慢进行性加重肌无力、肌萎缩为主要临床特征的常染色体隐性遗传性骨骼肌疾病,继杜兴型肌营养不良(Duchenne muscular dystrophy,DMD)之后第二常见婴幼儿致死性骨骼肌遗传病[1,2]。研究指出 95% 因 SMN1 纯合缺失(“0+0”型)致病,5% 因SMN1复合杂合突变(“0+1”型)致病[3]。部分研究证实白种人群中存在双等位基因均为微小变异致病[4]。因此,SMN1双等位基因致病性变异作为SMA发病机制,也是诊断SMA金标准。SMN2与SMN1序列具有高度同源性且均分布在5q13.2,作为公认的SMA修饰因子,研究指出患者携带 SMN2 拷贝数越多表型越轻,尽管其与表型的相关性不完全一致,但国内外SMA管理共识中仍将SMN2 拷贝数作为 SMA 诊断的标准步骤之一[5]。全美医学遗传学会(american college of medical genetics,ACMG)早在2008年即推荐将SMA携带者/产前筛查纳入常规孕前检查项目,并建议对高风险夫妇妊娠胎儿进行产前诊断或植入前诊断(preimplantation genetic diagnosis,PGD)[6]。本研究基于SMA分子致病特征,将高效液相色谱技术(DHPLC)作为SMN1/SMN2拷贝检测手段,同时联合一代测序技术对患者序惯性进行点突变检测,以证实DHPLC联合一代测序技术在脊髓肌萎缩症携带者/产前筛查中有重要临床价值。
1 资料与方法
1.1 一般资料 收集2018年1月至2019年1月因孕前筛查于石家庄市第四医院产前诊断中心就诊患者3 544例,其中男1 399例,女2 145例。签署知情同意书,抽取外周血3 ml。
1.2 分子生物学分析
1.2.1 DNA提取、PCR扩增:抽取3 ml外周血,天根DNA提取试剂盒获得基因组DNA,NanoDrop1000微量核苷酸蛋白多功能酶标仪(美国Gene公司)定量分析(OD260/OD280比值1.8~2.0),-80℃保存余DNA样本。Prime 6 软件设计引物,覆盖SMN1/KRIT1/CYBB全长,包括目的基因片段各个外显子及与内含子交界区,Pubmed blast比对引物。KRIT1/CYBB为内参基因。PCR扩增参数:95℃ 10 min热启动预变性,95℃ 30 s,54℃ 30 s,72℃ 60 s,共25个循环,72℃充分延伸 10 min。2% 琼脂糖凝胶电泳,100 V,30 min。见表1。

表1 PCR扩增片段及引物序列
1.2.2 DHPLC分析:样本完成PCR扩增进行DHPLC检测。5 μl PCR 反应样本上机(美国环球基因公司),选择类型DS Multiple Fragment,温度50℃,上样、洗脱。应用仪器自带软件计算SMN1/KRIT1比值,SMN1/KRIT1等于0纯合缺失,杂合缺失或携带为0.5,正常人为1。以SMN1/KRIT1 比值作为校正系数,所有比值按照校正系数进行比对后得出数据。
1.2.3 SMN1 测序分析:美国ABI 3730XL(Applied Biosystems,Foster City,CA)自动测序仪测序。Sequencher v4.90 (Gene Codes,Ann Arbor,MI,USA) 比对分析,致病变异位点进行家系成员靶向检测分析。分析变异序列与疾病表型有无共分离现象,进行基因变异位点定位、明确氨基酸变化及功能改变。
2 结果
2.1 3 544 DHPLC结果 3 544例携带者检测样本中,共检测出63例携带者,包含男33例,女30例,拷贝缺失携带者检出率1.78%。我们进一步对63例SMA携带者配偶进行SMN1检测,测得SMN1变异11例。SMN1缺失变异携带者9例(SMN1∶SMN2=1∶1),SMN1转换成SMN2 2例(SMN1∶SMN2=1∶3)。见图1。

图1 DHPL检出SMN1缺失携带者;A SMN1∶SMN2为1∶1;B SMN1∶SMN2为1∶2; D SMN1∶SMN2=1∶3; SMN1∶SMN2=1∶0
2.2 Sanger测序结果 SMN1 缺失分析检测后,对3 544 例样本进行SMN1 靶向测序分析,通过分析明确2例样本为SMN1点突变变异携带者。经Sequence 4.90及NCBI数据库比对分析证实1例为p.Q164X为致病突变携带者,对其配偶分别进行SMN1拷贝缺失及点突变检测未见异常。余1例为5号内含子位置SNP位点,数据库比对无显著致病意义。其他3 542例被检样本未检出致病意义明确变异位点。见表2,图2、3。

表2 受检人群、配偶及产前诊断胎儿 SMN1∶SMN2 基因型统计 例
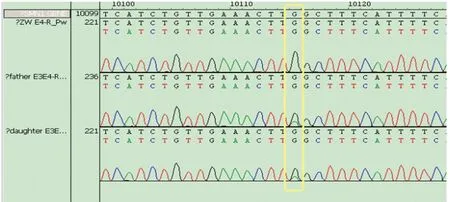
图2 SMN1 exon4发生:p.Q164X(C>T)变异,编码氨基酸碱基提前终止

图3 SMN1 5 号内含子 (第5外显子下游 59 位:基因组(Hg19)为:chr 5:70,240,639)存在 1 个 SNP(rs754465849)
2.3 产前诊断检测结果 夫妇双方知情同意并签署知情同意书后,我们对11对夫妇双方均为SMN1携带者胎儿于孕18周进行胎儿羊水染色体检查。测得2例胎儿SMN1纯合缺失,即SMA患者,1例胎儿缺失变异携带者SMN1∶SMN2=1∶1,1例胎儿为SMN1(p.Q164X)变异点突变携带者。余胎儿检出结果未见异常。后期随访过程中,我们分别对11例高危胎儿随访,2例SMN1纯合缺失胎儿夫妇选择双方终止妊娠。余胎儿分娩后未见显著异常。
2.4 不同SMN1∶SMN2基因变异携带者比较 不同SMN1∶SMN2比例携带者进行统计学比较,证实SMN1∶SMN2=1∶1最为常见,与其他组别比较具有统计学意义(P<0.01)。见表3。

表3 不同SMN1∶SMN2基因变异携带者检出率比较 n=78,例(%)
3 讨论
3.1 DHPLC应用于SMA携带者筛查中的优势 SMA是婴幼儿死亡最常见常染色体隐性神经骨骼肌遗传疾病,临床多依据临床表型、心肌酶、肌电图及骨骼肌活检进行初步诊断,由于缺乏特异性表型特征而多出现误诊、漏诊等情况[7]。与临床诊断依据比较,SMA基因检测因特异性强且取材方便的特征,逐渐被广大临床医生及受检者接受。迄今,已报道的SMA基因检测方法众多,如最早的单基因靶向测序技术、多重连接依赖性探针扩增技术(MLPA)、短片段多重定量PCR(QMMPSF)、实时荧光定量PCR(real-time PCR)、聚合酶链式限制性长度多态性分析技术(PCR-RFLP)、变性DHPLC等分子检测技术,此外,近年高分辨溶解曲线技术(HRMA)及液相微珠阵列技术(liquid microbead arrays)等也逐步开始应用于临床检测分析[8-10]。已知的上述技术手段不同程度的存在消耗成本高、耗时、点突变变异不灵敏、漏诊、误诊率高等问题,因此很难完全在临床广泛开展。
DHPLC技术作为高通量、自动化基因突变检测技术极具代表性,最早多应用于癌症靶点、药物研发等领域,与其他测序技术相比较,不需要制备凝胶,且具备全自动、高效、快速、准确、省时省力、成本低等特点。伴随分子技术向临床应用的广泛转化,DHPLC技术逐渐应用于小片段外显子缺失检测。本研究应用DHPLC对3 544例样本进行SMA携带者筛查,共检出61例缺失变异携带者,检出率约为1.72%。既往研究指出SMA携带者基因型变异主要分4种:[0+1]型、[2+0]型、[1+1d]及[2+1d]型,肯定携带者人群中以[1+0]型最为常见,即一条染色体SMN1等位基因正常而另一条染色体SMN1缺失的等位基因最为常见[10]。我们检出的携带者中均为[0+1]型,这与既往龚波章等[11]报道一致。
SMN1与SMN2碱基序列同源性高达 99%,由于二者且均分布在5q13.2,因此SMN1与SMN2间基因拷贝数可以相互转化并参与SMA疾病表型,即SMN2拷贝数增加可以减轻SMA临床表型[12]。通过检测SMN1及SMN2 拷贝数可从基因型及临床表型两方面综合评估SMA形成缘由及临床表型严重程度,而SMN1及SMN2 拷贝数变异比值的明确也可为遗传咨询提供依据。DHPLC技术除定性分析外,亦能通过确定SMN1与SMN2比值进行定量分析。我们研究中61例拷贝缺失变异携带者中,31例SMN1∶SMN2 =1∶1,11例 SMN1∶SMN2 =1∶2。DHPLC还明确检测出17例携带者为SMN1转换成SMN2(SMN1∶SMN2=1∶3)及2例携带者SMN1∶SMN2=1∶0。
基于上述携带者检测基础,我们同时对61例缺失携带者配偶进行SMN变异检测,测得11例SMN1变异[9例(SMN1∶SMN2=1∶1];2例(SMN1∶SMN2=1∶3)。以DHPLC对上述夫妇双方均为携带者高危胎儿进行SMN检测分析,检测结果证实2例胎儿为SMN1 纯合缺失,1例胎儿缺失变异携带者SMN1∶SMN2=1∶1。由此不难发现DHPLC对SMA携带者筛查或产前诊断均有重要意义,可有效减少相关患儿的出生[13]。
3.2 DHPLC联合一代测序技术检测应用于SMA携带者筛查的必要性及优势 SMA 患者95%因SMN1外显子7/8纯合缺失致病,5% SMN1点突变与缺失复合杂合致病[14],提示点突变检测对SMN必不可少。尽管DHPLC对拷贝缺失变异检测极为灵敏,但技术上仍有不足之处,如对PCR要求高,不能直接检测出纯合突变,只能提供个体样本无突变信息,但无法得出具体突变类型。因此,对点突变变异检测常会出现漏诊或误诊的可能[15]。一代测序技术作为单基因疾病诊断的“金标准”,以单基因单变异作为检测靶点,检测灵敏度、特异性毋庸置疑,且同样具备省时低成本的优势[16]。本研究技术联合中依据SMA分子致病特点,选择一代测序技术作为联合方法对样本进行SMN1点突变变异分析。研究检出1例样本携带SMN1 p.Q164X,1例样本发生SMN 1 多态性变异位点。因此本研究共计检出62例SMA携带者,DHPLC与一代测序技术的联合使携带者检出率由1.72%提高至1.75%,一定程度上提高了SMA携带者检出率。我们以同样的技术联合方式对夫妇双方均为携带者的高危胎儿进行SMA产前诊断筛查,测得2例胎儿为SMA患者及2例携带者[1例胎儿缺失变异携带者SMN1∶SMN2=1∶1,1例胎儿为SMN1(p.Q164X)变异点突变携带者]。再次提示SMA携带者筛查的重要性及技术联合的必要性。
3.3 河北地区SMN1携带者变异特征 研究数据指出SMA人群携带率1/100~1/45,亚洲人群携带率约1/48,SMA患者同胞携带率为66.67%,发病无性别差异[2]。本研究3 544例样本共计检测出62例(61例缺失变异带+1例点突变变异)SMN1变异为致病携带者,人群携带率约1.75%,与我国宋昉[4]报道北方人群1/60携带率一致。但低于既往报道的上海、香港、台湾等南方地区人群携带率,提示SMA除具有较高人群携带率外还存在较强的南北地区差异性[17]。我们检出62例携带者中约98.38%为缺失携带,男女比例1∶1,证实河北地区SMA携带不存在男女性别差异。
综上所述,SMA分子诊断对于预防及减少此类患儿出生有重要意义,规范、精准SMA携带筛查流程建立可有效降低缺陷患儿出生,也是实现SMA二级预防的有效途径。同时技术联合可显著提高SMA携带者/患者检出率,有效减少临床误诊、漏诊。
