小白菊内脂通过wnt/β-catenin影响胃癌细胞侵袭、迁移、凋亡的机制研究
2022-03-16张荣姚春和
张荣 姚春和
胃癌是全球常见的消化道肿瘤,对其早期诊断、治疗、预测肿瘤复发转移和评估预后有重大意义[1]。Wnt/β-catenin信号通路的异常活化与人类多种癌症的发病相关,可调控细胞的增殖、迁移、黏附和凋亡等,β-catenin是Wnt/β-catenin信号传导途径的关键调控因子,β-catenin水平低时,Wnt通路关闭,反之,Wnt通路开启[2]。研究发现胃癌转移患者组织中Wnt1 mRNA水平明显上调,β-catenin蛋白的水平也明显增加,提示其与胃癌的进展有关[3]。研究发现中医药在一定程度上可以防治胃癌的侵袭和转移[4]。小白菊内脂(parthenolide,PTL)是从中草药小白菊中提取的一种倍半萜内脂类化合物,其具有免疫调节功能,且还能抑制肿瘤细胞生长,诱导肿瘤细胞凋亡[5]。PTL能通过抑制PI3K/Akt信号通路诱导非小细胞性肺癌H1975细胞发生凋亡,抑制其侵袭和迁移[6]。PTL还能有效抑制结肠癌细胞及移植瘤的生长[7]。PTL还具有抑制胃癌细胞增殖和诱导其凋亡的作用[8]。但PTL对胃癌细胞侵袭迁移的影响及其作用机制还尚未可知,本实验旨在研究PTL是否调控Wnt/β-catenin信号通路影响胃癌细胞侵袭、迁移和凋亡。
1 材料与方法
1.1 材料 胃癌细胞SGC-7901、SNU-1(货号:YS265C、YS1368C,上海雅吉生物科技有限公司);胎牛血清(货号:10437-028,美国Gibco公司);RPMI-1640培养基(货号:R1145)、胰蛋白酶(货号:T7409)购自美国Sigma公司;MTT试剂盒(货号:8028,美国Sciencell公司);Annexin V-FITC/PI试剂盒(货号:AD10-2,日本同仁研究所);BCA试剂盒(货号:23227,美国PIERCE公司);RIPA蛋白裂解液(货号:BB-3201,贝博生物技术公司);SDS-PAGE试剂盒(货号:PN1200-25T,金克隆(北京)生物技术有限公司);Wnt激活剂CHIR99021(货号:S2924,美国Selleck公司);Transwell小室(货号:354480)、Matrigel(货号:356234)(美国BD公司)。
1.2 方法
1.2.1 细胞培养与分组:将胃癌细胞SGC-7901、SNU-1接种于含10 %胎牛血清的灭菌的RPMI-1640培养液中进行培养,取对数生长期细胞SGC-7901、SNU-1,将其用不同浓度的小白菊内酯(0 μmol/L、10 μmol/L、20 μmol/L、40 μmol/L、60 μmol/L)处理SGC-7901、SNU-1细胞,记为对照组、10 μmol/L组、20 μmol/L组、40 μmol/L组、60 μmol/L组;用20 μmoL/L的小白菊内酯作用于SGC-7901、SNU-1细胞培养12 h后再加入5 μmol/L的CHIR99021培养6 h,记为CHIR99021+PTL组。
1.2.2 MTT检测细胞增殖:收集以上各组培养12 h、24 h、48 h的细胞,按试剂盒说明操作,酶标仪检测490 nm处吸光度(A)值。细胞增殖抑制率(%)=1-(A实验组值/A空白对照组值)×100%。
1.2.3 流式细胞术检测细胞凋亡:收集以上各组细胞,按试剂盒说明书操作,上流式细胞仪检测细胞凋亡情况。
1.2.4 Western blot检测蛋白表达:提取总蛋白,BCA试剂盒定量;然后分别进行SDS-PAGE电泳,转膜,封闭;然后加入一抗和二抗孵育,最后在暗室中曝光显影,定影,检测蛋白条带吸光度,以β-actin为内参计算蛋白表达水平。
1.2.5 Transwell实验检测细胞迁移和侵袭:收集以上各组细胞,制成细胞悬液。细胞迁移实验:Transwell小室上室接种细胞悬液,下室中添加细胞培养液,培养24 h,PBS洗涤细胞,加入4%多聚甲醛固定,再用结晶紫染色,显微镜下拍照并计数。细胞侵袭实验:用Matrigel覆盖Transwell小室的上室,其余按照细胞迁移实验步骤操作。
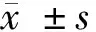
2 结果
2.1 PTL对SGC-7901、SNU-1细胞的增殖抑制作用 不同浓度小白菊内酯后胃癌细胞SGC-7901、SNU-1的增殖抑制率均显著高于对照组(P<0.05)。可见,小白菊内酯抑制胃癌细胞SGC-7901、SNU-1的增殖。见表1。

表1 MTT法检测不同浓度PTL对SGC-7901、SNU-1细胞增殖的影响
2.2 PTL对SGC-7901、SNU-1细胞凋亡的影响 与对照组相比,不同浓度PTL组胃癌细胞SGC-7901、SNU-1的凋亡率升高(P<0.05),胃癌细胞SGC-7901、SNU-1中Bax表达水平升高,Bcl-2表达水平降低(P<0.05)。可见,小白菊内酯促进胃癌细胞SGC-7901、SNU-1凋亡。见表2。

表2 不同浓度PTL对SGC-7901、SNU-1细胞凋亡影响
2.3 PTL对SGC-7901、SNU-1细胞侵袭和迁移的影响 与对照组相比,不同浓度PTL组胃癌细胞SGC-7901、SNU-1中Vimentin的表达水平降低(P<0.05),snail的表达水平降低(P<0.05),E-cadherin的表达水平升高(P<0.05),细胞SGC-7901、SNU-1迁移和侵袭数量显著降低,差异有统计学意义(P<0.05)。小白菊内酯抑制胃癌细胞SGC-7901、SNU-1的迁移和侵袭。见表3,图1。

表3 不同浓度PTL对SGC-7901、SNU-1细胞侵袭和迁移的影响

图1 Transwell assay 检测不同浓度PTL对SGC-7901、SNU-1细胞侵袭和迁移的影响(结晶紫染色×200)
2.4 PTL处理SGC-7901、SNU-1 细胞,wnt-1、β-catenin 蛋白表达情况研究 与对照组相比,不同浓度PTL处理组胃癌细胞SGC-7901、SNU-1中wnt-1、β-catenin的表达水平降低(P<0.05)。见表4。

表4 不同浓度PTL处理SGC-7901、SNU-1细胞,wnt-1、β-catenin 蛋白表达情况
2.5 PTL和Wnt激活剂(CHIR99021)+PTL对SGC-7901、SNU-1细胞凋亡、侵袭、迁移的影响 与PTL组相比,CHIR99021+PTL组胃癌细胞SGC-7901、SNU-1中wnt-1、β-catenin、Bcl-2、Vimentin、snail的表达水平显著升高,Bax、E-cadherin的表达水平显著降低(P<0.05),胃癌细胞SGC-7901、SNU-1的凋亡率显著降低(P<0.05),胃癌细胞SGC-7901、SNU-1迁移和侵袭数量显著升高(P<0.05)。见表5~7,图2。

表5 PTL和Wnt激活剂(CHIR99021)+PTL对SGC-7901、SNU-1细胞凋亡、侵袭、迁移的影响

表6 Western blot检测SGC-7901细胞中wnt-1、β-catenin 、Bax、Bcl-2、E-cadherin、Vimentin、snail的蛋白表达

表7 Western blot检测SNU-1 细胞中wnt-1、β-catenin 、Bax、Bcl-2、E-cadherin、Vimentin、snail的蛋白表达

图2 用Transwell assay 检测不同浓度PTL对SGC-7901、SNU-1细胞侵袭和迁移的影响(结晶紫染色×200)
3 讨论
胃癌的发病率及死亡率近年来不断上升,目前主要采用以手术为主的综合治疗,但转移复发率高,而在不同阶段中医药可以发挥预防癌前病变、促进术后康复、减轻放化疗毒性,提高生活晚期患者质量,延长生存期等作用[9]。PTL是一种天然产物,对肿瘤细胞有较好的杀伤作用,PTL不仅能促进细胞凋亡,并抑制SW620细胞的迁移和侵袭[10]。PTL还能够抑制宫颈癌Hela细胞株生长与迁移能力[11]。PTL通过下调GSK3β磷酸化抑制SNAIL蛋白入核,从而促进了E-cadherin蛋白的表达进而抑制胶质瘤细胞的迁移、侵袭[12]。PTL降低了乳腺癌细胞分泌的MMP-9,VEGF和IL-8的水平,抑制人脐静脉内皮细胞的增殖,迁移[13]。以上研究表明PTL具有抑制多种癌症进展的作用。为研究PTL是否对胃癌具有抑癌作用,本实验用不同浓度的PTL处理SGC-7901、SNU-1细胞,结果显示,细胞增殖抑制率升高,凋亡率升高,胃癌细胞SGC-7901、SNU-1中Bax表达水平升高,Bcl-2表达水平降低,迁移、侵袭细胞数降低;表明PTL可抑制胃癌细胞SGC-7901、SNU-1增殖、迁移、侵袭,并可促进细胞凋亡。
上皮间质转化是肿瘤发生转移的重要机制之一,上皮性E-钙粘蛋白(E-cadherin)是上皮间质转化(EMT)相关的蛋白,不仅可调节细胞之间的粘附性,还可以调节基质金属蛋白酶(MMP)的表达影响胃癌的侵袭转移[14]。波形蛋白(Vimentin)是EMT相关的骨架蛋白,其高表达时肿瘤的迁移侵袭能力强[15]。Snail是一种锌指蛋白转录因子,可以通过抑制E-cadherin影响EMT,抑制其表达可以抑制胃癌细胞体外迁移和侵袭能力[16]。以上研究表明EMT过程与癌细胞的迁移和侵袭能力密切相关。本研究结果显示,PTL处理的胃癌细胞SGC-7901、SNU-1中Vimentin、snail蛋白下调表达,而E-cadherin上调表达表达;表明PTL可抑制胃癌细胞的EMT过程,推测PTL对胃癌细胞SGC-7901、SNU-1迁移、侵袭的抑制作用可能与抑制EMT过程有关。
Wnt信号传导通路同肿瘤转移早期的EMT现象密切相关,可直接或间接影响EMT相关蛋白和EMT的诱发因素,如β-catenin可使E-cadherin保持粘附功能。研究发现Wnt/β-catenin信号参与胃癌细胞的增殖、侵袭和转移,是介导胃组织癌变的关键信号;靶向抑制Wnt/β-catenin能够抑制胃癌的生长、侵袭转移[17]。研究报道下调胃癌中的Wnt /β-catenin通路能抑制细胞侵袭和迁移[18]。汉黄芩素可抑制Wnt/β-catenin通路进而抑制胃癌细胞增殖、侵袭和迁移,并诱导凋亡[19]。沉默YAP通过抑制Wnt/β-catenin信号通路激活诱导胃癌BGC823细胞的凋亡[20]。表明抑制Wnt/β-catenin通路可抑制胃癌细胞的恶性生物学行为,且药物可影响Wnt/β-catenin通路激活与否。本实验用不同浓度PTL处理胃癌细胞后,wnt-1、β-catenin蛋白表达水平降低,表明PTL可能抑制了Wnt信号通路的激活。此外,浓度为20 μmol/L的PTL对wnt-1、β-catenin蛋白表达的抑制率接近50%,因此选用此浓度与Wnt激活剂共同作用胃癌细胞,检测其对胃癌细胞凋亡、侵袭、迁移的影响;结果显示,激活Wnt信号通路可以逆转PTL对胃癌细胞的侵袭、迁移抑制和凋亡促进的作用。提示,PTL对胃癌细胞侵袭、迁移的抑制作用和Wnt/β-catenin信号通路有关。
综上所述,小白菊内酯可抑制胃癌细胞的增殖、侵袭和迁移,促进其凋亡,其机制可能与调控Wnt /β-catenin信号通路及相关蛋白有关,将可为胃癌的治疗提供新思路和新靶点。
