阻断NKG2A共抑制分子在抗肿瘤免疫效应中的研究进展
2022-03-16阿依努尔艾尔肯阿卜杜艾尼啊卜力孜塔来提吐尔干吐尔干艾力阿吉
阿依努尔·艾尔肯 阿卜杜艾尼·啊卜力孜 塔来提·吐尔干 吐尔干艾力·阿吉,2,3▲
1.新疆医科大学第一附属医院肝胆包虫病外科,新疆乌鲁木齐 830054;2.新疆医科大学第一附属医院消化血管外科中心,新疆乌鲁木齐 830054;3.新疆维吾尔自治区包虫及肝胆疾病临床医学研究中心,新疆乌鲁木齐 830054
自然杀伤(natural killer,NK)细胞与T细胞和B细胞不同,其激活不需要抗原的事先致敏,在抵御病毒感染、肿瘤生长和转移扩散中发挥重要作用[1-2]。NK细胞功能的调节/诱导是由一系列激活性或抑制性表面受体介导的。程序性死亡受体1(PD-1)/程序性死亡配体1(PD-L1)轴的治疗性单克隆抗体在肿瘤免疫治疗中备受关注,已经是多种不同类型癌症的治疗药物[3-5]。然而,PD-1/PD-L1轴单克隆抗体的耐药性使更多的学者开始寻找其他的免疫检查点[6]。近年来研究较多的是NK细胞表面的新的免疫检查点——NKG2A。活化的NK细胞会产生多种细胞因子和趋化因子,导致机体发生炎症或者加深炎症,此外NK细胞也会调节下游的免疫反应,会对适应性免疫防御产生影响[7]。
1 NK细胞表面受体
NK细胞表面受体根据其发挥的免疫学效应分为激活性受体和抑制性受体。激活性受体主要有NKG2D、NKP30、NKP44和NKP46等;抑制性受体主要有 NKG2A、TIM-3、TIGIT 和 LILRB1等[7-8]。卵巢癌、头颈部鳞癌等癌症患者体内的NK细胞表面可能表达PD-1[7]。
2 NKG2A及其配体
NKG2A是一种在T细胞和NK细胞上均表达的抑制性受体,在慢性病毒感染和肿瘤患者的外周血中,超过50% NK细胞和细胞毒性T淋巴(CD8+T)细胞表面表达NKG2A[9-10]。在人类中,NKG2A与人类白细胞抗原E(HLA-E)结合;在小鼠体内,NKG2A与Qa-1b(HLA-E同源物)结合,有研究报道NKG2A是人类白细胞抗原G(HLA-G)的新受体[11]。在健康人体内,HLA-E的表达普遍较低,在胎盘滋养细胞、睾丸和附睾的导管上皮细胞中呈高表达,提示HLA-E在人体内一些需要免疫耐受的器官中发挥作用[12]。在肺、肾、胰腺、胃、头颈、肝脏、黑色素瘤、前列腺和结直肠肿瘤组织的肿瘤组织切片上有HLA-E富集现象[12-16]。在头颈部恶性肿瘤、乳腺癌和非小细胞肺癌中,发现侵袭性NK细胞表达NKG2A[17],且肿瘤细胞HLA-E的高表达与不良预后相关[11]。HLA-G的表达上调也可见于病毒感染、多种类型的癌症以及一些免疫介导疾病[9]。体外实验结果显示IFN-γ可明显增加HLA-E的表面表达[18-20],HLA-E的高表达可能与癌症细胞上皮黏附分子有关[21],肿瘤局部树突状细胞及肿瘤中其他专职性抗原提呈细胞亚群和炎性巨噬细胞HLA-E表达上调,这提示HLA-E在肿瘤免疫逃逸中有潜在作用[22]。
3 NKG2A的免疫效应
NKG2A通过SHP-1基因来传递抑制信号[23]。虽然SHP-1基因的激活被认为是NK细胞激活的负信号,但其缺失在很大程度上损害了NK细胞的活性[24]。根据CD56抗原的表面密度,人类NK细胞被分为两个主要的亚群,CD56brightNK细胞和CD56dimNK细胞。CD56brightNK细胞表达NKG2A、细胞溶解能力差、分泌γ干扰素(IFN-γ)和肿瘤坏死因子α(TNF-α)等细胞因子,主要在组织滞留,外周血淋巴细胞中仅占10%[2]。CD56dimNK细胞含有更多的穿孔素和颗粒酶,代表了强烈的有细胞毒性NK细胞亚群,占外周血淋巴细胞的90%[2,25]。NKG2A受体参与诱导的抑制性信号导致NK细胞和CD8+T细胞裂解靶细胞的能力下降。NKG2A受体通过破坏激活受体NKG2D的免疫突触的肌动蛋白网络来抑制NK细胞的细胞毒效应功能[23]。
3.1 NKG2A在肿瘤中的免疫效应
在小鼠体内NKG2A与Ly49家族协同调节NK细胞发育,缺乏NKG2A受体表达可损害NK细胞的活性[24]。在肝癌患者中,与正常肝组织相比肿瘤局部NK细胞NKG2A表达上调,同时INF-γ产生减少;宫颈癌、卵巢肿瘤患者肿瘤局部CD8+T细胞NKG2A表达上调[26]。肝癌细胞体外培养结果显示NKG2A+CD8+T细胞群增殖能力减弱,细胞毒性减弱;在NKG2A阻断治疗后NKG2A+的大多数细胞增殖能力和细胞毒性都有一定程度的恢复。在肿瘤衍生的CD8+T细胞上也观察到类似的现象[21]。在结直肠癌患者外周血淋巴细胞中NKG2A、NKG2D mRNA水平显著提高[27]。在头颈部鳞状细胞癌患者中多数肿瘤浸润NK细胞中观察到NKG2A表达,在肿瘤环境下的CD8+T细胞中选择性表达,在CD4+T细胞上几乎不表达。在接种癌症疫苗诱导后,肿瘤中NKG2A+CD8+T细胞的百分比显著增加,相反在该荷瘤小鼠的脾脏中检测到不到5%的NKG2A+CD8+T细胞[13]。这意味着NKG2A受体在肿瘤中有很强的选择性定位,在瘤内CD8+T细胞上的表达是动态的,与控制肿瘤的发生发展相关。
3.2 NKG2A在感染性及其他疾病中的免疫效应
NKG2A受体在感染性及其他疾病中的高表达使NK、CD8+T细胞功能衰竭,在疾病中发挥了免疫抑制作用。在泡型棘球蚴病模型中,NK细胞表达NKG2A明显高于对照组且INF-γ的产生低于对照组[28]。在感染了新型冠状病毒的患者体内NK和CD8+T细胞数量减少、功能衰竭、NKG2A表达增加。治愈后NK和CD8+T细胞的数量恢复,NKG2A表达量也恢复正常[29]。在慢性乙型肝炎患者体内NKG2A+NK细胞百分比增加,而阻断NKG2A恢复了NK细胞的功能;乙型肝炎抗原(HBeAg)阳性患者NKG2A+NK细胞和IL-10+调节性T细胞(Treg细胞)以及血清丙氨酸转移酶和乙型肝炎病毒脱氧核糖核酸水平显著升高。表明HBeAg诱导Treg中IL-10的产生导致NK细胞上NKG2A的表达增加,从而导致HBV感染期间NK细胞功能障碍[30]。NKG2A是丙型肝炎病毒感染中NK细胞衰竭的标志[31]。肾移植术后外周血NK细胞表型为NKG2ANKG2D+的患者预后良好,而NKG2A+NK细胞表型患者常出现移植后功能受损[32]。
4 阻断NKG2A在抗肿瘤中的免疫效应
在一些肿瘤模型中阻断NKG2A缓解了NK、CD8+T细胞的功能耗竭;除单独阻断NKG2A外,联合阻断其他免疫检查点得到了更好的抗肿瘤效果。
4.1 淋巴瘤细胞模型中阻断NKG2A的抗肿瘤效应
与Qa-1b正常淋巴瘤模型相比在70%的Qa-1b缺陷肿瘤模型中未见肿瘤的生长且CD107a(NK细胞活化标志)的表达高于Qa-1b正常共培养体系[33]。而在阻断NKG2A的肿瘤模型中可以观察到CD107a表达上调。单独阻断NKG2A或PD-L1只能轻微改善肿瘤浸润CD8+T细胞的效应活性,但两者的结合避免了70%的小鼠死亡。
在另一个肿瘤模型中观察到,经免疫治疗治愈的肿瘤小鼠脾脏内有记忆效应T细胞,而未治疗的小鼠脾脏内未观察到[33]。将相同肿瘤细胞注射到经过联合阻断NKG2A和PD-L1治疗且治愈的小鼠体内时,未见肿瘤细胞生长。将相同肿瘤细胞注射到未经治疗的小鼠体内时则可见肿瘤迅速生长。提示联合阻断NKG2A和PD-L1可以促进抗肿瘤记忆细胞的产生[33]。
4.2 结直肠癌肿瘤模型中阻断NKG2A的抗肿瘤效应
体外三维培养结直肠恶性肿瘤模型中,阻断NKG2D的配体基因MICA/B之后NKG2A在浸润性T淋巴细胞表面表达增加,但在NK细胞表面表达下调[16]。单独阻断NKG2A之后未观察到其发挥抗肿瘤作用。但是在阻断MICA/B的同时阻断NKG2A后观察到肿瘤细胞的凋亡,肿瘤体积减小。表明在该肿瘤模型中联合阻断MICA/B和NKG2A对免疫介导的抗肿瘤反应有协同作用。
4.3 蛋白质表达阻断剂阻断NKG2A的抗肿瘤效应
一种含有抗NKG2A抗体单链可变片段的构建体与内质网滞留结构域相连的蛋白质表达阻断剂可阻止NKG2A转运到NK细胞表面,消除NKG2A的表达[34]。产生的NKG2AnullNK细胞对表达HLA-E的肿瘤细胞具有更高的细胞毒性。转导NKG2A蛋白质表达阻断剂比抗NKG2A单抗进行干扰可产生更强的细胞毒性,且能在不影响NK细胞增殖的情况下防止NKG2A的重新表达[34]。
4.4 人源化抗NKG2A单抗Monalizumab阻断NKG2A的抗肿瘤效应
Monalizumab是一种人源化抗NKG2A单抗,通过阻断NKG2A+细胞与其配体的结合增加细胞脱粒和IFN-γ的产生,从而促进NK细胞杀伤功能(如图1所示)[33]。在体外实验中单独使用Monalizumab或度伐单抗仅能适度增加效应细胞的反应性,而这两种抗体联合使用时增加了NKG2A+CD8+T细胞脱颗粒的频率。据此可以推断,Monalizumab有效恢复了NKG2A的参与所产生的抑制作用[33,35]。
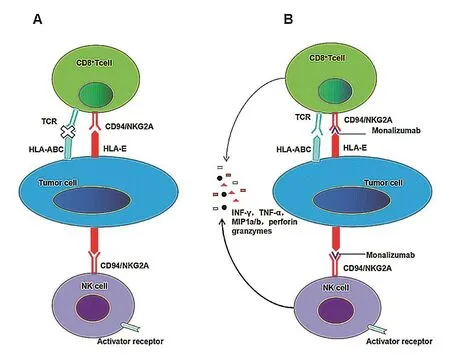
图1
4.5 达沙替尼阻断NKG2A的抗肿瘤效应
用达沙替尼治疗慢性髓系白血病,体内外实验均证实达沙替尼通过抑制p38MAPK信号通路,从而影响GATA3的核输入和GATA3对NKG2A的转录活性使得达沙替尼可以通过选择性抑制NKG2A促进NK细胞毒性和脱颗粒能力,使患者NK细胞表面NKG2A的表达逆转到非常低的水平[36]。此外也有研究报道,抗NKG2A抗体可用在急性白血病化疗后的过继治疗中[37],联合阻断NKG2A和LIR-1有望利用NK细胞治疗急性白血病[38]。
4.6 肿瘤疫苗联合阻断NKG2A的抗肿瘤效应
NKG2A/Qa-1b轴在治疗性癌症疫苗中的重要抑制作用是通过增加肿瘤中CD8+T细胞上NKG2A的表达和诱导肿瘤细胞上Qa-1b的表达来介导的。在接受疫苗接种的荷瘤小鼠中,阻断NKG2A增加了无进展生存期,几乎所有的荷瘤小鼠都有完全或者部分的肿瘤逆转或生长延迟。阻断这一轴可有效提高治疗性癌症疫苗的疗效[13]。
5 有关Monalizumab的新研究进展
一项二期临床试验评估了Monalizumab联合西妥昔单抗治疗头颈部鳞状细胞癌患者的有效性和安全性,其中40例可评估患者的总有效率(ORR)为27.5%,高于早期报道的西妥昔单抗治疗总有效率13%[33,35]。目前Monalizumab或安慰剂联合西妥昔单抗治疗头颈部复发性或转移性鳞状细胞癌的全球Ⅲ期临床试验正在开展。此外还有其与度伐单抗在成人晚期实体肿瘤中的1/2期研究正在开展;以及其和曲妥珠单抗治疗转移性HER2阳性乳腺癌的Ⅱ期临床试验即将开展。最新的报道指出,一种名叫KSQmab的NKG2A阻断抗体被证明其药物亲和力是Monalizumab的800倍、NK细胞杀伤效率是Monalizumab的 33倍[39]。
6 结语与展望
近年来,一些阻断NKG2A/HLA-E轴的研究都取得了较好的成果,阻断NKG2A信号通路之后,由NKG2A参与所引起的抑制作用得到了缓解,NK、CD8+T细胞的免疫效应有所恢复。多项临床研究结果显示,在多数恶性肿瘤患者体内,NK、CD8+T细胞表面NKG2A的表达上调,与此同时肿瘤细胞表面HLA-E的表达也上调。提示医务工作者可考虑NKG2A、HLA-E的表达异常与肿瘤的发生是否存在某种相关性,或者在将来,这两者可以作为辅助诊断恶性肿瘤的一种预测性标志物。阻断NKG2A治疗肿瘤及其他免疫相关疾病的研究尚不完善。如果希望阻断NKG2A途径成为癌症免疫治疗的新方法,还需继续深入研究NKG2A信号通路。
